Содержание
- 2. Амінокислота Органічна сполука, молекули якої одночасно містять аміно- (-NH2) та карбоксильну (-COOH) групи; Є мономерними одиницями
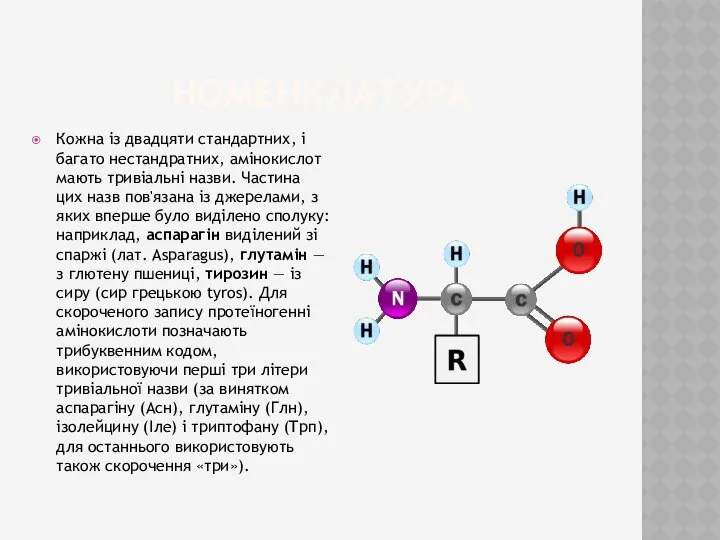
- 3. номенклатура Кожна із двадцяти стандартних, і багато нестандратних, амінокислот мають тривіальні назви. Частина цих назв пов'язана
- 4. Абревіатури амінокислот Для позначення шести амінокислот використані їх початкові літери (в англійській мові), оскільки вони є
- 5. Хімічна будова Усі амінокислоти містять карбоксильну й аміногрупи. В α-амінокислот вони приєднані до одного і того
- 6. “нестандартні амінокислоти” Крім 20 «стандартних» амінокислот, що кодуються генетичним кодом, у живих організмах також трапляється велика
- 7. “нестандартні” амінокислоти 6-N-метиллізин є складовою скоротливого білка міозину. Деякі білки, які зв'язують іони кальцію, наприклад, протромбін,
- 8. “нестандартні” аміноксилоти Всього у живих клітинах зустрічається близько 700 різних амінокислот, багато із яких виконують самостійні
- 9. Функції амінокислот На додаток до синтезу білків, стандартні і нестандартні амінокислоти в тваринному організмі виконують багато
- 10. Функції амінокислот Деякі з 20-ти протеїногенних амінокислот називаються «незамінними» — це такі, що не виробляються в
- 12. Скачать презентацию






 Развитие жизни на Земле
Развитие жизни на Земле Видоизменения побегов
Видоизменения побегов Бактерии. Докембрийский строматолит
Бактерии. Докембрийский строматолит Генетика статі. Хромосомна теорія спадковості
Генетика статі. Хромосомна теорія спадковості Презентация на тему "Генетические опыты Менделя" - скачать бесплатно презентации по Биологии
Презентация на тему "Генетические опыты Менделя" - скачать бесплатно презентации по Биологии Особенности экологической стратегии и биотических связей у микроорганизмов. Лекция 4
Особенности экологической стратегии и биотических связей у микроорганизмов. Лекция 4 Зерновые культуры
Зерновые культуры Выполнила студентка группы Л-911 Чубарева Анастасия Проверил преподаватель – Чернышова Антонина Ивановна
Выполнила студентка группы Л-911 Чубарева Анастасия Проверил преподаватель – Чернышова Антонина Ивановна Лишайники Лишайники обычно pассматpиваются отдельно от гpибов, хотя и пpинадлежат к ним, являясь специализиpованной гpуппой. Они
Лишайники Лишайники обычно pассматpиваются отдельно от гpибов, хотя и пpинадлежат к ним, являясь специализиpованной гpуппой. Они  Ткани человека
Ткани человека Інфекції травної системи. Отруєння
Інфекції травної системи. Отруєння Определение фагоцитарной активности лейкоцитов
Определение фагоцитарной активности лейкоцитов Виды тюльпанов
Виды тюльпанов Отдел Плауновидные и отдел Хвощевидные. Особенности организации, жизненного цикла. Распространение и роль в биоценозах
Отдел Плауновидные и отдел Хвощевидные. Особенности организации, жизненного цикла. Распространение и роль в биоценозах Обеспечение клеток энергией
Обеспечение клеток энергией Зоны корня: деления, растяжения, всасывания, проведения. Кончик корня – корневой чехлик
Зоны корня: деления, растяжения, всасывания, проведения. Кончик корня – корневой чехлик Игра Интеллект. Вопросы о животных
Игра Интеллект. Вопросы о животных Проект Тайны шоколада
Проект Тайны шоколада Пчелка. Пчеловодство
Пчелка. Пчеловодство Красота природы и человека
Красота природы и человека Органы кровеносной и лимфатической систем. Круги кровообращения
Органы кровеносной и лимфатической систем. Круги кровообращения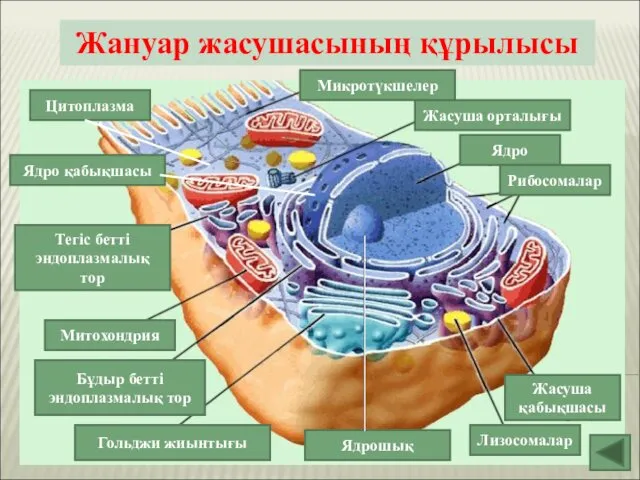 Жануар жасушасының құрылысы
Жануар жасушасының құрылысы Презентация на тему "Могут ли растения чувствовать" - скачать презентации по Биологии
Презентация на тему "Могут ли растения чувствовать" - скачать презентации по Биологии Водорастворимые витамины. (Лекция 13)
Водорастворимые витамины. (Лекция 13) Тема урока: Эритроциты и лейкоциты Цель урока: Выяснить взаимосвязь строения и функций эритроцитов и лейкоцитов.
Тема урока: Эритроциты и лейкоциты Цель урока: Выяснить взаимосвязь строения и функций эритроцитов и лейкоцитов. Гидроидные. Строение
Гидроидные. Строение Кожа и ее производные
Кожа и ее производные Репродуктивная изоляция и ее причины
Репродуктивная изоляция и ее причины