Химия вокруг нас Работа учеников 9 класса «В» МБОУ «СОШ №25» г.Набережные Челны Давлиев Камиль и Юманьков Антон
Содержание
- 2. Меню 11.1.Углеродное волокно ♦ получение ♦ применение 22.2.Тефлон ♦ свойства 33.3.Фосфор ♦получение 44.4.Сода ♦ примечание 55.5.Озон
- 3. Углеродное волокно Углеродное волокно — материал, состоящий из тонких нитей диаметром от 3 до 15 микрон
- 4. УВ добывают после 3-х стадий нагревания. 1-ая стадия, смесь нагревают до 90 градусов. 2-ая стадия, получившуюся
- 5. Применение УВ нашло свое применение в машиностроении из-за своих свойств. УВ обычно получают термической обработкой химических
- 6. Тефлон(Политетрафторэтиле́н) Тефлон применяют в химическойприменяют в химической, электротехнической и пищевой промышленности, в медицине, в транспортных средствах,
- 7. Свойства Физические Тефлон — белое, в тонком слое прозрачное вещество, по виду напоминающее парафин — белое,
- 8. Фосфор Самый распространенный способ применения в быту фосфора, а именно красного фосфора – это спички. Он
- 9. Получение Красный фосфор получают в лабораторных условиях при возгорании белого фосфора без доступа воздуха.
- 10. Сода(Пищевая) NaHCO3 Гидрокарбонат натрия Na NaH NaHC NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия,
- 11. Примечание Сода, из-за своих соединений, очень опасна в плане взрывоопасности. При взаимодействии с огнем, сода начинает
- 12. Озон Озон – тяжёлый газ с сильными окисляющими свойствами. Обладает специфическим запахом и голубоватым оттенком. Химическая
- 13. Применение Тем не менее, при всей своей опасности, озон нередко можно встретить в нашей повседневной жизни.
- 14. Озонотерапия • Однако право использовать озон в медицине до сих пор оспаривается. Существует отдельное направление в
- 15. Аммиак Аммиак — это бесцветный газ с очень резким запахом. Длительное вдыхание аммиака может вызвать смерть.
- 16. Применение • После сжатия и охлаждения аммиак превращается в жидкость, напоминающую воду, но кипящую при температуре
- 17. Применение • Хлорид аммония применяется в сварке, при изготовлении сухих источников питания и в медицине. •
- 18. Применение • В медицине • В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется
- 19. Интересные факты • Некоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать. Например,
- 20. Известь Известь (из греч. (из греч. ἄσβεστος «неугасимый») — материал, получаемый путем обжига (не до расплава)
- 21. Негашёная известь (Оксид кальция) CaO Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической
- 22. Применение • Основные объёмы используются в строительстве при производстве Силикатного кирпича• Основные объёмы используются в строительстве
- 23. Применение • В небольших количествах оксид кальция также используется в лабораторной практике для осушения веществ, которые
- 24. Гашёная известь (Гидроксид кальция) Ca(OH)2 Химическое вещество, сильное основание Химическое вещество, сильное основание. Представляет собой порошок
- 25. Применение • При побелке помещений. • При побелке деревянных заборов и обмазывании стропил — для защиты
- 26. Применение • Для устранения карбонатной жёсткости воды (умягчение воды). Реакция идёт по уравнению: Ca(HCO3)2 + Ca(OH)2
- 27. Применение • Известковая вода — прозрачный раствор гидроксида кальция. Она используется для обнаружения углекислого газа. При
- 28. Применение • В стоматологииВ стоматологии — для дезинфекции корневых каналов зубов.
- 30. Скачать презентацию


























 ПОЛИЭТИЛЕН
ПОЛИЭТИЛЕН  Матчворк Підготувала учениця 11-А класу Шведюк Людмила
Матчворк Підготувала учениця 11-А класу Шведюк Людмила  Коллоидтық химия және беттік құбылыстар химиясының негізгі түсініктемелері
Коллоидтық химия және беттік құбылыстар химиясының негізгі түсініктемелері Степень окисления Автор презентации: учитель химии МОУ лицея «Технический» г. Обнинска Калужской области Яснова Юлия Анатоль
Степень окисления Автор презентации: учитель химии МОУ лицея «Технический» г. Обнинска Калужской области Яснова Юлия Анатоль Количественный анализ. Гравиметрия
Количественный анализ. Гравиметрия Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Ненасыщенные углеводороды этиленового ряда
Ненасыщенные углеводороды этиленового ряда Физико-химическое явление электролиз
Физико-химическое явление электролиз Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Одорант природный
Одорант природный Презентация по Химии "Соли" - скачать смотреть
Презентация по Химии "Соли" - скачать смотреть  Прикладная химия. Теплоперенос в химических реакторах и теплообменники
Прикладная химия. Теплоперенос в химических реакторах и теплообменники Химическая связь. Строение веществ
Химическая связь. Строение веществ Исследование состава и свойств минеральной воды Авторы:
Исследование состава и свойств минеральной воды Авторы:  Викторина «Своя игра» в рамках декады по биологии, географии и химии
Викторина «Своя игра» в рамках декады по биологии, географии и химии  Растворы. Часть 2
Растворы. Часть 2 Сложные реакции
Сложные реакции Пиридин. Строение пиридина
Пиридин. Строение пиридина Фотосинтез. Суммарное уравнение, общий вид
Фотосинтез. Суммарное уравнение, общий вид Виды полимеризации
Виды полимеризации Коллоидная химия
Коллоидная химия Капилярлық конденсация. Дәріс 14
Капилярлық конденсация. Дәріс 14 Биохимия нервной ткани. Биологические мембраны
Биохимия нервной ткани. Биологические мембраны Валентность связи и локальный баланс валентности
Валентность связи и локальный баланс валентности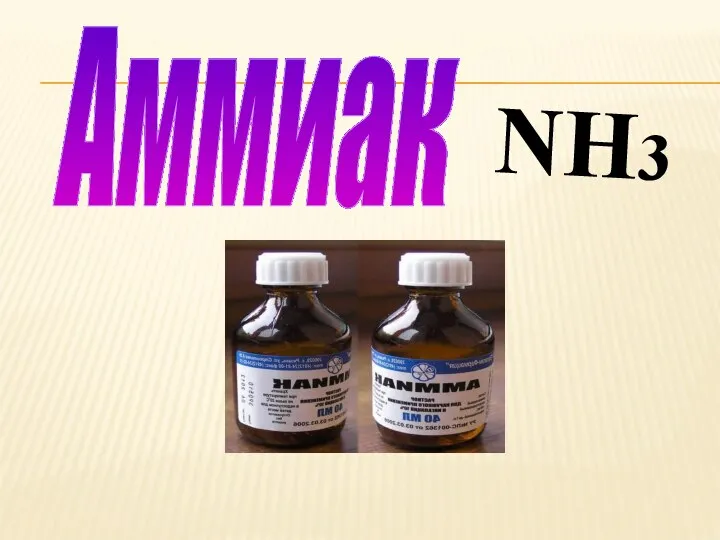 Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Метаболизм процесіндегі липидтер мен нуклеин қышқылдарының орны
Метаболизм процесіндегі липидтер мен нуклеин қышқылдарының орны Алкадиены. Физические свойства
Алкадиены. Физические свойства Презентация по Химии "Основные классы неорганических соединений" - скачать смотреть
Презентация по Химии "Основные классы неорганических соединений" - скачать смотреть