Содержание
- 2. Перекисное Окисление Липидов
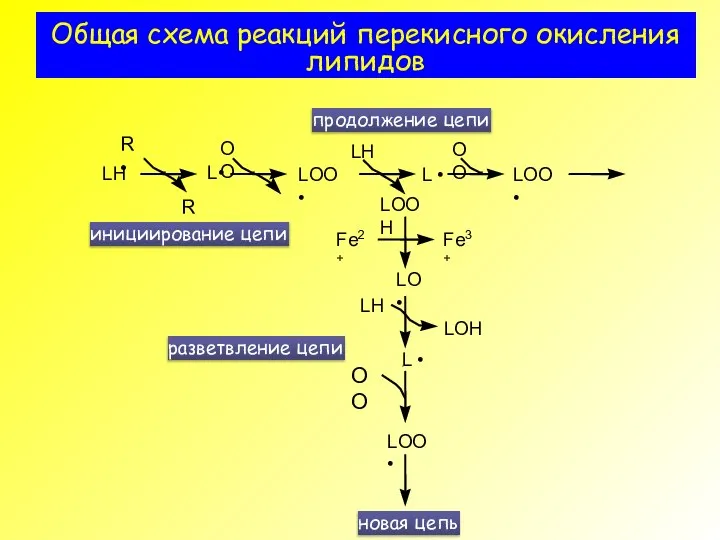
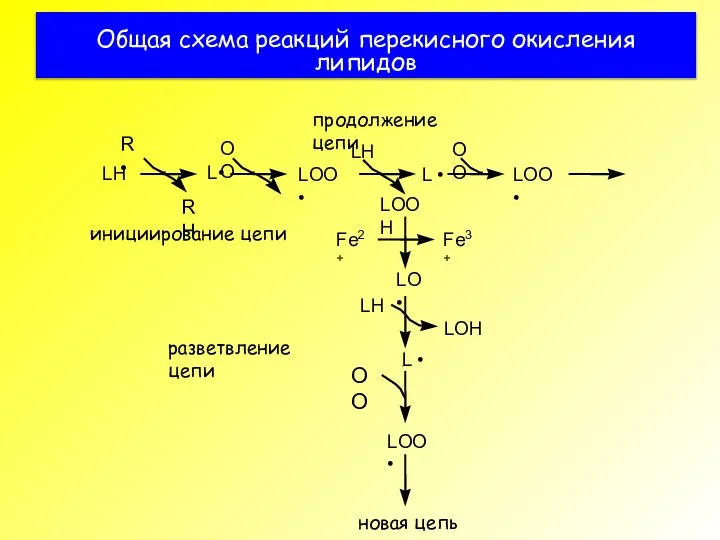
- 3. Общая схема реакций перекисного окисления липидов
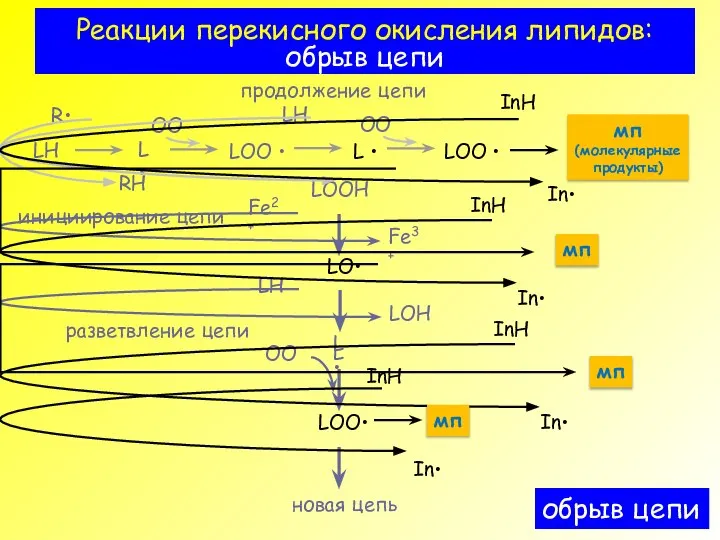
- 4. Реакции перекисного окисления липидов: обрыв цепи
- 5. Уравнения реакций цепного окисления липидов
- 6. Анализ кинетики ПОЛ
- 7. Уравнения реакций цепного окисления липидов
- 8. Уравнения реакций цепного окисления липидов
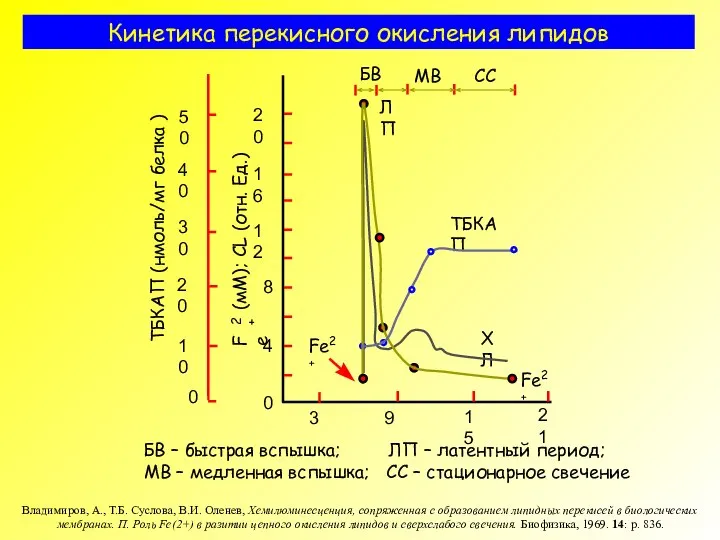
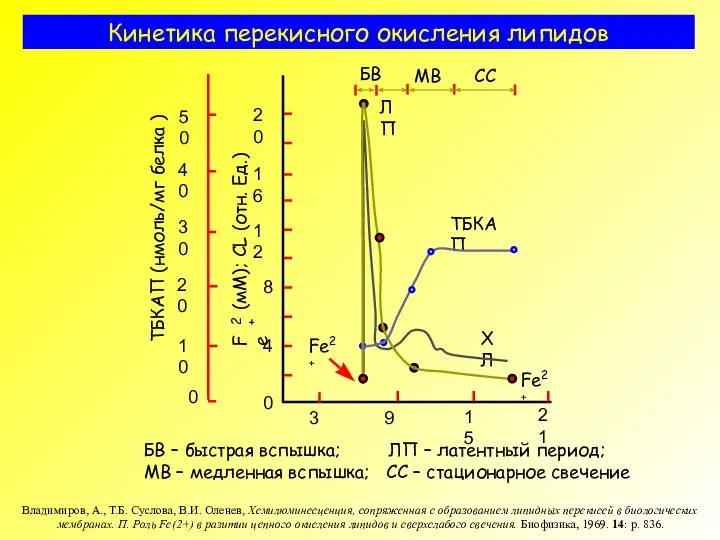
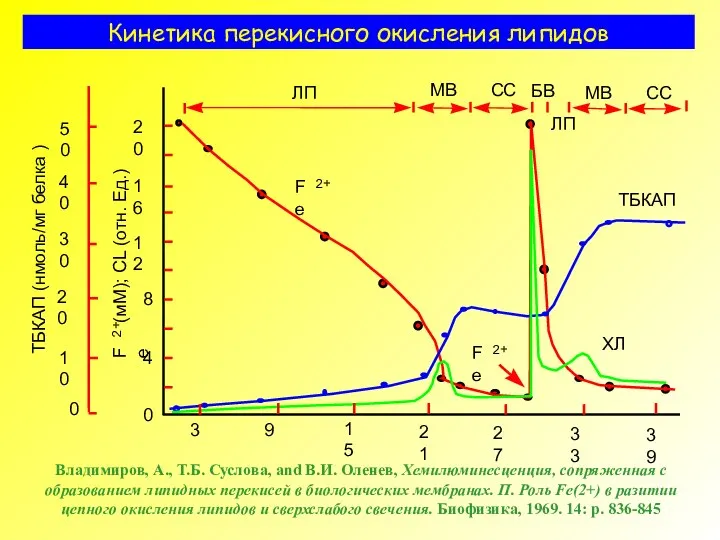
- 9. Кинетика перекисного окисления липидов БВ – быстрая вспышка; ЛП – латентный период; МВ – медленная вспышка;
- 10. Упрощение схемы химических реакций Правило 1: Скорость нескольких последовательных реакций равна скорости самой медленной из них
- 11. Уравнения реакций цепного окисления липидов
- 12. Скорость нескольких последовательных реакций равна скорости самой медленной из них Пример 1: Вместо двух реакций продолжения
- 13. Уравнения реакций цепного окисления липидов
- 14. Уравнения реакций цепного окисления липидов
- 15. Скорость нескольких параллельных реакций в основном определяется самой быстрой из них Пример 1: Скорость образования радикалов
- 16. Уравнения реакций цепного окисления липидов
- 17. Уравнения реакций цепного окисления липидов
- 18. Пример 4: Вместо четырех реакций обрыва цепи оставим две, идущие в отсутствие ингибитора: Скорость нескольких параллельных
- 19. Упрощенная схема реакций перекисного окисления липидов из 5 реакций O2 + е- + LH → …
- 20. Пример 2: Скорость реакции обрыва цепей определяется двумя параллельно идущими реакциями: Fe2+ + L· + H+
- 21. Уравнения реакций цепного окисления липидов
- 22. Уравнения реакций цепного окисления липидов
- 23. Упрощенная схема реакций перекисного окисления липидов из 3 реакций L· + O2 (+ LH) → LOOH
- 24. Дифференциальные уравнения кинеткики в системе трех реакций
- 25. Стационарное приближение Боденштейна – Семенова
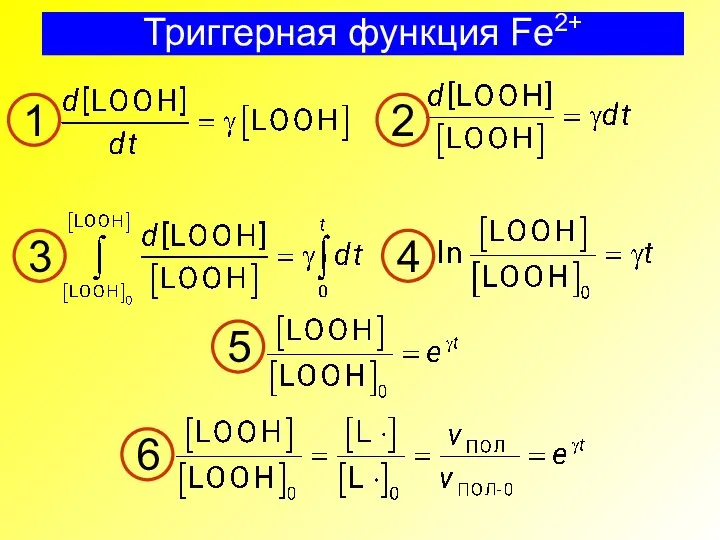
- 26. Триггерная функция Fe2+ 1 2 3 4 5 6
- 27. Триггерная функция Fe2+ При γ = 0 При [Fe2+] > [Fe2+] *, γ γ = kp([Fe2+]*
- 28. Железо как про- и антиоксидант [Fe2+] > [Fe2+] * γ [Fe2+] γ > 0 Скорость цепного
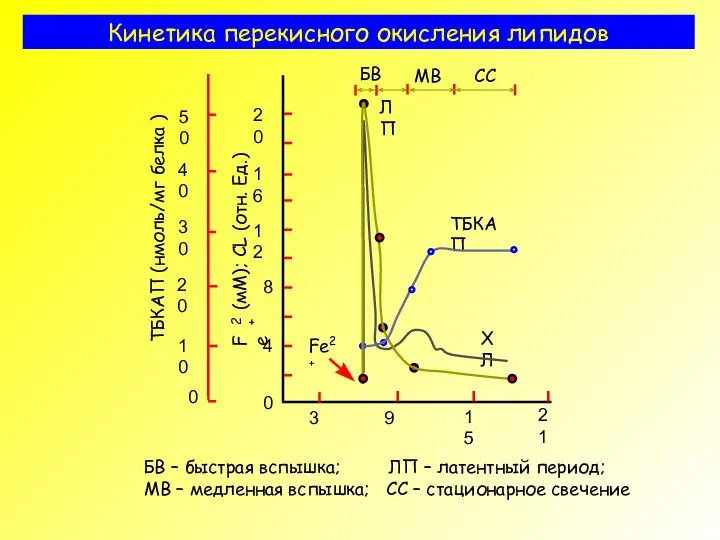
- 29. Кинетика перекисного окисления липидов БВ – быстрая вспышка; ЛП – латентный период; МВ – медленная вспышка;
- 30. Хемилюминесценция при перекисном окислении липидов
- 31. Общая схема реакций перекисного окисления липидов
- 32. Уравнения реакций цепного окисления липидов
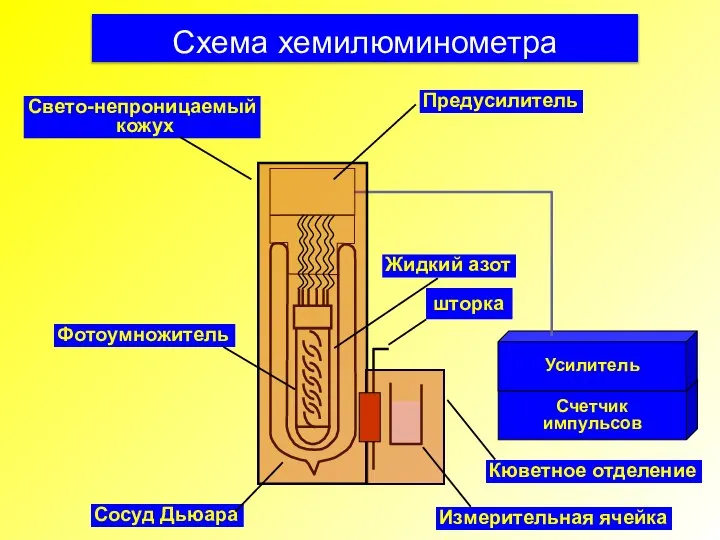
- 33. Схема хемилюминометра
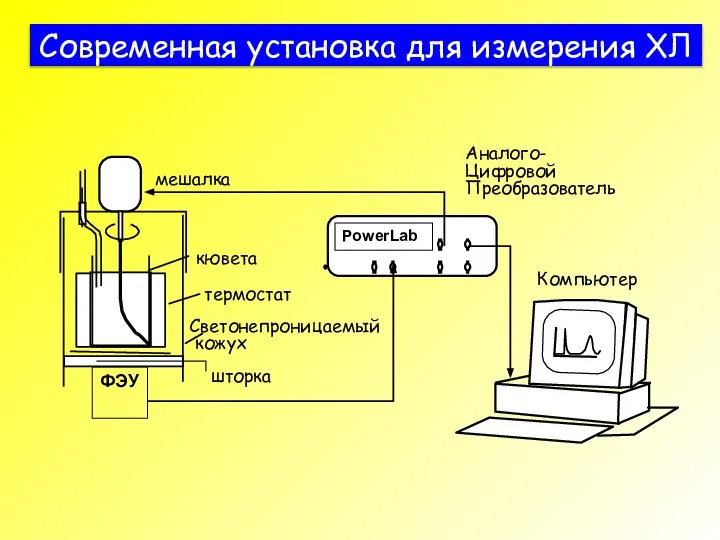
- 34. Современная установка для измерения ХЛ
- 35. Кинетика перекисного окисления липидов Владимиров, А., Т.Б. Суслова, and В.И. Оленев, Хемилюминесценция, сопряженная с образованием липидных
- 36. Кинетика перекисного окисления липидов БВ – быстрая вспышка; ЛП – латентный период; МВ – медленная вспышка;
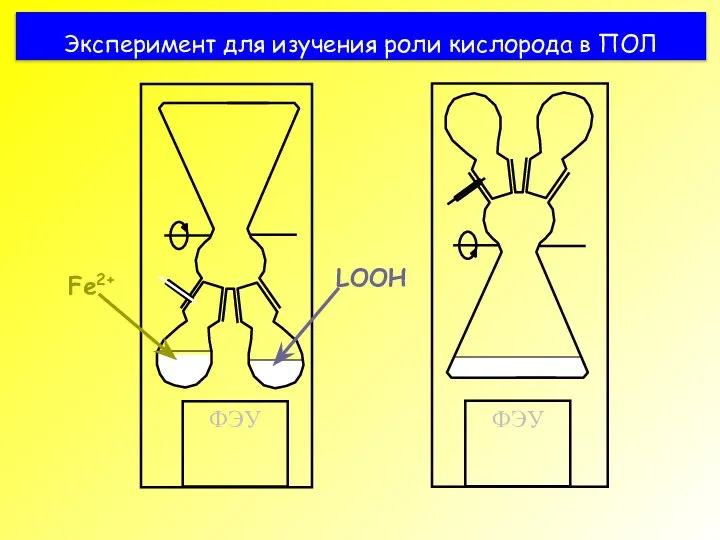
- 37. Эксперимент для изучения роли кислорода в ПОЛ
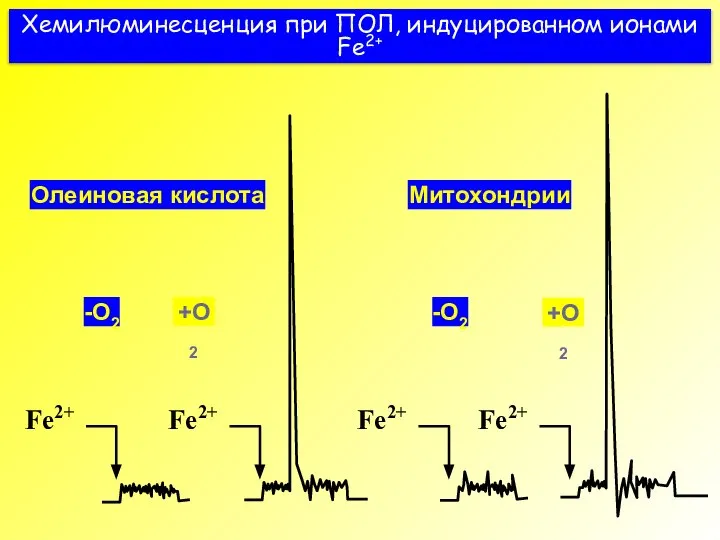
- 38. Хемилюминесценция при ПОЛ, индуцированном ионами Fe2+ Олеиновая кислота -O2 +O2 Митохондрии +O2 -O2
- 39. Реакции ПОЛ, протекающие в присутствии и в отсутствие О2 Без кислорода: Fe2+ + LOOH ⇒ Fe3+
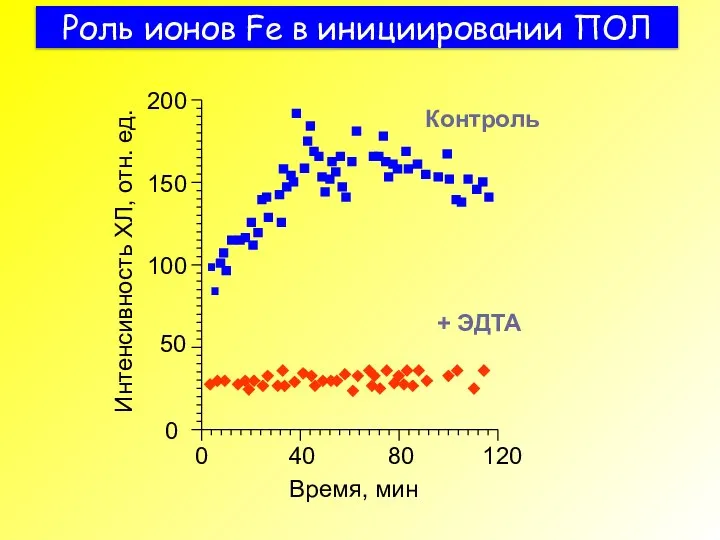
- 40. Роль ионов Fe в инициировании ПОЛ
- 41. Кинетика ХЛ (быстрая вспышка) при различных [Fe2+]
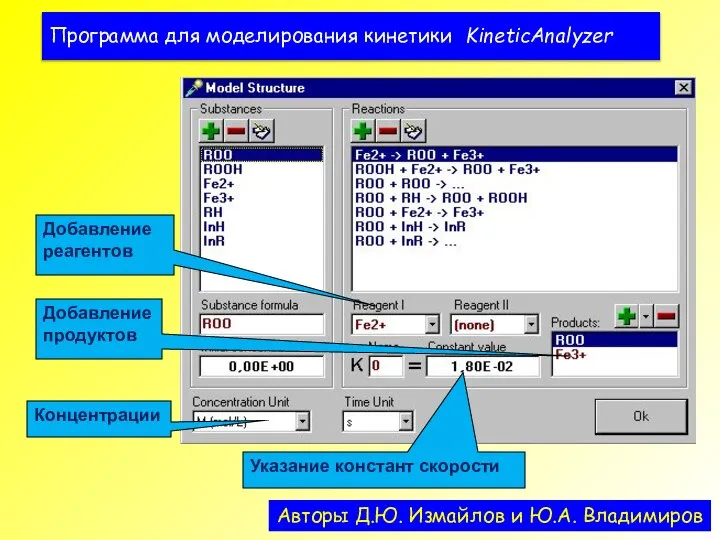
- 42. Программа для моделирования кинетики KineticAnalyzer Авторы Д.Ю. Измайлов и Ю.А. Владимиров
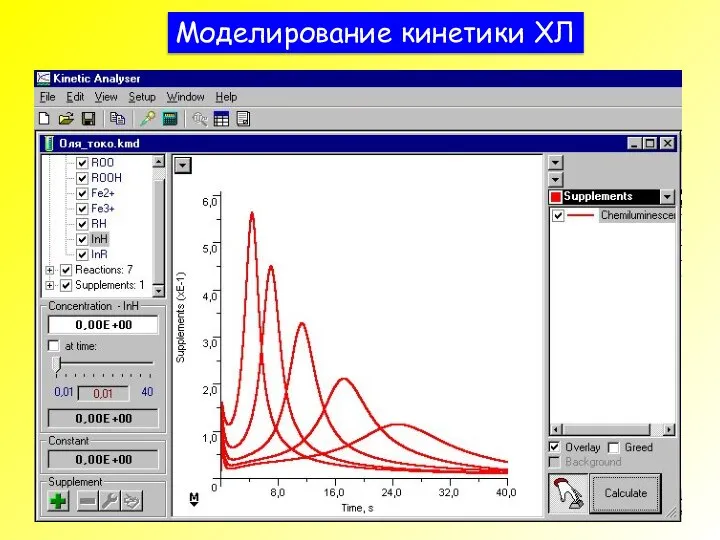
- 43. Моделирование кинетики ХЛ
- 44. Сравнение кинетики ХЛ (медленная вспышка) и ее модели при разных [Fe2+] Измеренные кривые Рассчитанные кривые
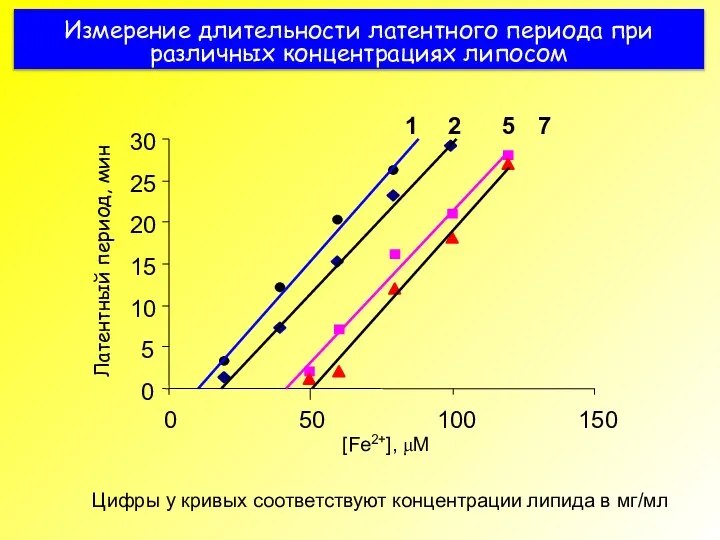
- 45. Измерение длительности латентного периода при различных концентрациях липосом
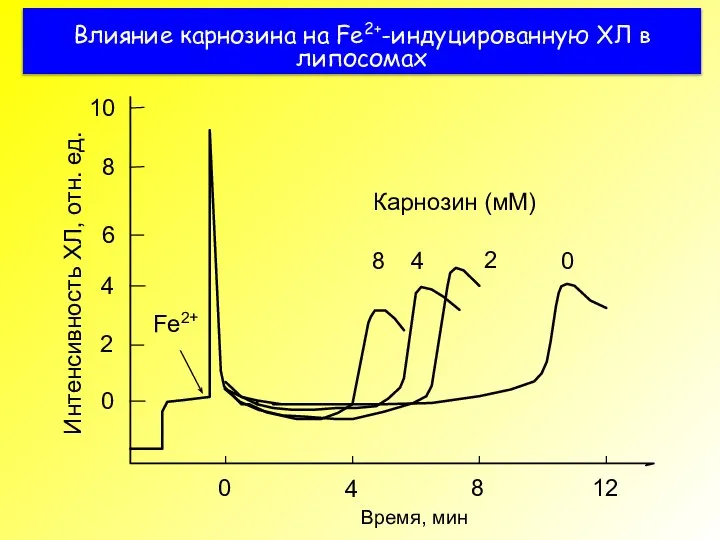
- 46. Влияние карнозина на Fe2+-индуцированную ХЛ в липосомах
- 48. Скачать презентацию





















![Триггерная функция Fe2+ При γ = 0 При [Fe2+] > [Fe2+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/630987/slide-26.jpg)
![Железо как про- и антиоксидант [Fe2+] > [Fe2+] * γ [Fe2+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/630987/slide-27.jpg)



![Кинетика ХЛ (быстрая вспышка) при различных [Fe2+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/630987/slide-40.jpg)
![Сравнение кинетики ХЛ (медленная вспышка) и ее модели при разных [Fe2+] Измеренные кривые Рассчитанные кривые](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/630987/slide-43.jpg)
 Царство Растения. Кружок Горизонты биологии: система живых организмов
Царство Растения. Кружок Горизонты биологии: система живых организмов Презентация на тему Ткани растений Урок биологии 6 класс
Презентация на тему Ткани растений Урок биологии 6 класс Презентация на тему Зима в лесу
Презентация на тему Зима в лесу Онтогенез. Гаметогенез: сперматогенез и оогенез. Систематика. Вирусы. Жизненный цикл вируса
Онтогенез. Гаметогенез: сперматогенез и оогенез. Систематика. Вирусы. Жизненный цикл вируса Кайнозойская эра Предмет: Биология Пре
Кайнозойская эра Предмет: Биология Пре Скелет человека. Соединения костей. 8 класс
Скелет человека. Соединения костей. 8 класс Маскировка животных
Маскировка животных Повторение строения и свойств изученных органических соединений
Повторение строения и свойств изученных органических соединений  Подводное путешествие Тайны морского дна
Подводное путешествие Тайны морского дна Мышечная система
Мышечная система Транспорт липидов. Сложные липиды и стероиды
Транспорт липидов. Сложные липиды и стероиды Физиологические взаимодействия между растениями
Физиологические взаимодействия между растениями Биосинтез белка
Биосинтез белка Красная панда - блестящий зверек
Красная панда - блестящий зверек Презентация на тему Культивирование клеток
Презентация на тему Культивирование клеток Знаменитые растения Крыма
Знаменитые растения Крыма Просо. Описание сортов
Просо. Описание сортов Строение и функции центральной нервной системы
Строение и функции центральной нервной системы Презентация на тему "Человек умелый Homo Habilis" - скачать презентации по Биологии
Презентация на тему "Человек умелый Homo Habilis" - скачать презентации по Биологии Любимая порода собак моей мамы
Любимая порода собак моей мамы Физиологические особенности сенсорной системы в онтогенезе
Физиологические особенности сенсорной системы в онтогенезе Аттестационная работа. Внеурочная деятельность. Проект Домашние животные
Аттестационная работа. Внеурочная деятельность. Проект Домашние животные Тип Arthropoda Членистоногие. Класс Ostracoda Остракоды (кембрий – кватер) (Ракушняковые раки)
Тип Arthropoda Членистоногие. Класс Ostracoda Остракоды (кембрий – кватер) (Ракушняковые раки) Презентация на тему "Отдел Голосеменные" - скачать презентации по Биологии
Презентация на тему "Отдел Голосеменные" - скачать презентации по Биологии Вторая сигнальная система. Дельфин
Вторая сигнальная система. Дельфин Водоросли
Водоросли ЛИШАЙНИКИ
ЛИШАЙНИКИ Ознакомление детей дошкольного возраста с животным миром родного края
Ознакомление детей дошкольного возраста с животным миром родного края