Содержание
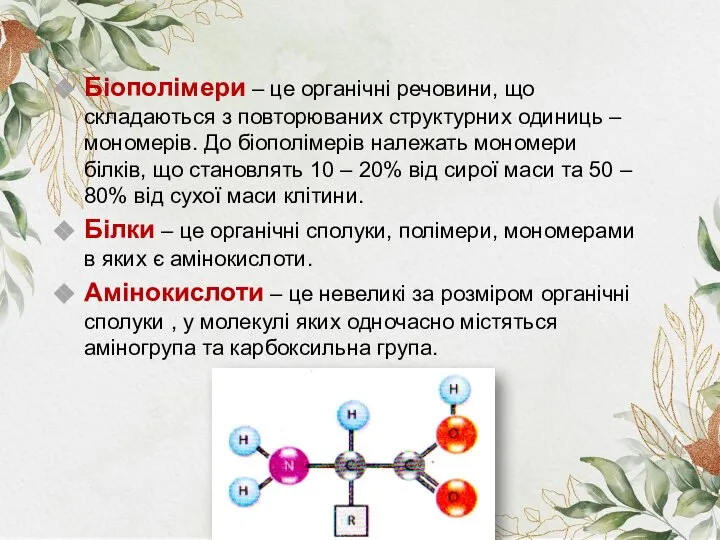
- 2. Біополімери – це органічні речовини, що складаються з повторюваних структурних одиниць – мономерів. До біополімерів належать
- 3. Білки – це високомолекулярні природні полімери, молекули яких побудовані із залишків амінокислот, з'єднаних пептидними групами Число
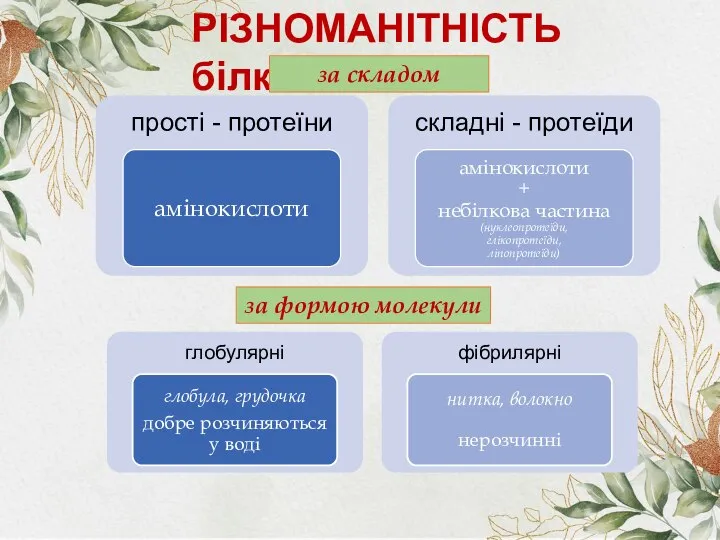
- 4. РІЗНОМАНІТНІСТЬ білків за складом за формою молекули
- 5. До складу білкових речовин входять: Карбон, Гідроген, Оксиген, Нітроген, Сульфур, Фосфор. Гемоглобін – C3032H4816O872N780S8Fe4. Молекулярна маса
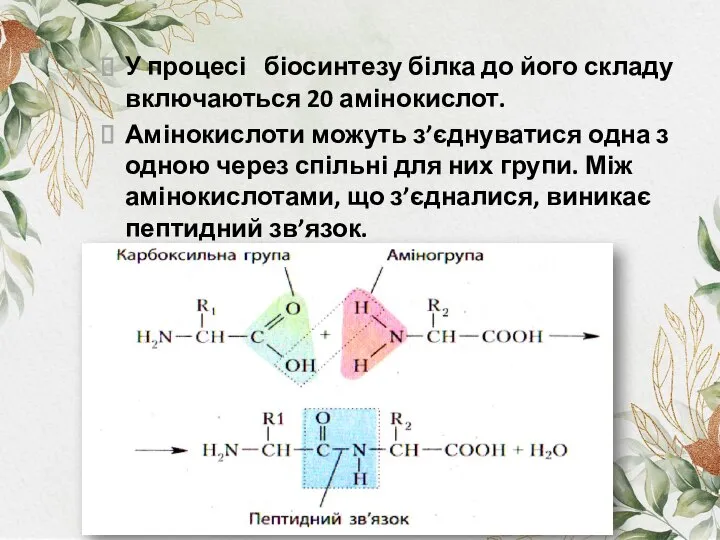
- 6. У процесі біосинтезу білка до його складу включаються 20 амінокислот. Амінокислоти можуть з’єднуватися одна з одною
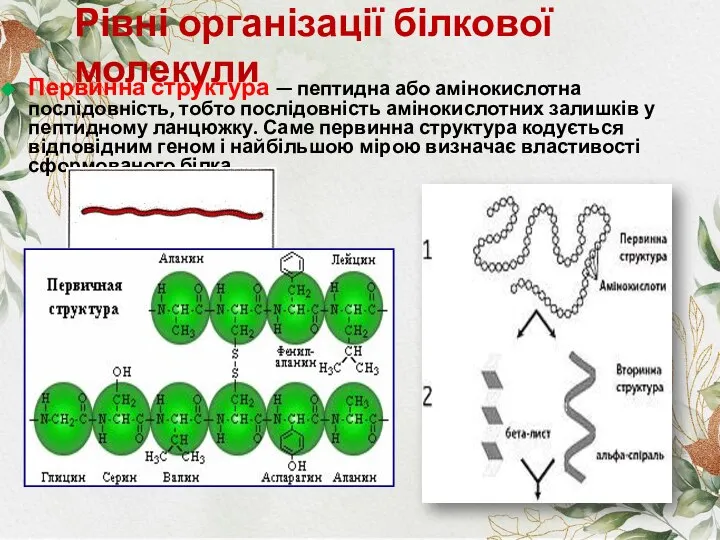
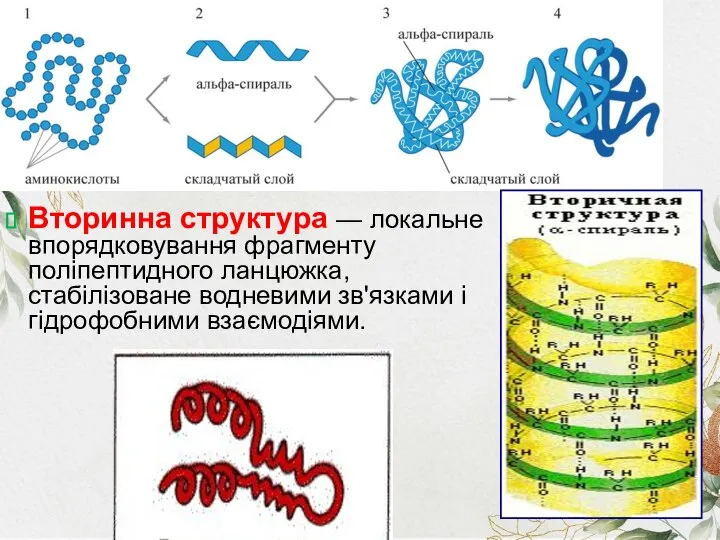
- 7. Рівні організації білкової молекули Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у
- 8. Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями.
- 9. Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної.
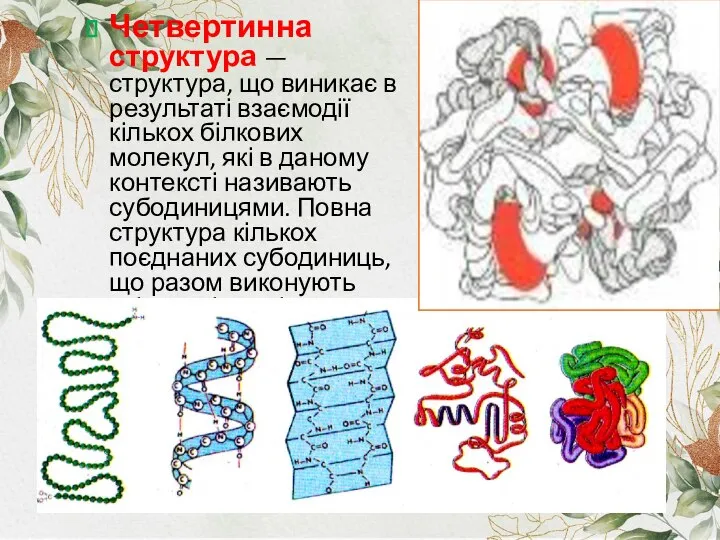
- 10. Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті
- 11. Хімічні властивості білків Денатурація (згортання, втрата природних властивостей, зберігається первинна структура білка) Чинники денатурації: концентровані кислоти
- 12. Функції білків в організмі Будівельна – вони є основою біологічних мембран. З білків складаються мікротрубочки та
- 13. Сигнальна – здатність “розпізнавати” специфічні хімічні сполуки і певним чином на них реагувати. Скорочувальна – забезпечує
- 15. Скачать презентацию






 Тема: Вредные привычки. Курение
Тема: Вредные привычки. Курение Презентация на тему "Популяционные аспекты паразитизма" - скачать бесплатно презентации по Биологии
Презентация на тему "Популяционные аспекты паразитизма" - скачать бесплатно презентации по Биологии Виртуальный гербарий
Виртуальный гербарий 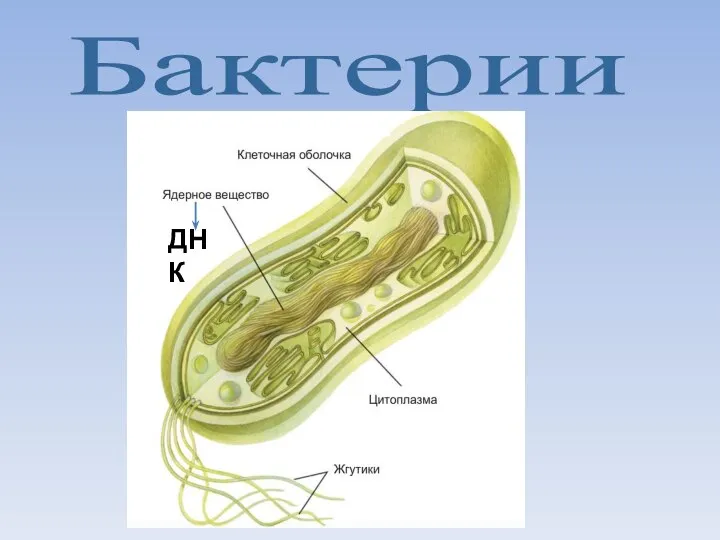 Бактерии. Строение бактериальной клетки
Бактерии. Строение бактериальной клетки Ретровирусы и ретровирусные векторы МГУ В.С. Прасолов
Ретровирусы и ретровирусные векторы МГУ В.С. Прасолов Биологически активные вещества. Витамины
Биологически активные вещества. Витамины Обмен аминокислот. Дезаминирование и трансаминирование аминокислот. Обезвреживание аммиака. Образование и выведение мочевины
Обмен аминокислот. Дезаминирование и трансаминирование аминокислот. Обезвреживание аммиака. Образование и выведение мочевины Хвороба Ебола Підготувала Учениця 11-А Безнощенко Валентина
Хвороба Ебола Підготувала Учениця 11-А Безнощенко Валентина  Хімічні елементи, які входять до складу живих організмів
Хімічні елементи, які входять до складу живих організмів Презентация на тему Гнездование птиц Сезонное изменение в природе
Презентация на тему Гнездование птиц Сезонное изменение в природе Скелет человека
Скелет человека Размножение растительной клетки. Общая характеристика
Размножение растительной клетки. Общая характеристика Эйкозаноиды и их функция
Эйкозаноиды и их функция Презентация на тему "Скелет" - скачать бесплатно презентации по Биологии
Презентация на тему "Скелет" - скачать бесплатно презентации по Биологии Как прекрасен этот мир
Как прекрасен этот мир Естественный отбор – главная движущая сила эволюции
Естественный отбор – главная движущая сила эволюции Тип Кольчатые черви
Тип Кольчатые черви (фрагмент урока)
(фрагмент урока)  Антропогенез Откуда взялись люди на Земле?
Антропогенез Откуда взялись люди на Земле?  Николай Алексеевич Заболоцкий
Николай Алексеевич Заболоцкий Ссавці. Парнокопитні. Жирафові. Жирафа степова
Ссавці. Парнокопитні. Жирафові. Жирафа степова  Самые необычные насекомые В природе огромное множество насекомых, многие из которых имеют очень интересные и необычные формы.
Самые необычные насекомые В природе огромное множество насекомых, многие из которых имеют очень интересные и необычные формы.  Тип круглые черви, класс нематоды
Тип круглые черви, класс нематоды Строение эукариотической клетки
Строение эукариотической клетки Урок 21. Про кошек и собак
Урок 21. Про кошек и собак Тема урока: Происхождение человека. Место человека в системе органического мира.
Тема урока: Происхождение человека. Место человека в системе органического мира. Нуклеиновые кислоты Презентация по биологии
Нуклеиновые кислоты Презентация по биологии  Красная книга. Taxiphyllum alternans (таксифиллум чередующийся)
Красная книга. Taxiphyllum alternans (таксифиллум чередующийся)