Содержание
- 2. Открытие вирусов 1892 год Д.И.Ивановский – инфекционный фильтрующийся агент, вызывающий табачную мозаику. 1898 год M.Beijerinck -
- 3. Ретровирусы
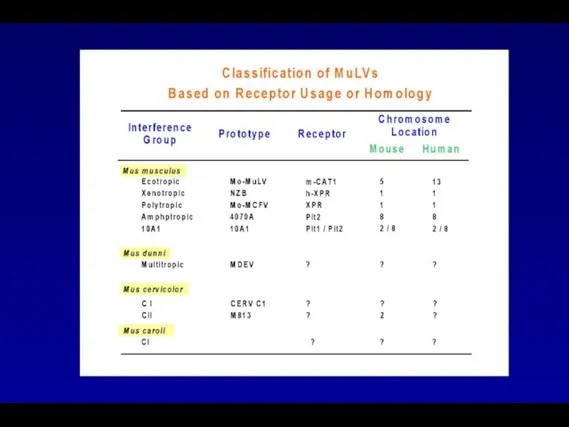
- 4. Классификация ретровирусов
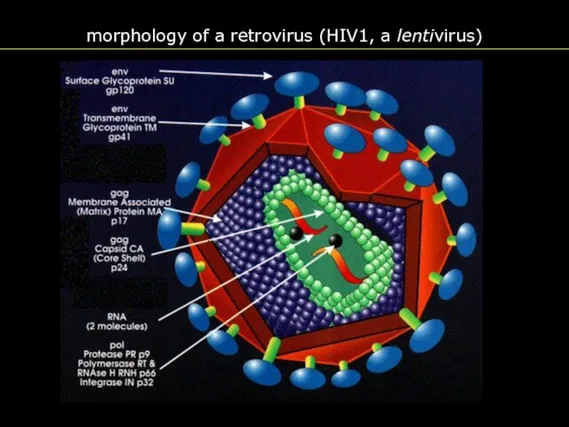
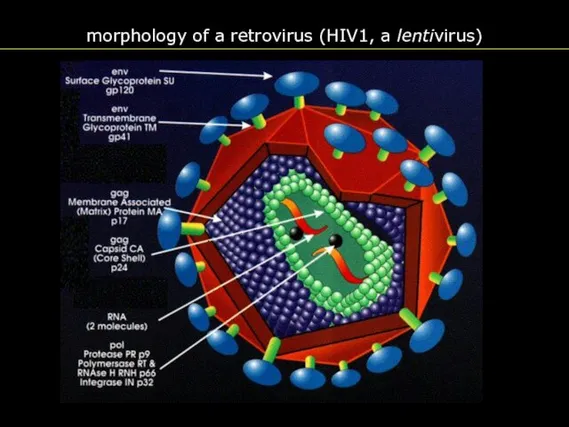
- 5. morphology of a retrovirus (HIV1, a lentivirus)
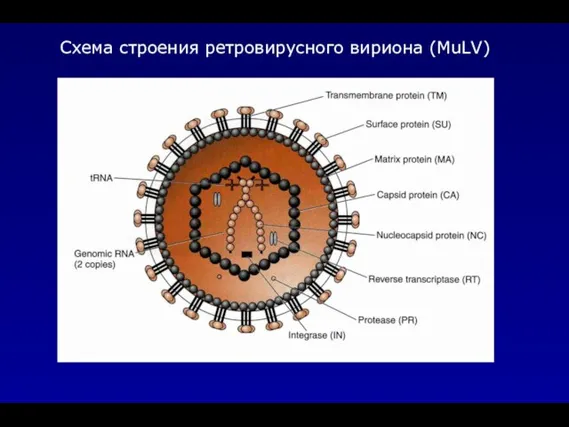
- 6. Схема строения ретровирусного вириона (MuLV)
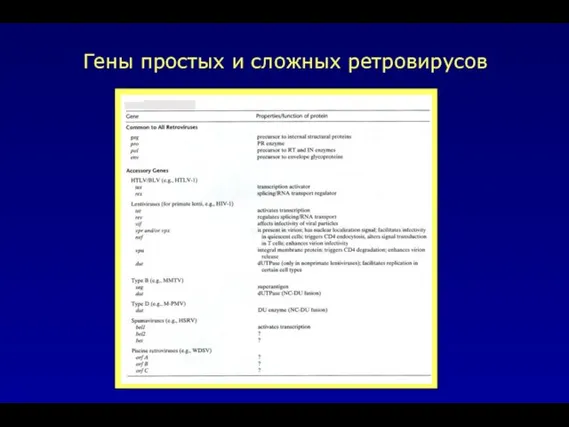
- 7. Гены простых и сложных ретровирусов
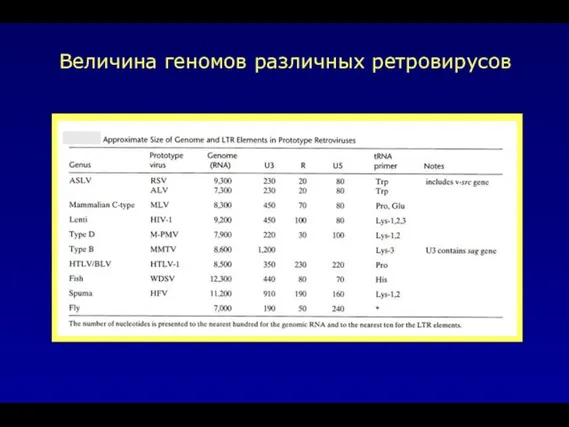
- 8. Величина геномов различных ретровирусов
- 9. Структура геномной РНК простого ретровируса
- 10. Геномная организация различных ретровирусов
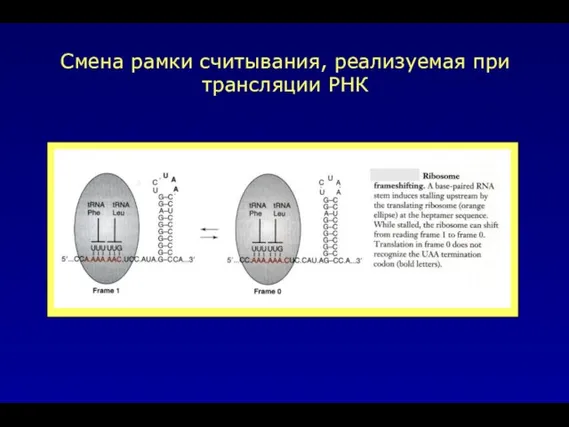
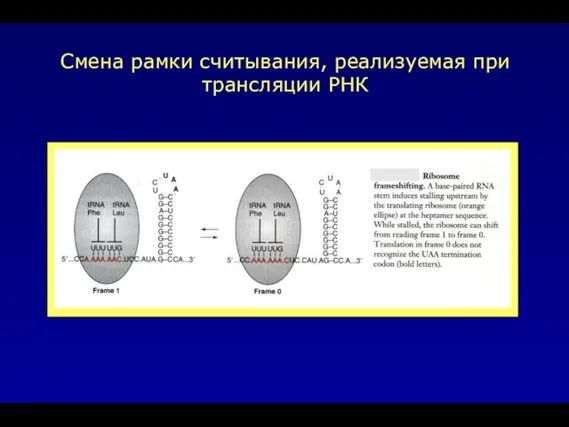
- 11. Смена рамки считывания, реализуемая при трансляции РНК
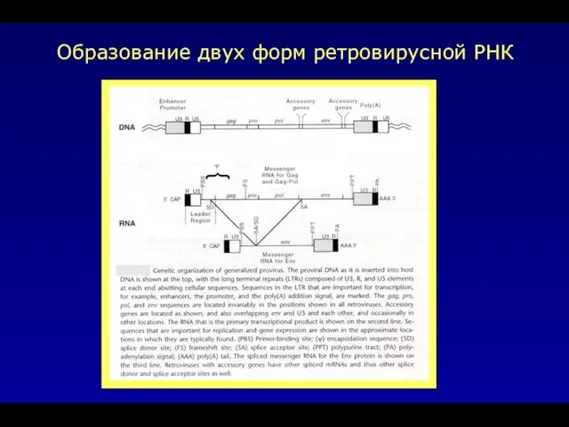
- 12. Образование двух форм ретровирусной РНК
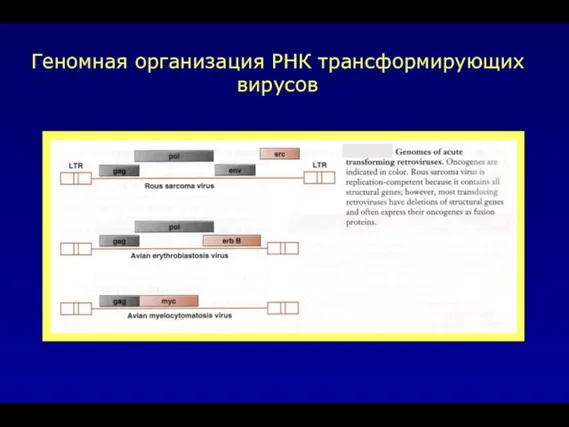
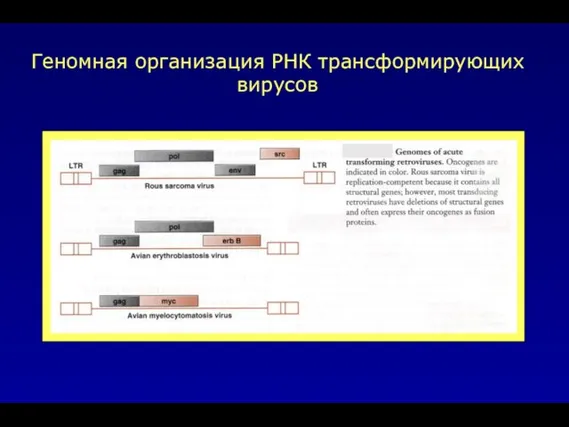
- 13. Геномная организация РНК трансформирующих вирусов
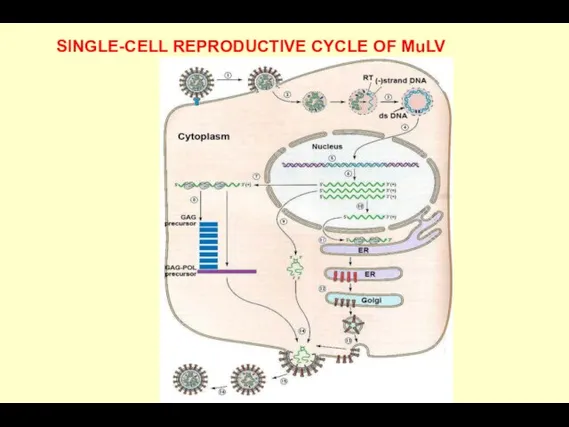
- 14. SINGLE-CELL REPRODUCTIVE CYCLE OF MuLV
- 15. Организация белков оболочки различных ретровирусов
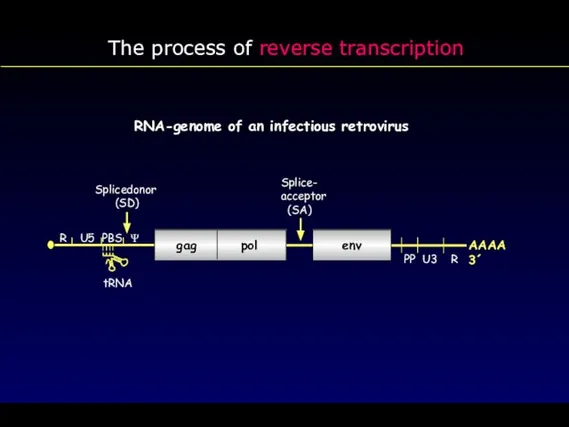
- 16. RNA-genome of an infectious retrovirus tRNA gag pol env Splicedonor (SD) Splice- acceptor (SA) Ψ R
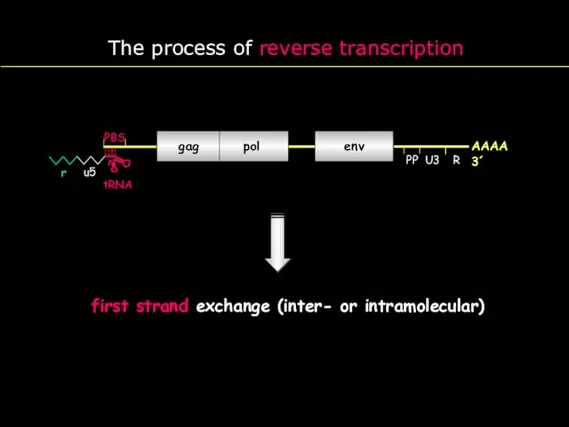
- 17. gag pol env R U5 PBS PP U3 R AAAA 3´ The process of reverse transcription
- 18. gag pol env PP U3 R AAAA 3´ The process of reverse transcription PBS r u5
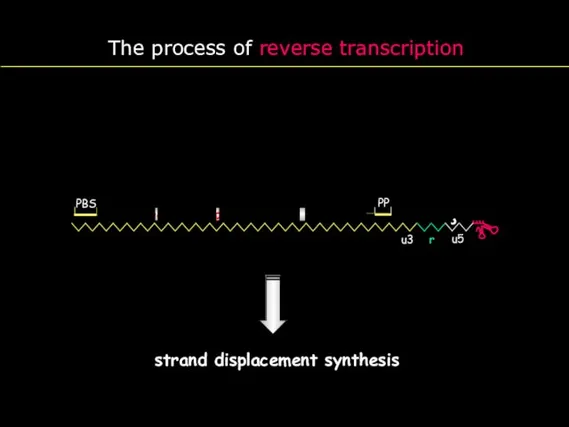
- 19. The process of reverse transcription
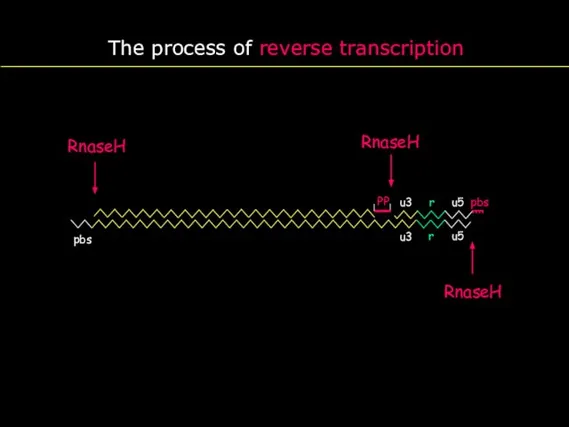
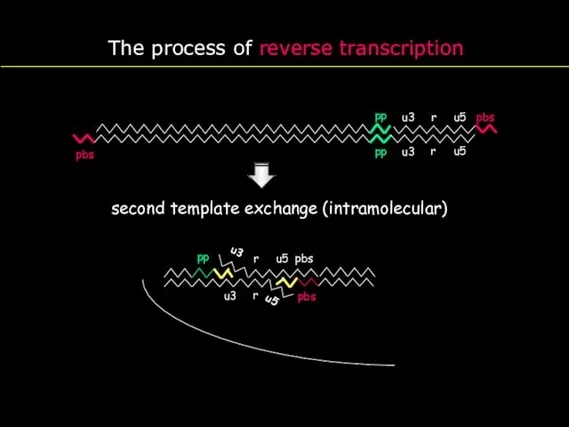
- 20. The process of reverse transcription u3 r u5 pbs r u5 PBS u3 pbs pp pp
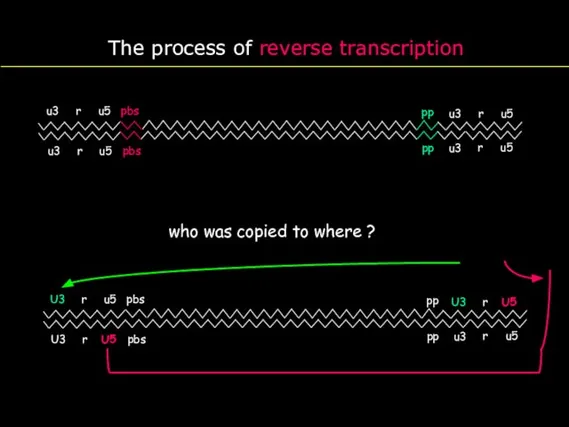
- 21. The process of reverse transcription who was copied to where ?
- 22. Схема обратной транскрипции
- 23. Genomic organization of murine retroviruses
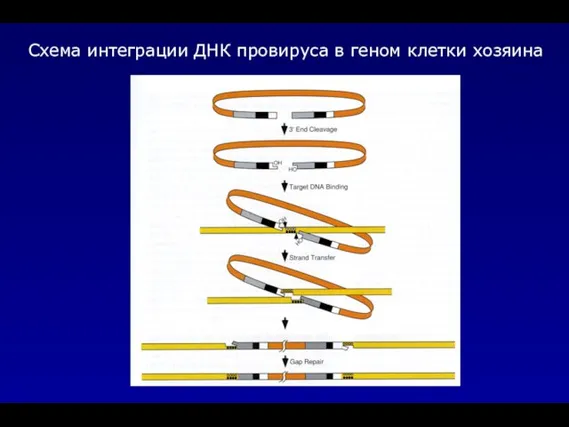
- 24. Схема интеграции ДНК провируса в геном клетки хозяина
- 25. Схема интеграции провируса в геномную ДНК клетки-хозяина
- 26. Образование молекул РНК простого ретровируса
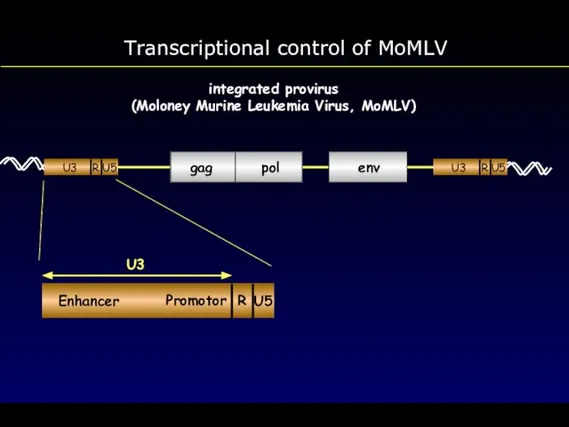
- 27. Transcriptional control of MoMLV integrated provirus (Moloney Murine Leukemia Virus, MoMLV)
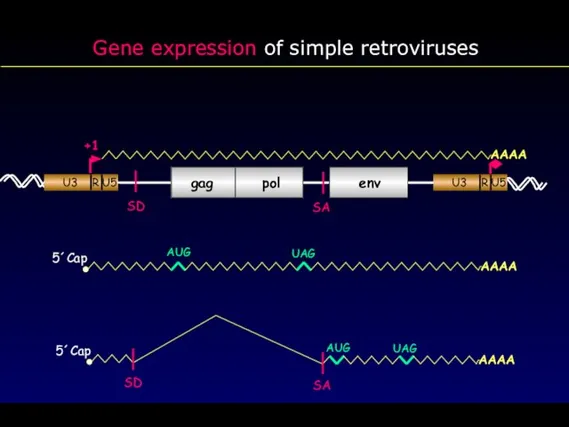
- 28. Gene expression of simple retroviruses gag pol env AAAA
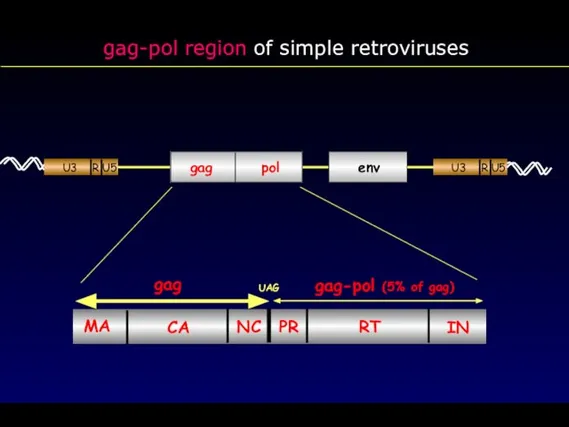
- 29. gag-pol region of simple retroviruses
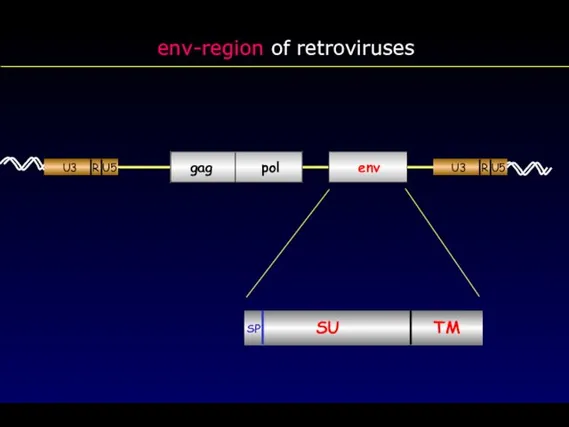
- 30. env-region of retroviruses
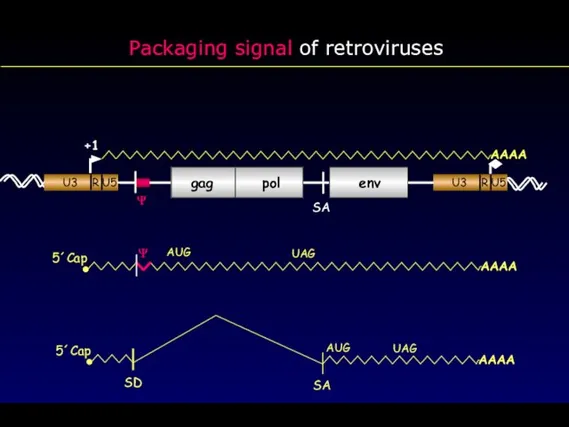
- 31. Packaging signal of retroviruses 5´Cap AUG UAG gag pol env +1 AAAA SA
- 32. Смена рамки считывания, реализуемая при трансляции РНК
- 33. Геномная организация РНК трансформирующих вирусов
- 34. Лентивирусы – возбудители медленных инфекций
- 35. morphology of a retrovirus (HIV1, a lentivirus)
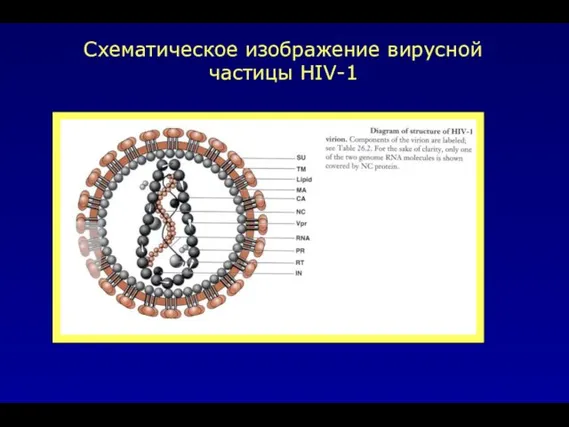
- 36. Схематическое изображение вирусной частицы HIV-1
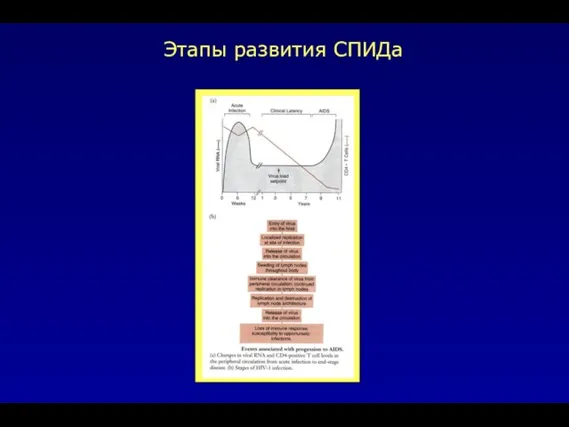
- 37. Этапы развития СПИДа
- 38. Лентивирусы млекопитающих
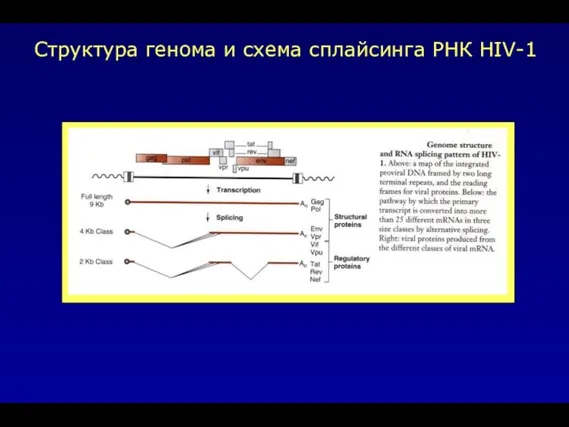
- 39. Структура генома и схема сплайсинга РНК HIV-1
- 40. Структурные белки HIV-1
- 41. Неструктурные белки HIV-1
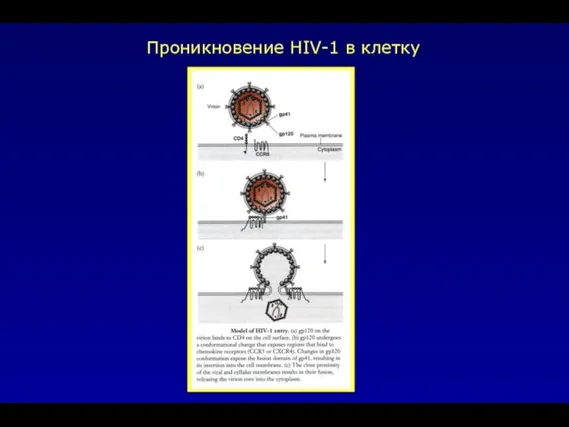
- 42. Проникновение HIV-1 в клетку
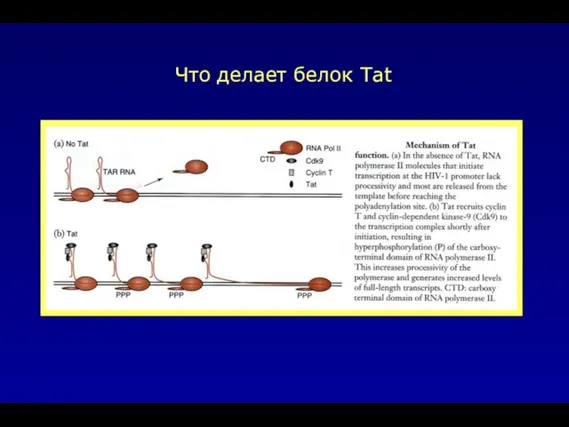
- 43. Что делает белок Tat
- 44. Зачем нужен белок Rev
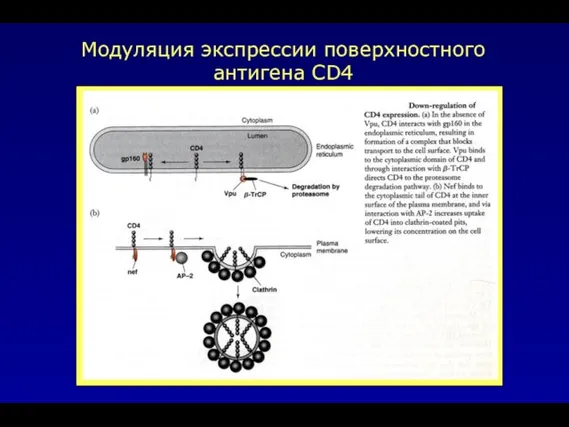
- 45. Модуляция экспрессии поверхностного антигена CD4
- 46. Функции вирусных белков 1.Белок Tat увеличивает транскрипцию провирусного генома HIV-1, стимулируя элонгаторную активность РНК-полимеразы II. 2.Белок
- 47. Вирус Т-клеточного лейкоза 1 типа человека
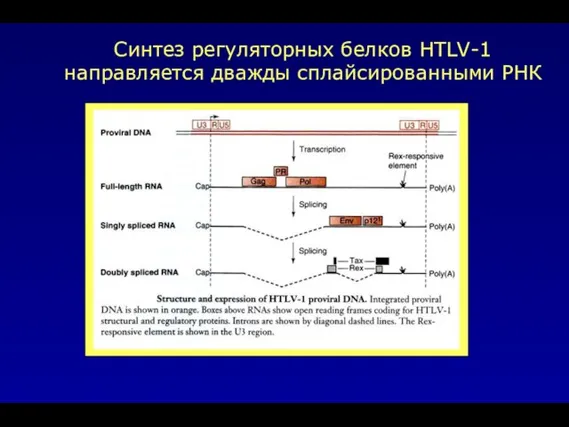
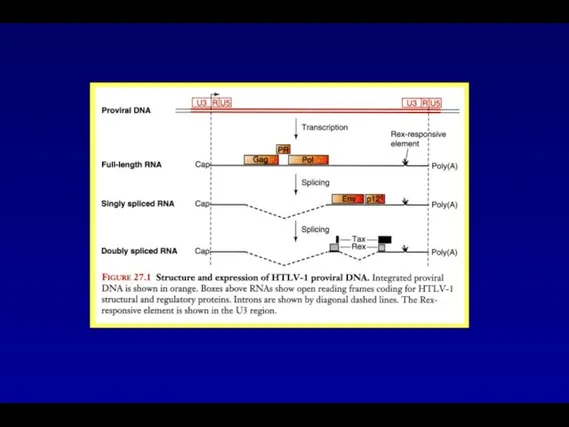
- 48. Синтез регуляторных белков HTLV-1 направляется дважды сплайсированными РНК
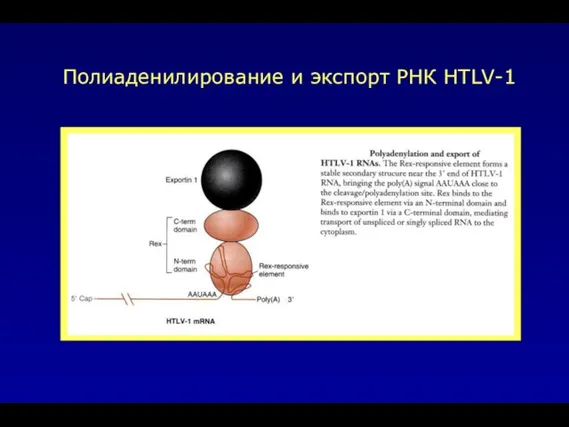
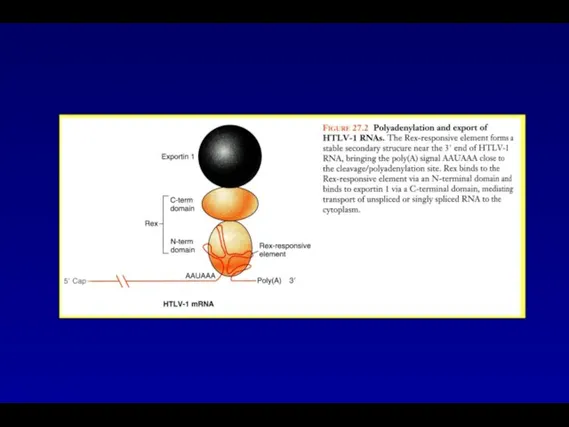
- 49. Полиаденилирование и экспорт РНК HTLV-1
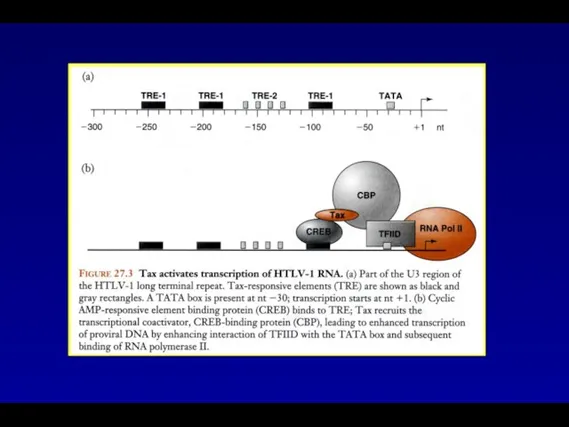
- 50. Белок Tax активирует транскрипцию РНК HTLV-1
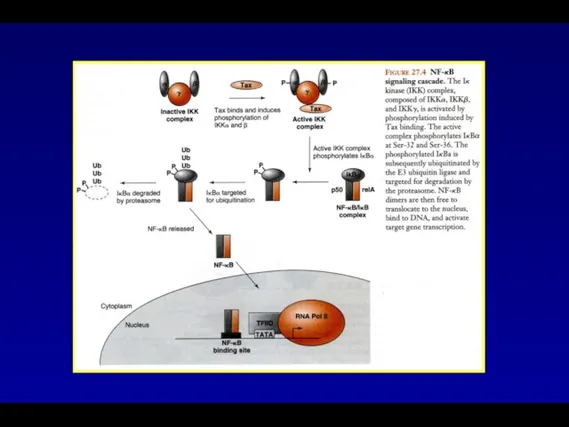
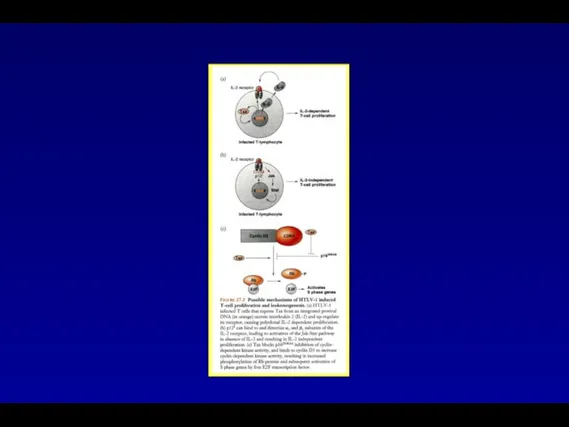
- 51. Клеточные гены, активируемые вирусным белком Tax
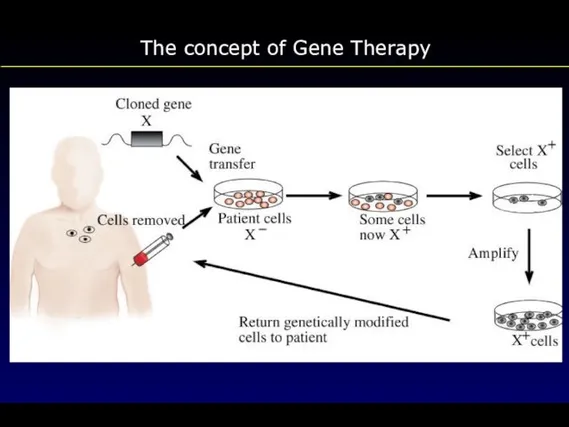
- 60. The concept of Gene Therapy
- 61. Необходимые свойства эффективной системы переноса и экспрессии гена Высокая эффективность переноса выбранного генетического материала в клетки-мишени(in
- 62. Выбор метода переноса и экспрессии целевых генов
- 63. Выбор метода переноса и экспрессии целевых генов (продолжение)
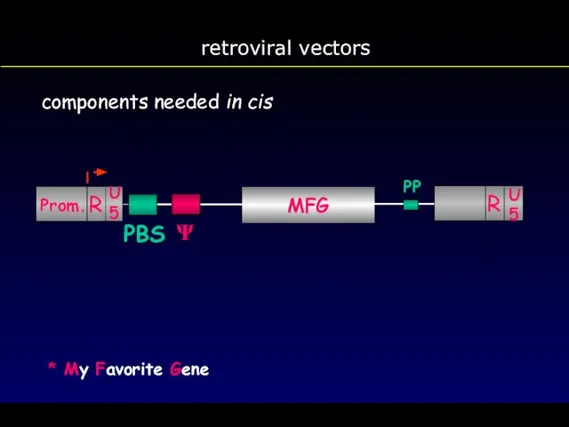
- 64. retroviral vectors components needed in cis MFG * My Favorite Gene U 5
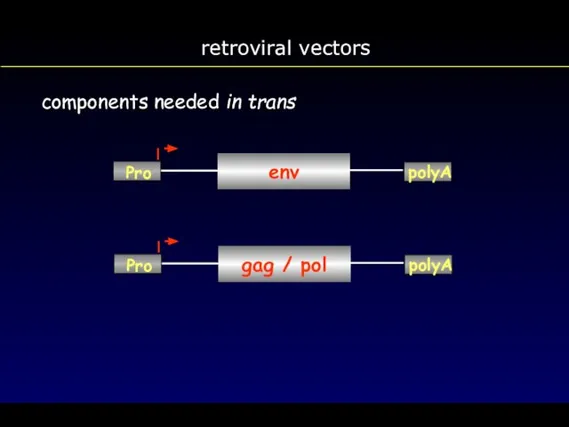
- 65. retroviral vectors components needed in trans
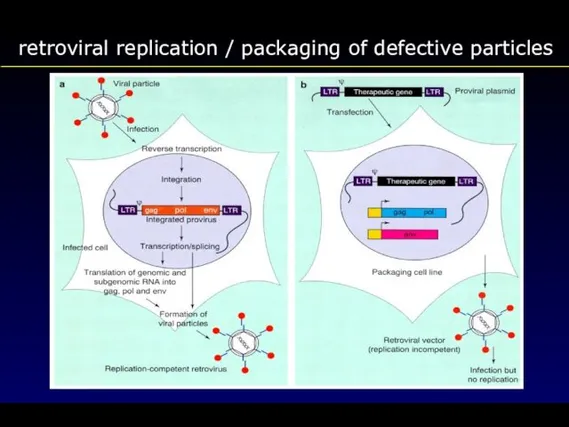
- 66. retroviral replication / packaging of defective particles
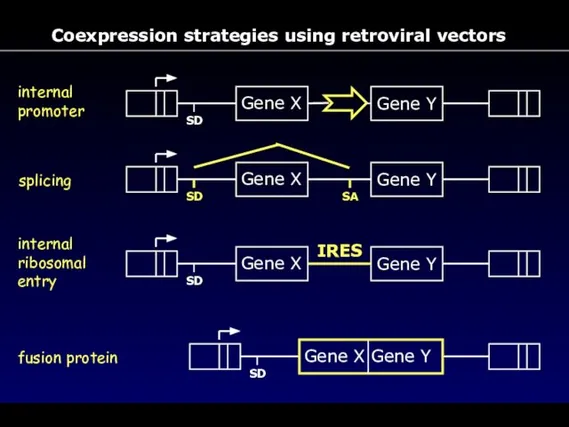
- 67. Coexpression strategies using retroviral vectors
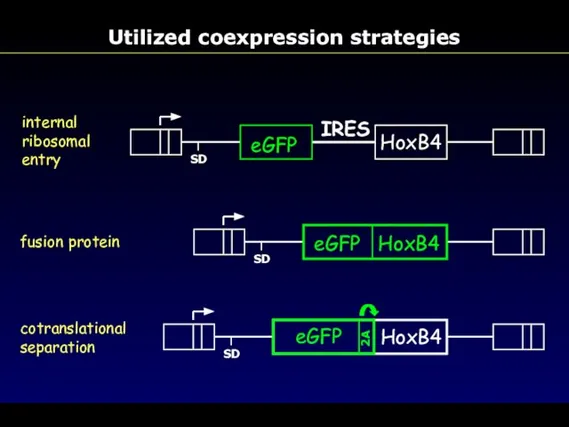
- 68. Utilized coexpression strategies HoxB4 eGFP SD internal ribosomal entry IRES fusion protein eGFP HoxB4 SD eGFP
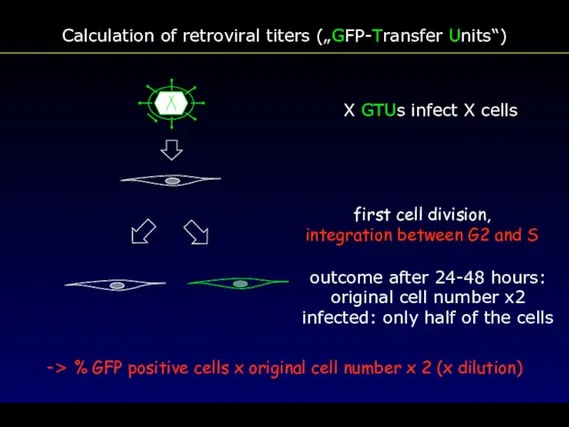
- 69. Calculation of retroviral titers („GFP-Transfer Units“) -> % GFP positive cells x original cell number x
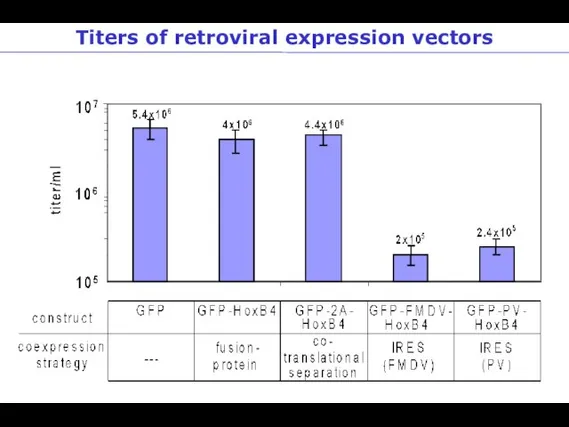
- 70. Titers of retroviral expression vectors
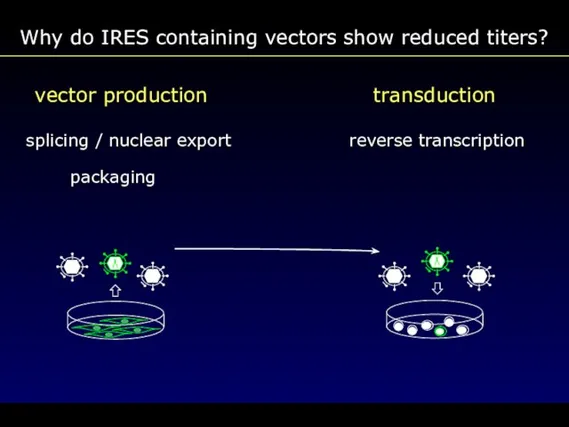
- 71. vector production transduction splicing / nuclear export reverse transcription packaging
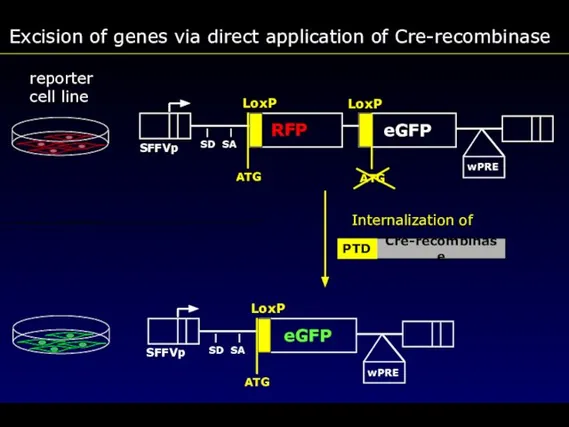
- 73. Excision of genes via direct application of Cre-recombinase reporter cell line
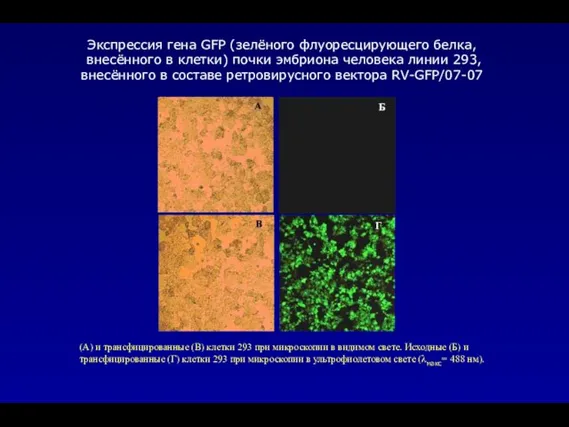
- 76. В процессе работы были получены ретровирусные векторы содержащие в своем составе в качестве маркерного гена ген
- 77. (А) и трансфицированные (В) клетки 293 при микроскопии в видимом свете. Исходные (Б) и трансфицированные (Г)
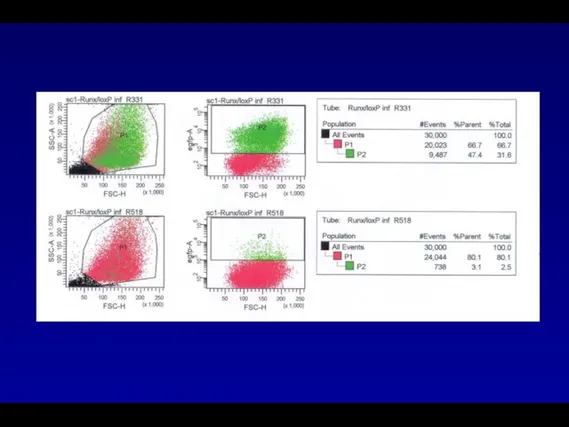
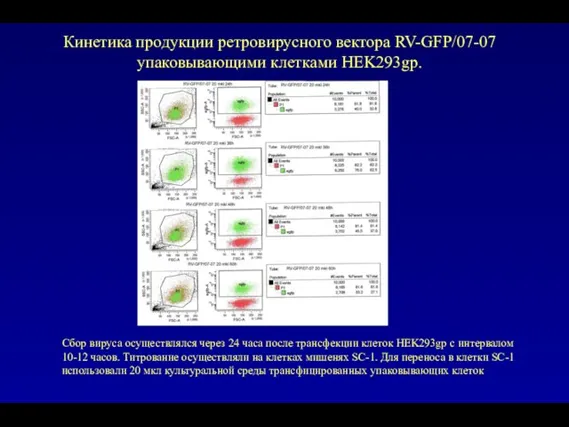
- 78. Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками HEK293gp. Сбор вируса осуществлялся через 24 часа после трансфекции
- 79. Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками HEK293gp. Для переноса использовали 100 мкл культуральной среды трансфицированных
- 80. Создание клеток продуцентов (перевиваемых фибробластов мыши) секретируемого гормона роста человека с помощью ретровирусного вектора RV-GFP/ 07-07.
- 81. Продукция гормона роста человека перевиваемыми клетками мыши линии SC1, трансдуцированных ретровирусным вектором R-hGH-IRES-eGFP Электрофоретической разделение в
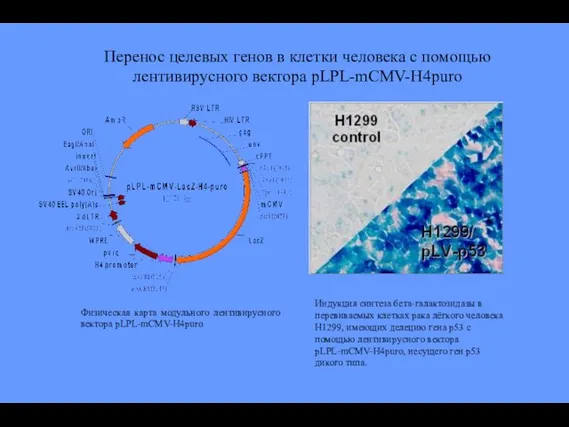
- 82. Физическая карта модульного лентивирусного вектора pLPL-mCMV-H4puro Индукция синтеза бета-галактозидазы в перевиваемых клетках рака лёгкого человека H1299,
- 83. Схема конструкции для экспрессии зеленого флуоресцентного белка с локализацией в эндоплазматическом ретикулуме, на основе нового лентивирусного
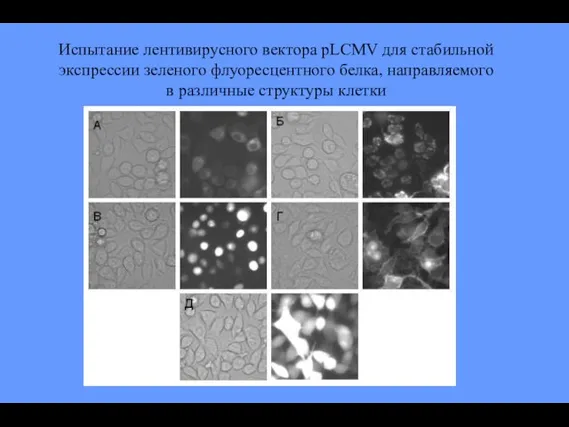
- 84. Испытание лентивирусного вектора pLCMV для стабильной экспрессии зеленого флуоресцентного белка, направляемого в различные структуры клетки
- 85. Retroviral vectors most commonly used gene transfer system in gene therapy genome integration ensures stable long-term
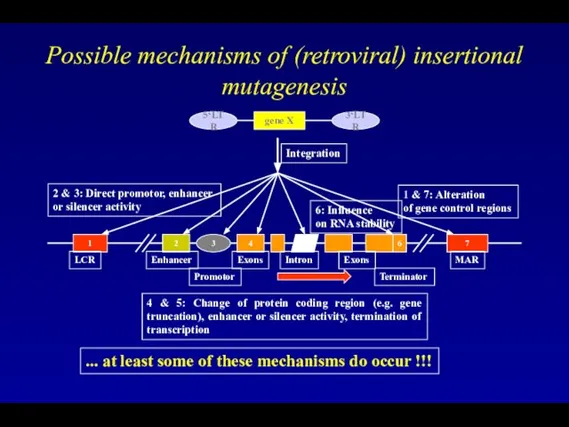
- 86. Possible mechanisms of (retroviral) insertional mutagenesis gene X 5‘LTR 3‘LTR 1 2 3 4 5 7
- 87. ... theoretical risk assessment Starting cell number: 108 Target cell number: 1x109 (1x107 per kg) Transduction
- 88. Схематическое изображение структурно-функциональных изменений ретровирусного вектора, приводящих к делециям в промоторно-энхансерных областях обоих LTR а) -
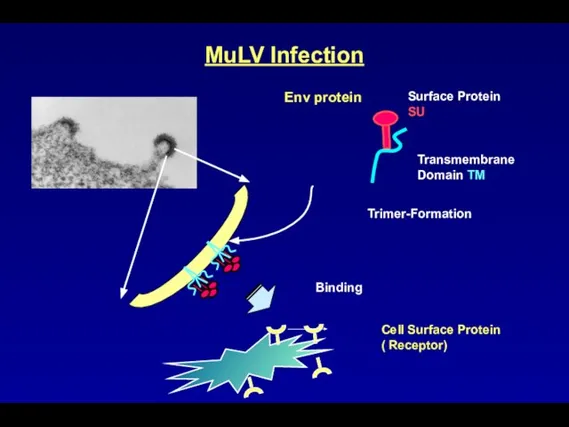
- 89. Env protein Transmembrane Domain TM Surface Protein SU Cell Surface Protein ( Receptor) Binding Trimer-Formation MuLV
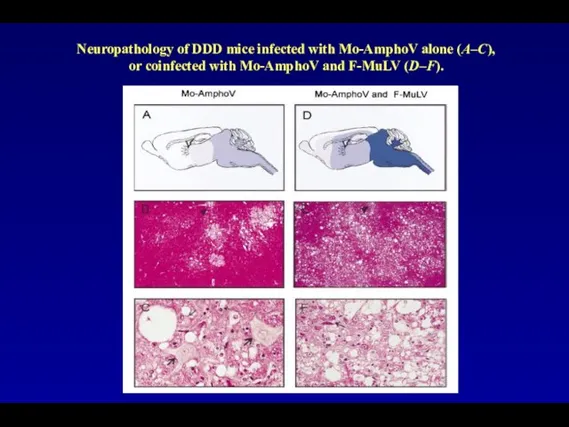
- 90. Neuropathology of DDD mice infected with Mo-AmphoV alone (A–C), or coinfected with Mo-AmphoV and F-MuLV (D–F).
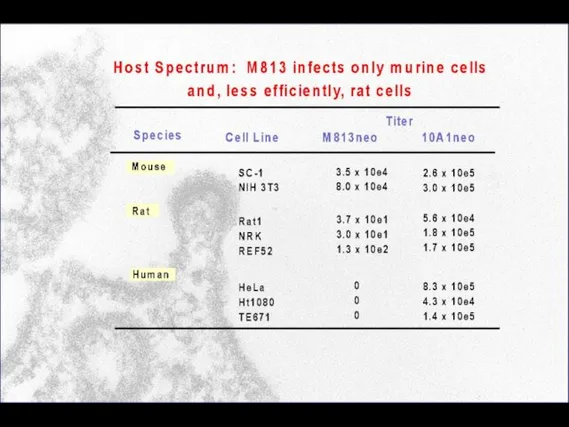
- 94. M813 expression slightly interferences with ecotropic MuLV infection but not with other MuLVs
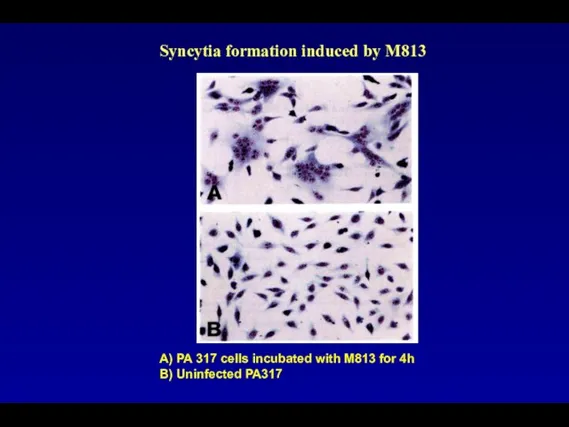
- 95. А) PA 317 cells incubated with M813 for 4h B) Uninfected PA317 Syncytia formation induced by
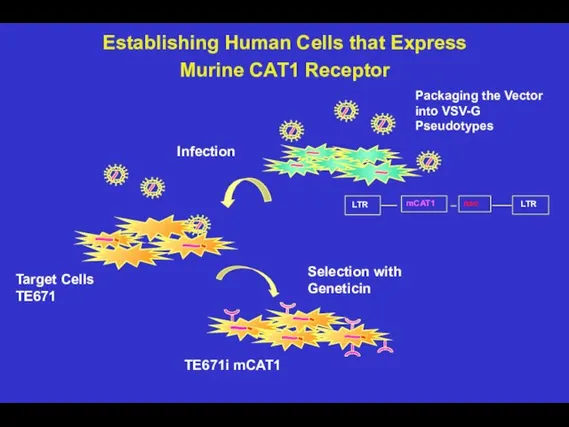
- 96. Selection with Geneticin Target Cells TE671 Infection Packaging the Vector into VSV-G Pseudotypes TE671i mCAT1 Establishing
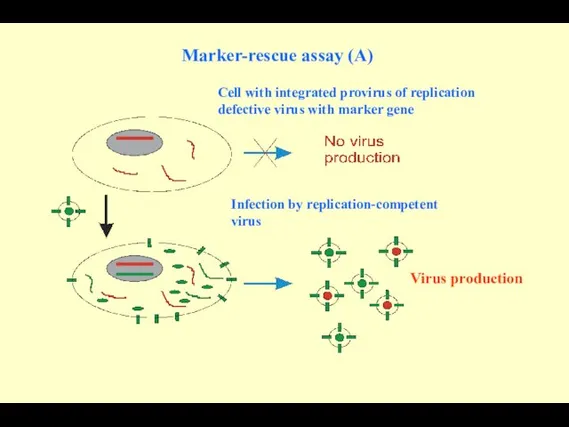
- 97. Marker-rescue assay (A) Cell with integrated provirus of replication defective virus with marker gene Infection by
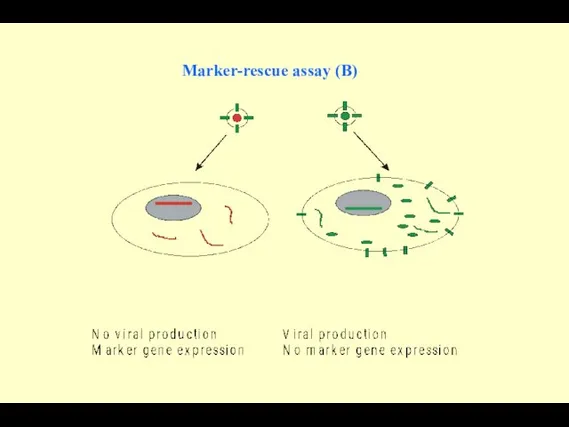
- 98. Marker-rescue assay (B)
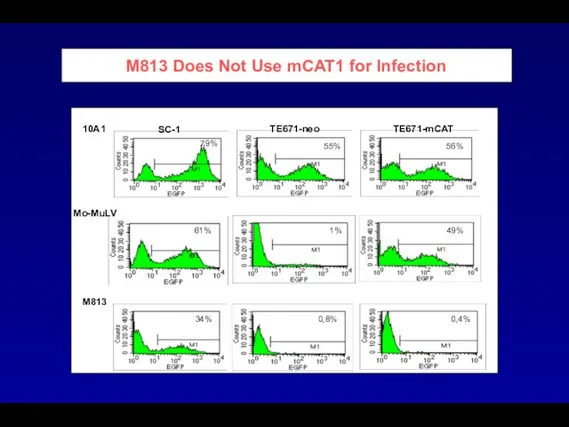
- 99. M813 Does Not Use mCAT1 for Infection SC-1 TE671-neo TE671-mCAT 10A1 Mo-MuLV M813 79% 55% 56%
- 101. M813 SU Sequences Dictate Receptor Usage MoMuLV MoM813 M813
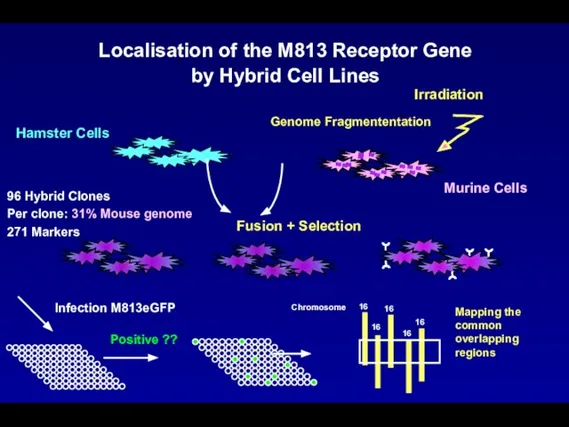
- 102. Hamster Cells Murine Cells Irradiation Genome Fragmententation Fusion + Selection 96 Hybrid Clones Per clone: 31%
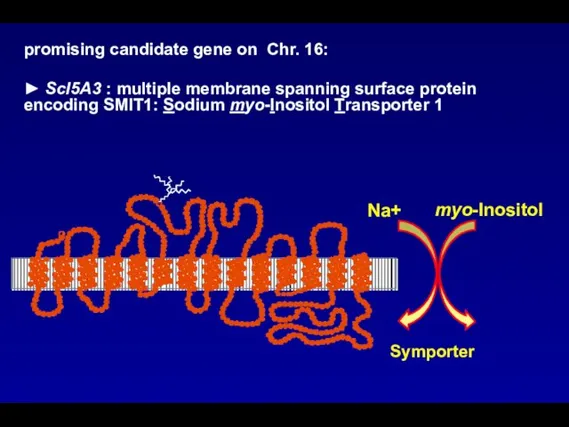
- 103. promising candidate gene on Chr. 16: ► Scl5A3 : multiple membrane spanning surface protein encoding SMIT1:
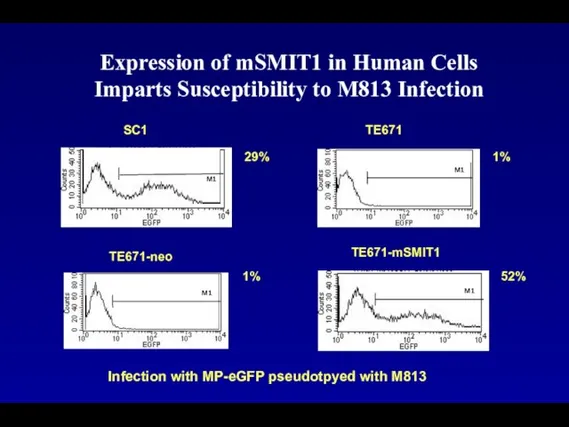
- 104. Expression of mSMIT1 in Human Cells Imparts Susceptibility to M813 Infection TE671-mSMIT1 52% M1 SC1 M1
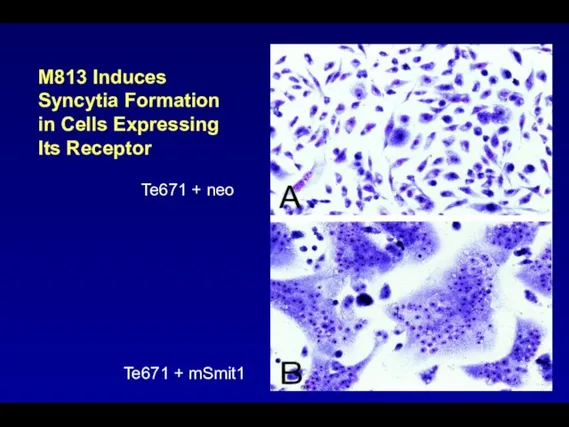
- 105. M813 Induces Syncytia Formation in Cells Expressing Its Receptor Te671 + neo Te671 + mSmit1
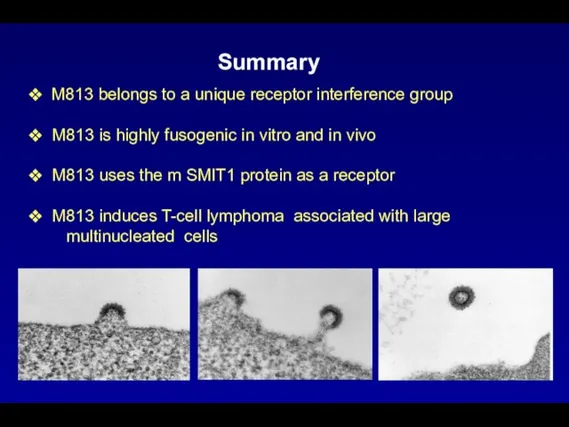
- 106. M813 belongs to a unique receptor interference group M813 is highly fusogenic in vitro and in
- 107. Acknowledgments Dmitry Ivanov, Pavel Spirin, Tamara Semenova Engelhardt Institute of Molecular Biology Moscow, Russia Sibyll Hein
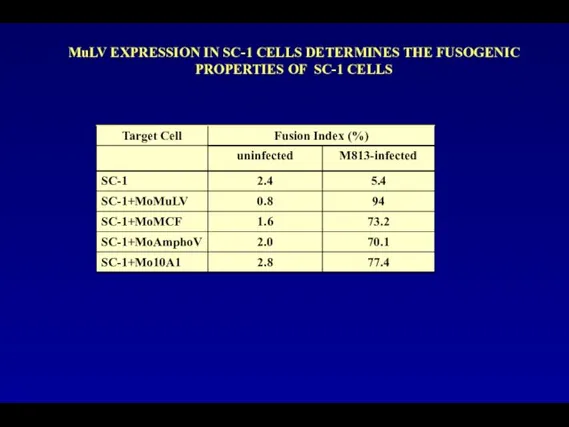
- 108. MuLV EXPRESSION IN SC-1 CELLS DETERMINES THE FUSOGENIC PROPERTIES OF SC-1 CELLS
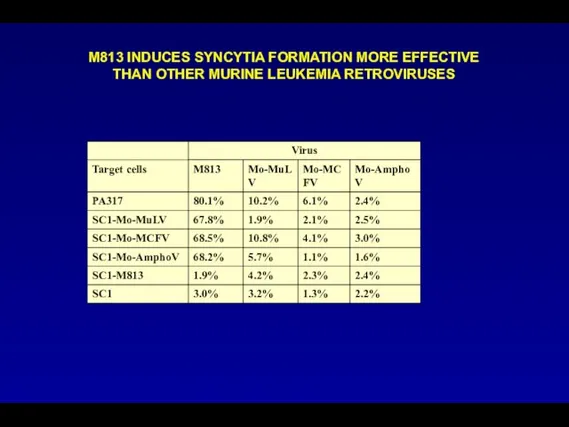
- 109. М813 INDUCES SYNCYTIA FORMATION MORE EFFECTIVE THAN OTHER MURINE LEUKEMIA RETROVIRUSES
- 110. Fusion index (FI) = (N - S)/T N – number of nuclei in syncytium S –
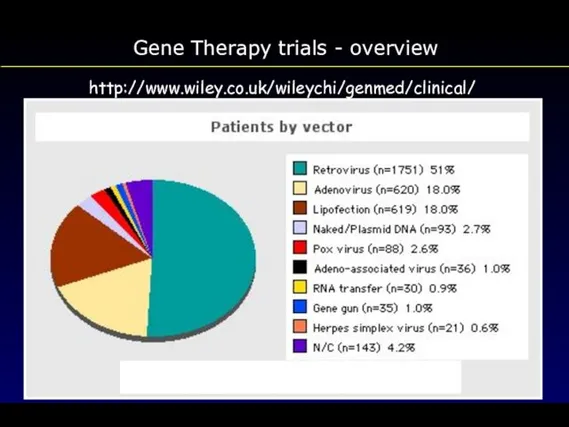
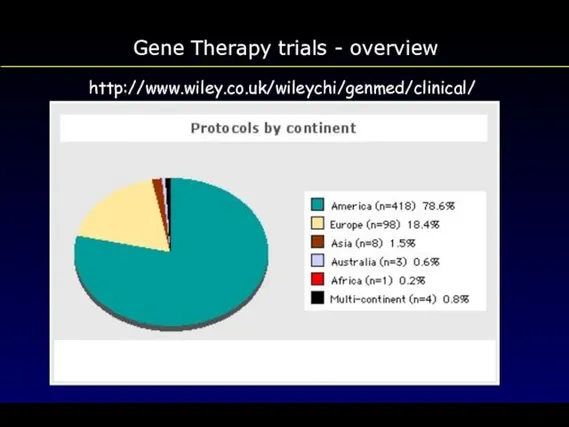
- 111. Gene Therapy trials - overview http://www.wiley.co.uk/wileychi/genmed/clinical/
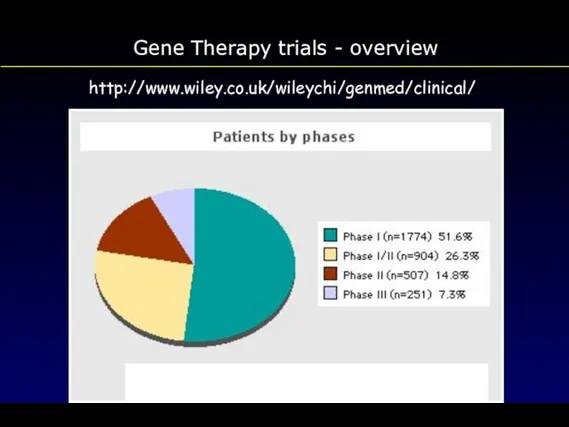
- 112. Gene Therapy trials - overview http://www.wiley.co.uk/wileychi/genmed/clinical/
- 113. Gene Therapy trials - overview http://www.wiley.co.uk/wileychi/genmed/clinical/
- 114. Инсерционный мутагенез Встраивание провируса может приводить к трансформации клетки
- 115. Открытие вирусов 1892 год Д.И.Ивановский – инфекционный фильтрующийся агент, вызывающий табачную мозаику. 1898 год M.Beijerinck -
- 117. Скачать презентацию








































 Презентация на тему ДНК и РНК нуклеиновые кислоты
Презентация на тему ДНК и РНК нуклеиновые кислоты Жасушаның құрылысы
Жасушаның құрылысы Современные аспекты генетического анализа
Современные аспекты генетического анализа Этапы эволюции человека
Этапы эволюции человека Презентация на тему Птицы, кормящиеся в воздухе
Презентация на тему Птицы, кормящиеся в воздухе  ОХРАНА ЖИВОЙ ПРИРОДЫ
ОХРАНА ЖИВОЙ ПРИРОДЫ  Тип кишечнополостные
Тип кишечнополостные Презентация по биологии Простейшие Жгутиковые
Презентация по биологии Простейшие Жгутиковые  Насекомые - переносчики заболевания человека
Насекомые - переносчики заболевания человека Презентация на тему "Окружающий мир (3 класс)" - скачать презентации по Биологии
Презентация на тему "Окружающий мир (3 класс)" - скачать презентации по Биологии Нервная ткань
Нервная ткань Каталог гибридов подсолнечника и кукурузы 2021-2022
Каталог гибридов подсолнечника и кукурузы 2021-2022 Головной мозг
Головной мозг Генеалогическое древо моей семьи Два чувства в жизни близки нам. В них обретает сердце пищу: Любовь к отеческим гробам, Любовь к
Генеалогическое древо моей семьи Два чувства в жизни близки нам. В них обретает сердце пищу: Любовь к отеческим гробам, Любовь к  Дикие животные
Дикие животные Вегетативное размножение
Вегетативное размножение Строение растительных клеток
Строение растительных клеток Презентация на тему "Значение млекопитающих в природе и жизни человека" - скачать презентации по Биологии
Презентация на тему "Значение млекопитающих в природе и жизни человека" - скачать презентации по Биологии Презентация на тему "Василёчки - Васильки" - скачать презентации по Биологии
Презентация на тему "Василёчки - Васильки" - скачать презентации по Биологии Царство грибы. Общая характеристика грибов. Отдел Миксомицеты. Отдел Хитридиомицеты. Отдел Оомицеты. Отдел Зигомицеты
Царство грибы. Общая характеристика грибов. Отдел Миксомицеты. Отдел Хитридиомицеты. Отдел Оомицеты. Отдел Зигомицеты Строение и функции гемоглобина и миоглобина человека. Кривые диссоциации кислорода для гемоглобина и миоглобина человека
Строение и функции гемоглобина и миоглобина человека. Кривые диссоциации кислорода для гемоглобина и миоглобина человека Миграция радионуклидов по пищевым цепочкам
Миграция радионуклидов по пищевым цепочкам Оценка сортов яровой пшеницы в условиях Лысковского сортоучастка
Оценка сортов яровой пшеницы в условиях Лысковского сортоучастка Презентация Отряды насекомых
Презентация Отряды насекомых Introduction to the Nervous System
Introduction to the Nervous System Животный мир Северной Америки
Животный мир Северной Америки Класс Млекопитающие. 7 класс
Класс Млекопитающие. 7 класс ТЕМА УРОКА ВЛИЯНИЕ НАРКОГЕННЫХ ВЕЩЕСТВ НА ЗДОРОВЬЕ И СУДЬБУ ЧЕЛОВЕКА
ТЕМА УРОКА ВЛИЯНИЕ НАРКОГЕННЫХ ВЕЩЕСТВ НА ЗДОРОВЬЕ И СУДЬБУ ЧЕЛОВЕКА