Содержание
- 2. Экспрессия трансгенов
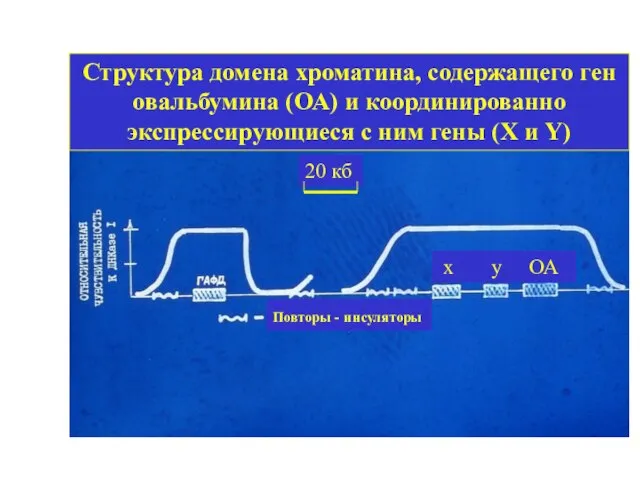
- 3. Структура домена хроматина, содержащего ген овальбумина (ОА) и координированно экспрессирующиеся с ним гены (Х и Y)
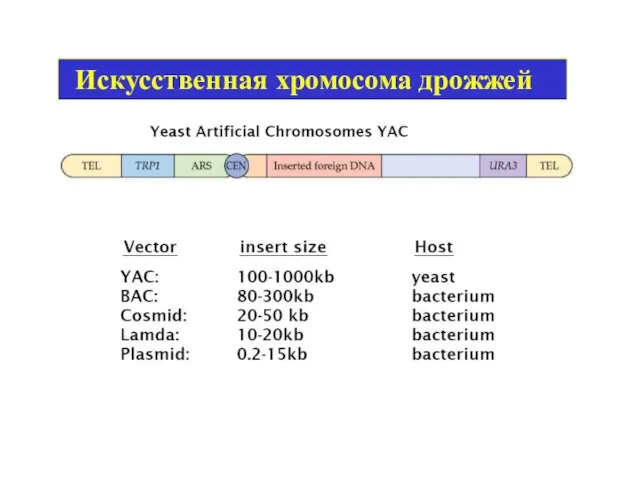
- 4. Искусственная хромосома дрожжей
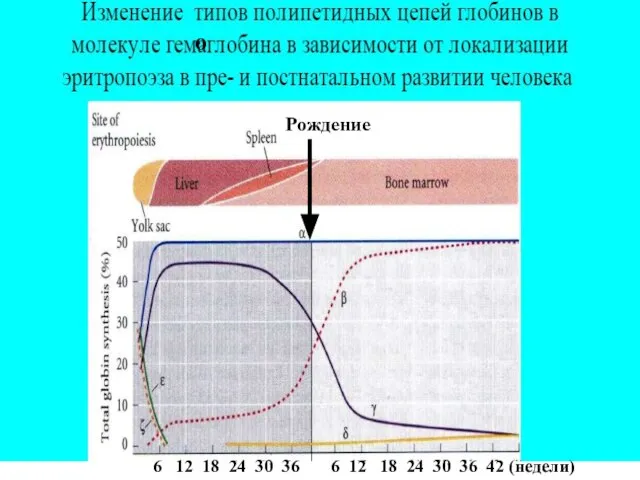
- 5. о 6 12 18 24 30 36 6 12 18 24 30 36 42 (недели) Рождение
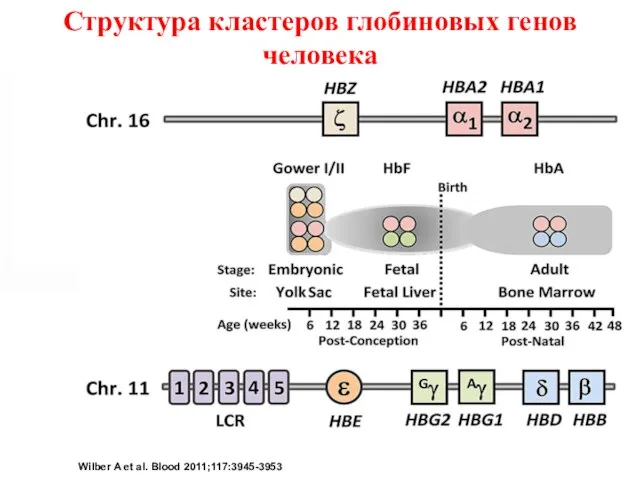
- 6. Schematic of genomic structural organization of the human α-globin and β-globin loci and temporal expression of
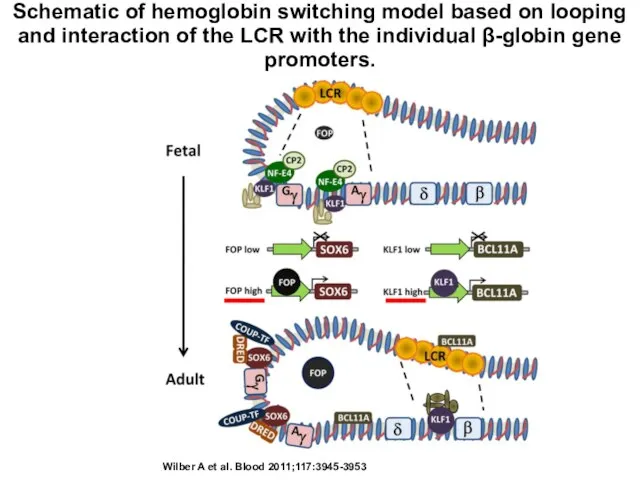
- 7. Schematic of hemoglobin switching model based on looping and interaction of the LCR with the individual
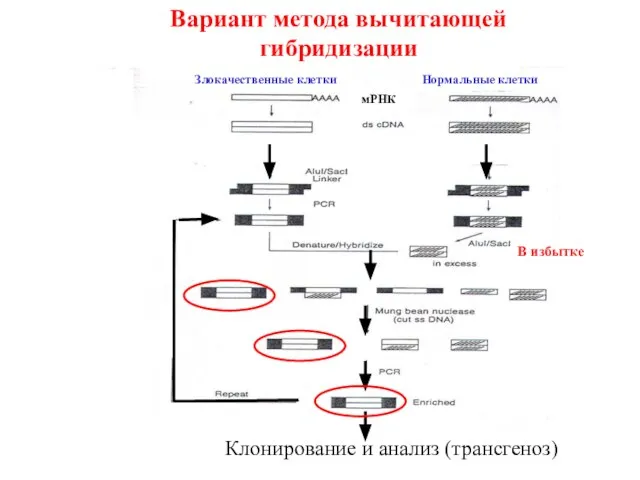
- 8. Вариант метода вычитающей гибридизации Клонирование и анализ (трансгеноз) Злокачественные клетки Нормальные клетки мРНК В избытке
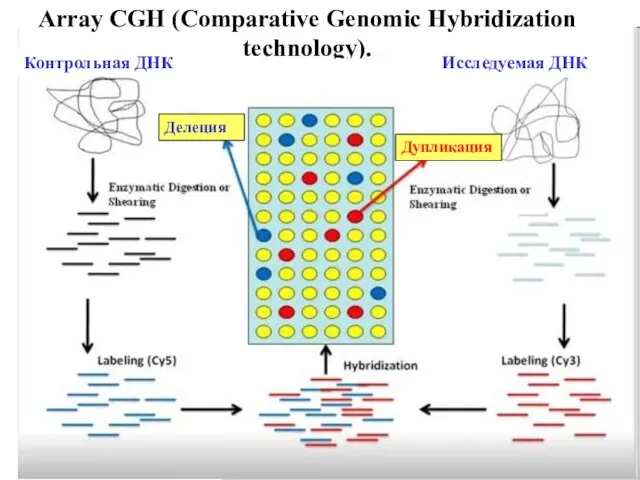
- 9. Array CGH (Comparative Genomic Hybridization technology). Делеция Дупликация Контрольная ДНК Исследуемая ДНК
- 10. От хромосомных перестроек - к механизмам злокачественного перерождения через трансгеноз -Транслокация хромосом t(9;22) у человека при
- 11. Влияние экспрессии онкогенов на канцерогенез у трансгенных мышей
- 12. Клеточные гены, ускоряющие развитие лимфомы у трансгенных мышей
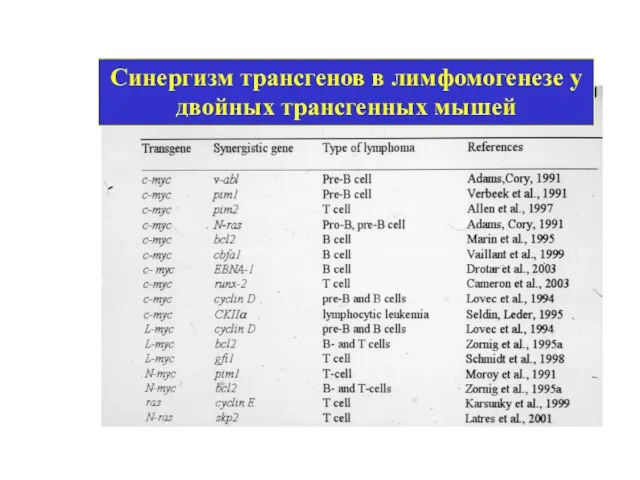
- 13. Синергизм трансгенов в лимфомогенезе у двойных трансгенных мышей
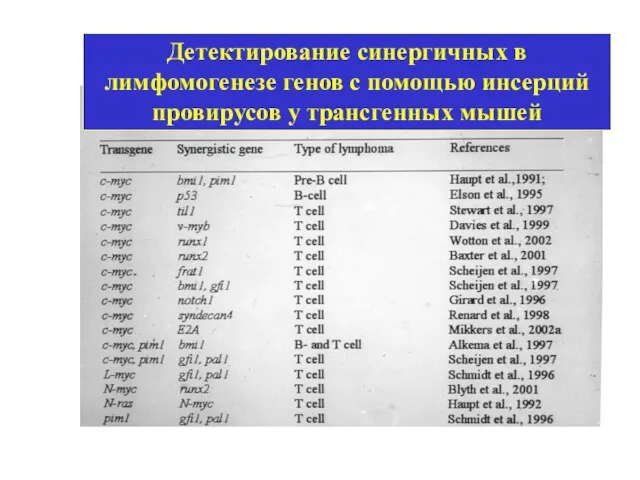
- 14. Детектирование синергичных в лимфомогенезе генов с помощью инсерций провирусов у трансгенных мышей
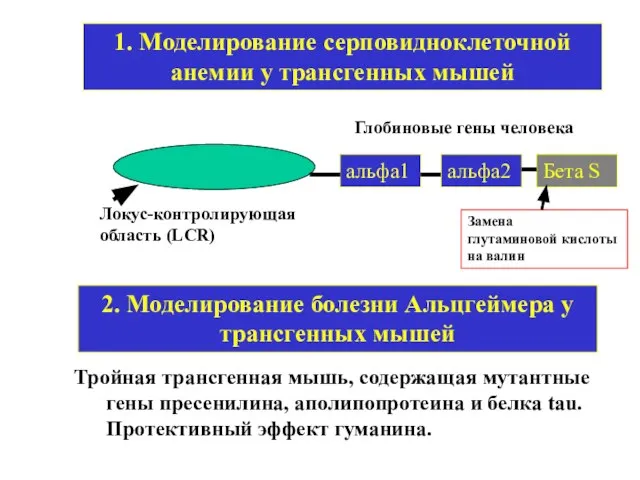
- 15. 1. Моделирование серповидноклеточной анемии у трансгенных мышей альфа1 альфа2 Бета S Локус-контролирующая область (LCR) Глобиновые гены
- 16. Некоторые другие проблемы, решаемые с помощью трансгеноза. Токсикогенетика развития. Генетическая замена микрохирургии – ген дифтерийного токсина
- 17. Структура генома ВИЧ-1
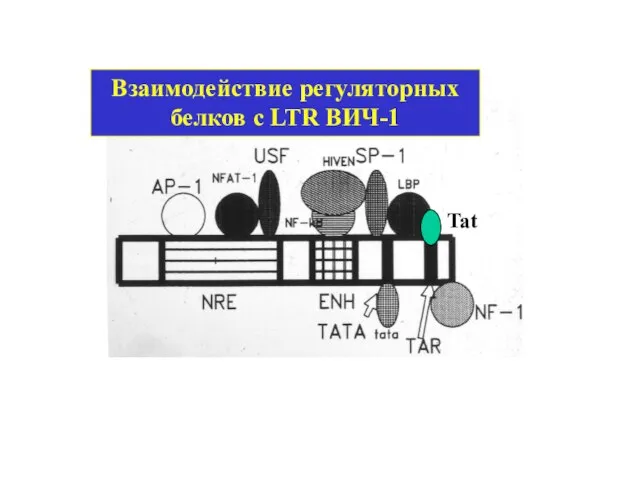
- 18. Взаимодействие регуляторных белков с LTR ВИЧ-1 Tat
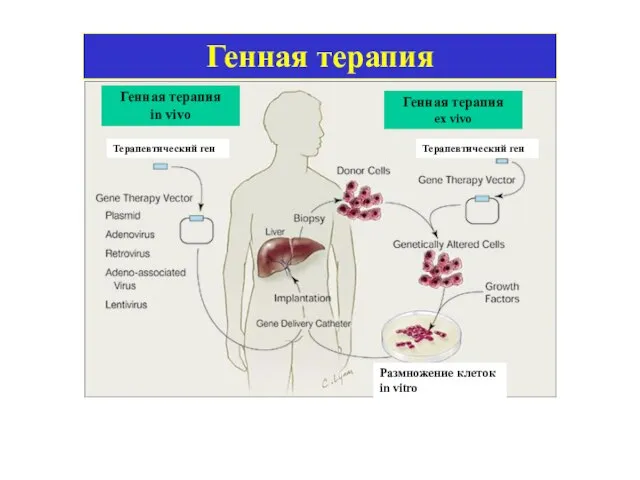
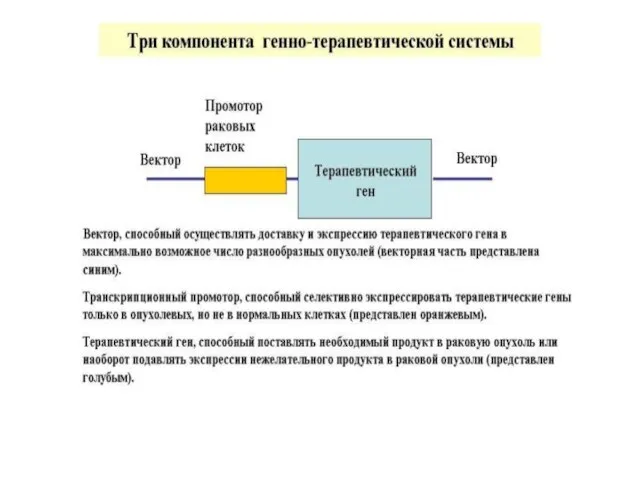
- 19. ГЕННАЯ ТЕРАПИЯ
- 20. Генная терапия in vivo Генная терапия ex vivo Размножение клеток in vitro Терапевтический ген Терапевтический ген
- 21. Что надо для успеха? Выбор потенциально терапевтического гена (моногенные заболевания, вирусные и бактериальные инфекции) Выбор вектора
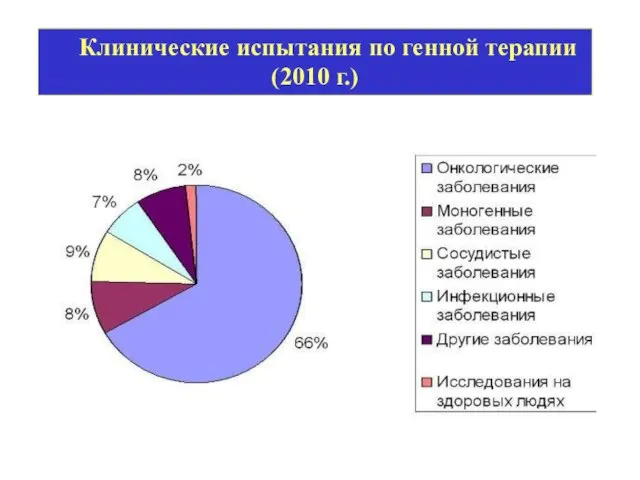
- 22. Клинические испытания по генной терапии (2010 г.)
- 23. Генная терапия некоторых заболеваний человека Заболевание Вектор Ген Болезнь Паркинсона RV декарбоксилаза глутаминовой ы кислоты Гемофилия
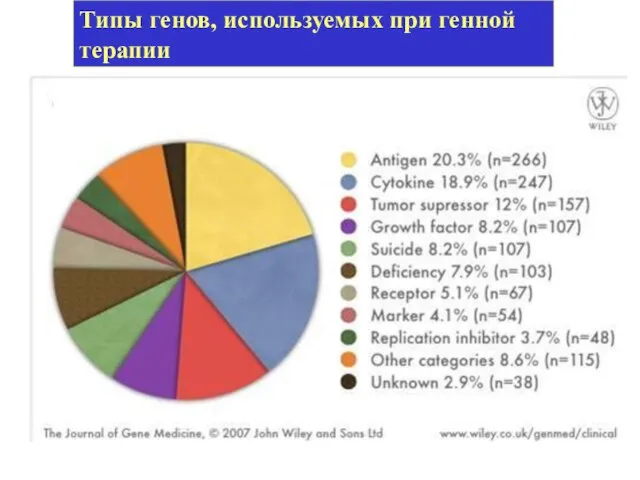
- 24. Типы генов, используемых при генной терапии
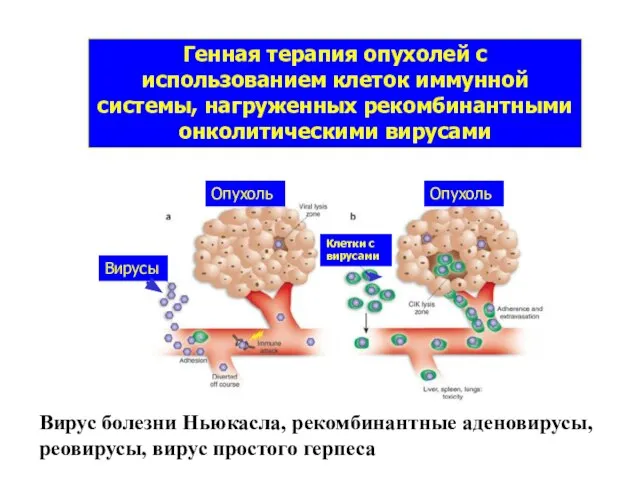
- 26. Генная терапия опухолей с использованием клеток иммунной системы, нагруженных рекомбинантными онколитическими вирусами Вирусы Клетки с вирусами
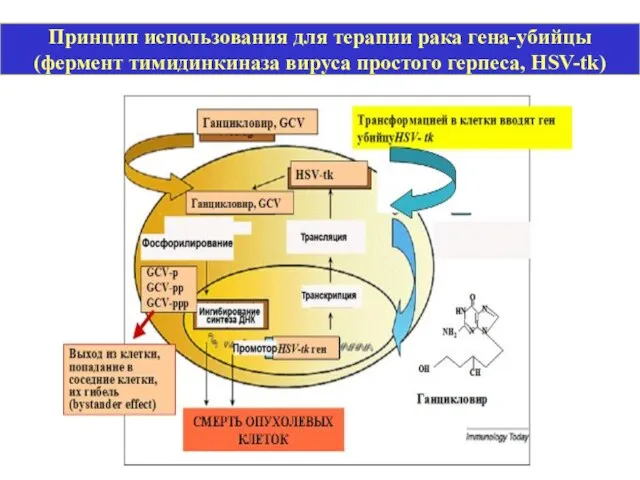
- 27. Принцип использования для терапии рака гена-убийцы (фермент тимидинкиназа вируса простого герпеса, HSV-tk)
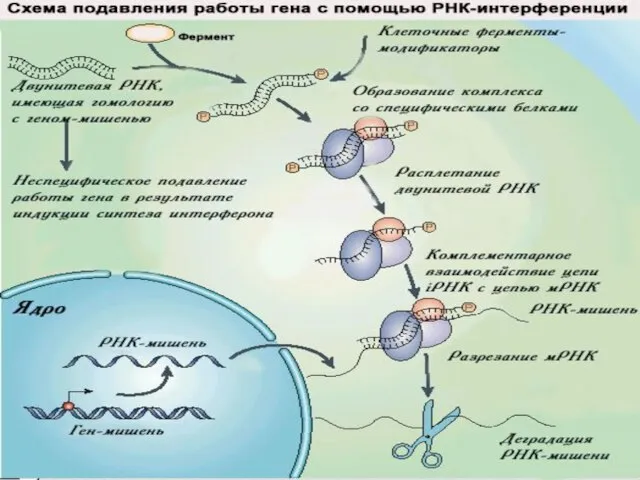
- 28. Направленное подавление работы гена в клетках достигается с помощью: 1) Антисмысловых РНК 2) Рибозимов 3) РНК-
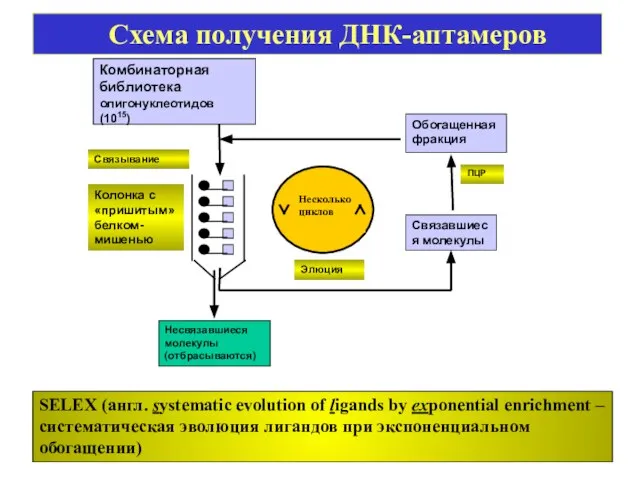
- 29. SELEX (англ. systematic evolution of ligands by exponential enrichment – систематическая эволюция лигандов при экспоненциальном обогащении)
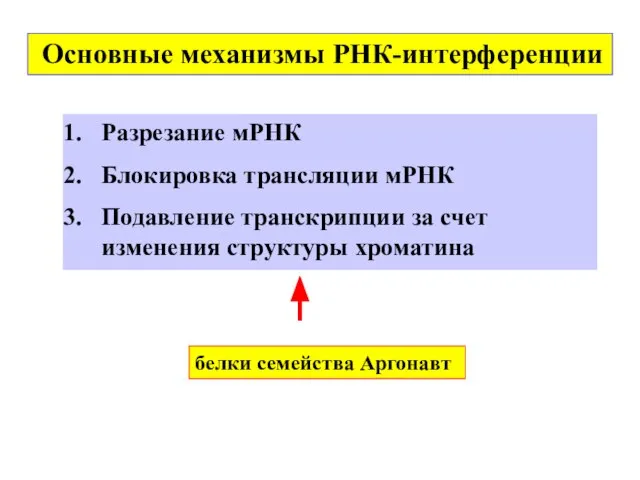
- 31. белки семейства Aргонавт Основные механизмы РНК-интерференции Разрезание мРНК Блокировка трансляции мРНК Подавление транскрипции за счет изменения
- 32. 1990 г. – ген аденозиндезаминазы в аденовирусе (наследственный иммунодефицит) (Андерсон, США). 2003 г. – в Китае
- 33. Перспективы генно-клеточной терапии Стволовые нейрональные клетки, экспрессирующие VEGF, - при инсульте Эмбриональные стволовые клетки, экспрессиирующие VEGF
- 34. Таргетинг генов
- 35. Гомологичная рекомбинация Осуществляется через образование структуры Холидея. В этом участвуют разнообразные ферменты: - комплекс топоизомераз, -
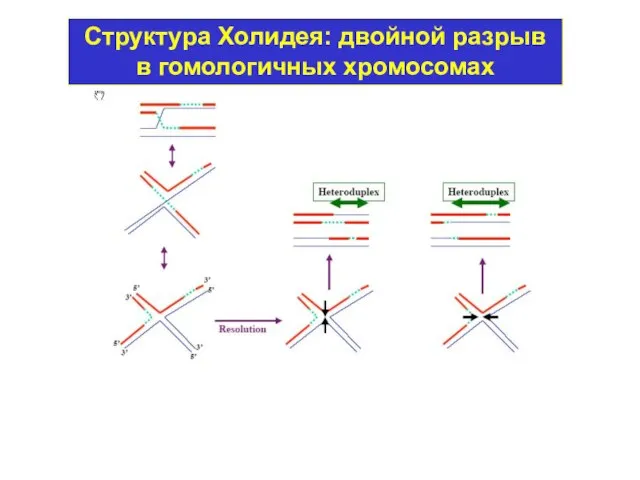
- 36. Структура Холидея: двойной разрыв в гомологичных хромосомах
- 37. Хронологическая справка об использовании механизма гомологичной рекомбинации
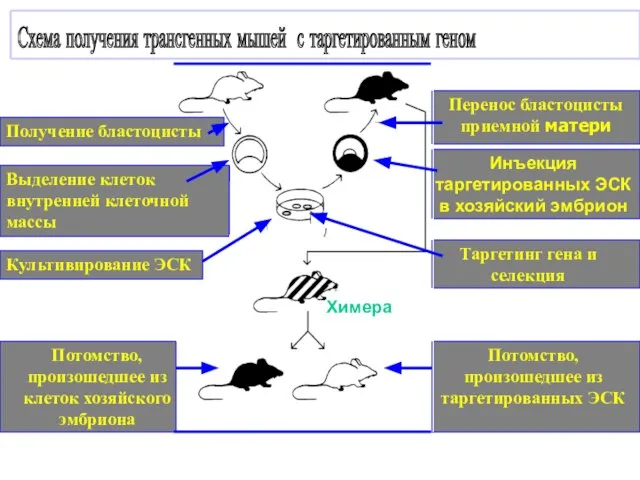
- 38. Потомство, произошедшее из таргетированных ЭСК Потомство, произошедшее из клеток хозяйского эмбриона Химера Таргетинг гена и селекция
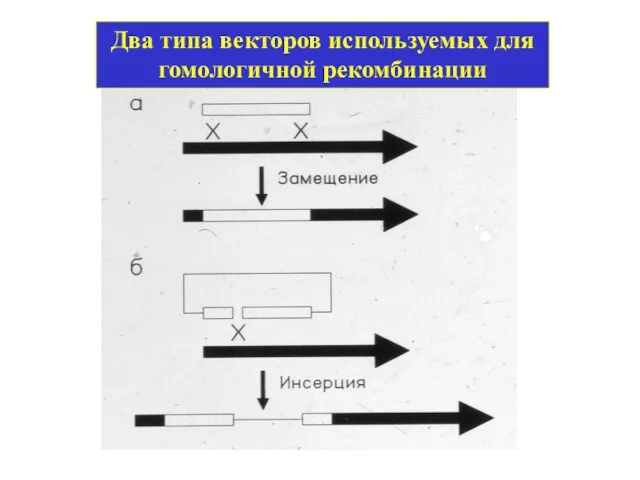
- 39. Два типа векторов используемых для гомологичной рекомбинации
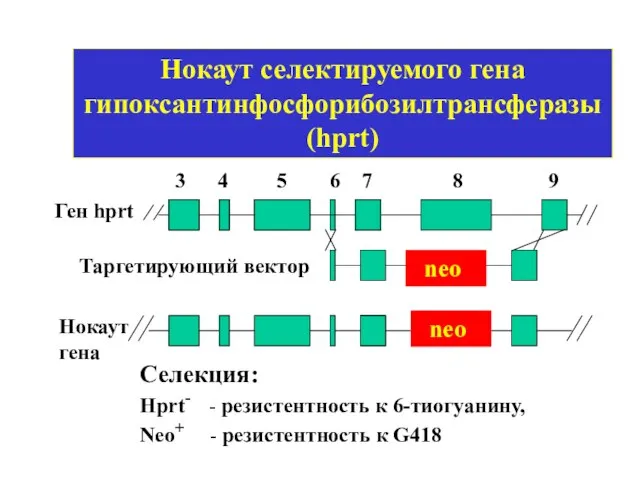
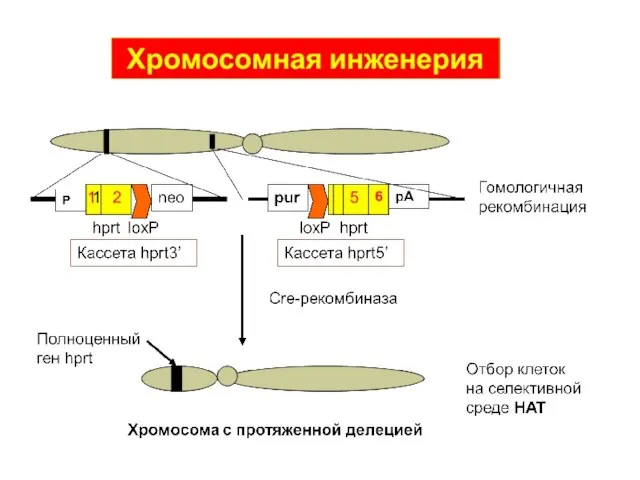
- 40. Нокаут селектируемого гена гипоксантинфосфорибозилтрансферазы (hprt) Ген hprt neo Таргетирующий вектор 3 4 5 6 7 8
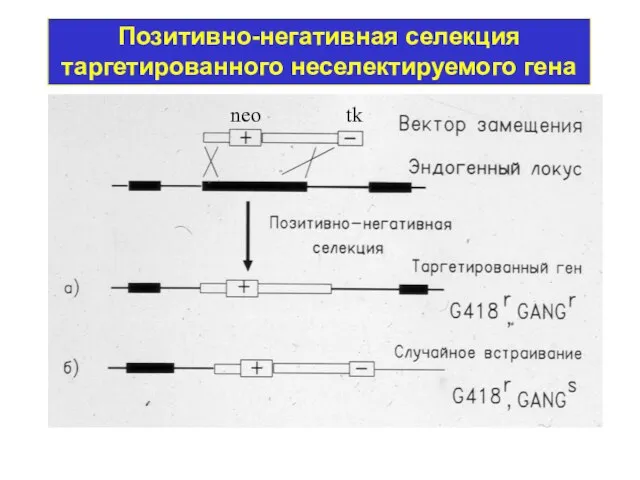
- 41. Позитивно-негативная селекция таргетированного неселектируемого гена neo tk
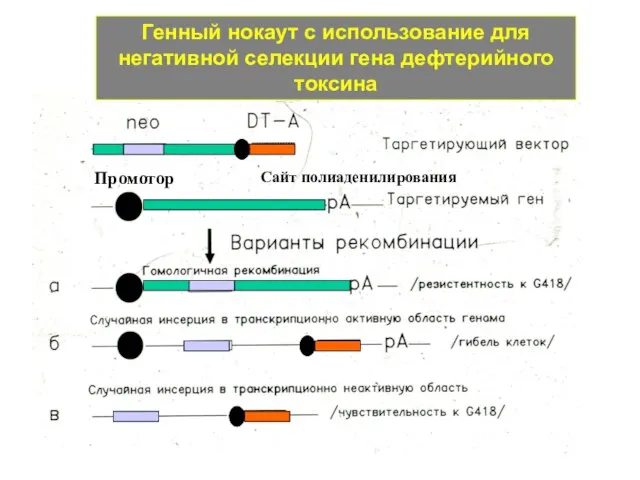
- 42. Генный нокаут с использование для негативной селекции гена дефтерийного токсина Промотор Сайт полиаденилирования
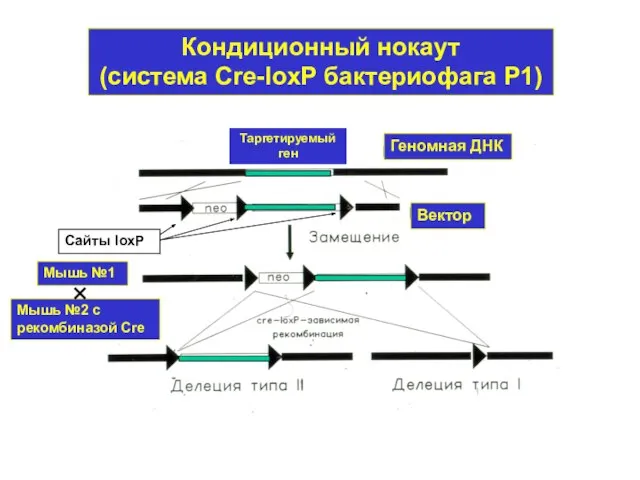
- 43. Кондиционный нокаут (система Cre-loxP бактериофага Р1) Сайты loxP Мышь №1 Мышь №2 с рекомбиназой Cre Таргетируемый
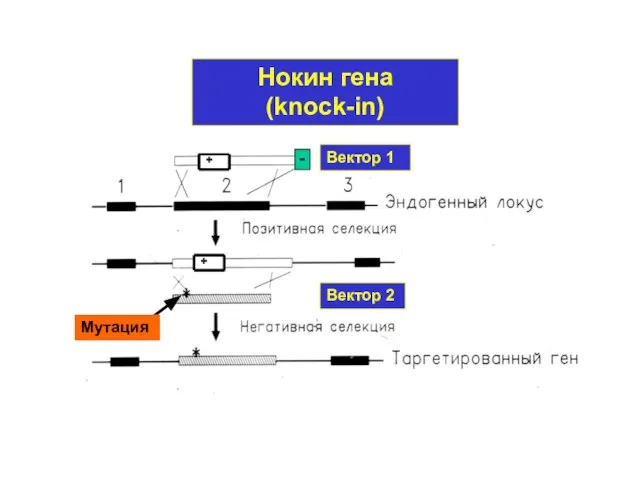
- 44. Вектор 1 Вектор 2 Нокин гена (knock-in) Мутация + +
- 45. Функции генов, установленные с помощью их нокаута
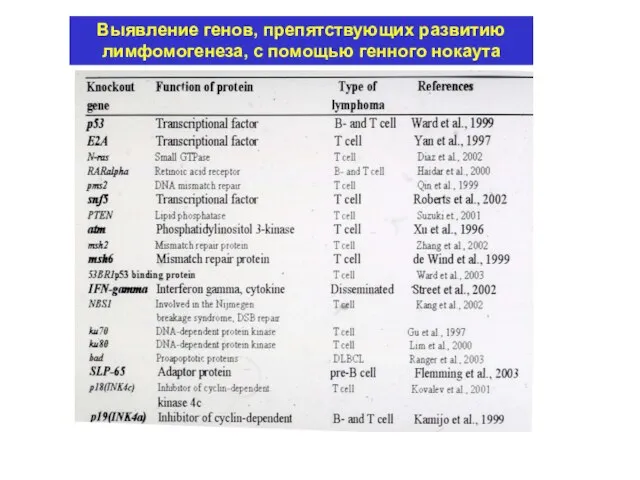
- 46. Выявление генов, препятствующих развитию лимфомогенеза, с помощью генного нокаута
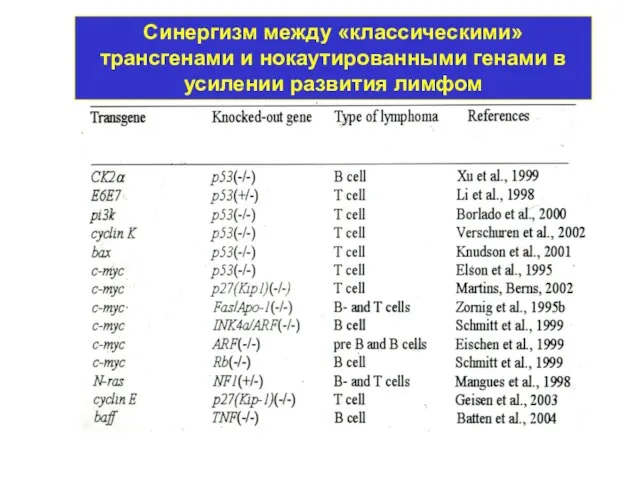
- 47. Синергизм между «классическими» трансгенами и нокаутированными генами в усилении развития лимфом
- 48. Синергизм между действием генов в лимфомогенезе, установленный на основе анализа дважды и трижды нокаутированных мышей
- 49. Обнаружение генов, участвующих в раннем развитии, с помощью нокаута генов Нокаутированный ген Аномалии развития Гамма-субъединица ламинина
- 50. Примеры изучения вирусного патогенеза с помощью нокаута генов Вирус лейкоза мышей Мыши дикого типа – синдром
- 52. Таргетинг генов без ЭСК – прямо в зиготе (редактирование генома) 2009 г. – белки с «цинковыми
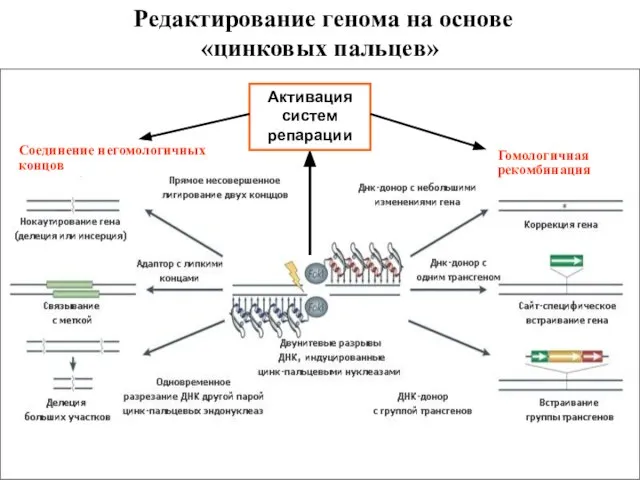
- 53. Редактирование генома на основе «цинковых пальцев» Соединение негомологичных концов Гомологичная рекомбинация Активация систем репарации
- 54. Редактирование генома на основе TALENs ---------------------------------------------------------------------------------(Trascription Activator-like Effector Nucleases (TALENs) – белки из бактерий рода Xanthomonas,
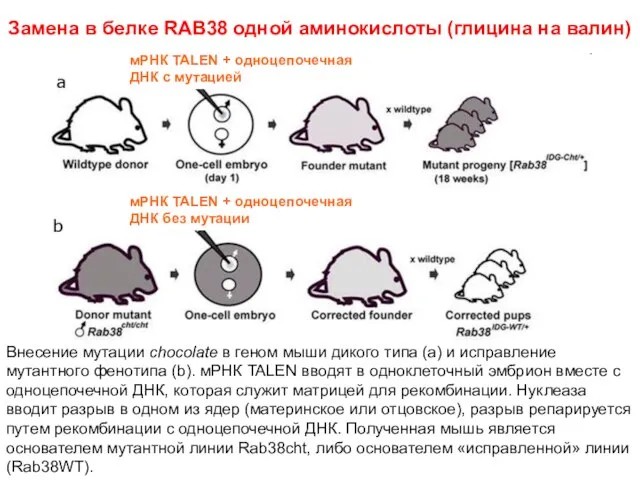
- 55. Замена в белке RAB38 одной аминокислоты (глицина на валин) мРНК TALEN + одноцепочечная ДНК с мутацией
- 56. CRISPR (от англ. clustered regularly interspaced short palindromic repeats — короткие палиндромные — короткие палиндромные повторы,
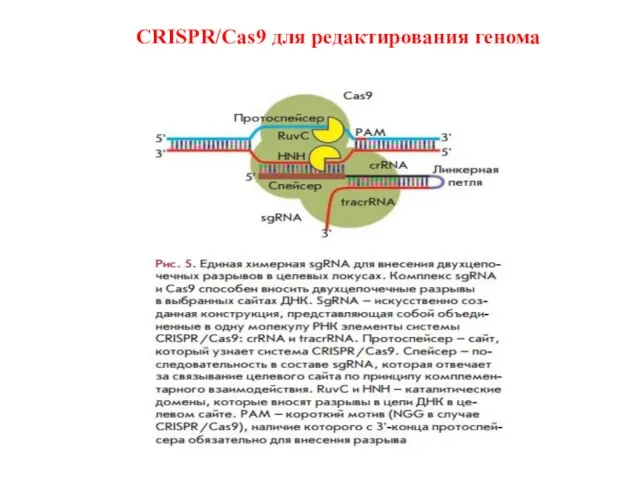
- 57. CRISPR/Cas9 для редактирования генома
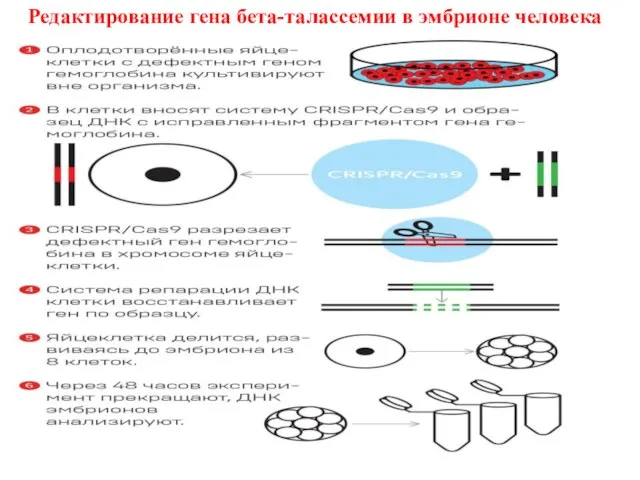
- 58. Редактирование гена бета-талассемии в эмбрионе человека
- 59. Впервые в мире технологию CRISPR/Cas9 для модификации эмбрионов человека применили исследователи из Китая в 2015 г.
- 65. Скачать презентацию



























 Лишайники
Лишайники Презентация на тему "Опыление растений" - скачать презентации по Биологии
Презентация на тему "Опыление растений" - скачать презентации по Биологии Тема «Внутреннее строение рыбы» Тыквенко Наталья Вениаминовна Учитель географии и биологии Гляденской ООШ №11 Красноярский к
Тема «Внутреннее строение рыбы» Тыквенко Наталья Вениаминовна Учитель географии и биологии Гляденской ООШ №11 Красноярский к Caracteristică succintă a angiospermelor
Caracteristică succintă a angiospermelor Тип Губки
Тип Губки Строение и жизнедеятельность бактерий, их роль в природе и жизни человека
Строение и жизнедеятельность бактерий, их роль в природе и жизни человека Презентация на тему "Что такое обмен веществ?" - скачать бесплатно презентации по Биологии
Презентация на тему "Что такое обмен веществ?" - скачать бесплатно презентации по Биологии Овощи и фрукты - полезные продукты (игра)
Овощи и фрукты - полезные продукты (игра) Предмет и задачи микробиологии
Предмет и задачи микробиологии Модификационная изменчивость
Модификационная изменчивость Презентацию подготовила Семибратова Л.П. Учитель биологии МОУ «Чебаклинская СОШ»
Презентацию подготовила Семибратова Л.П. Учитель биологии МОУ «Чебаклинская СОШ»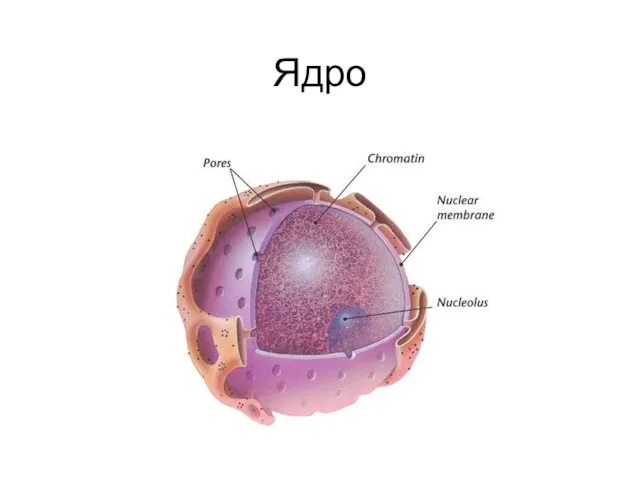 Ядро. Ядерные поры
Ядро. Ядерные поры Презентация на тему "Значение корней в жизни растений" - скачать презентации по Биологии
Презентация на тему "Значение корней в жизни растений" - скачать презентации по Биологии Законы Менделя. лицей №1550 САО г.Москвы Донская Валентина Григорьевна
Законы Менделя. лицей №1550 САО г.Москвы Донская Валентина Григорьевна  Человек и эволюция: старение или молодость? Выполнила Красикова Дарья, ученица 11 класса.
Человек и эволюция: старение или молодость? Выполнила Красикова Дарья, ученица 11 класса. Лимфа. Лимфа айналым жүйесі
Лимфа. Лимфа айналым жүйесі Родительское поведение у животных
Родительское поведение у животных Ауа сапасын анықтаудың биоиндикациялық әдістерін тәжірибеде пайдалану
Ауа сапасын анықтаудың биоиндикациялық әдістерін тәжірибеде пайдалану Звезды океана
Звезды океана Детекция и идентификация биомолекул. Полимеразная цепная реакция (ПЦР)
Детекция и идентификация биомолекул. Полимеразная цепная реакция (ПЦР) Питание, убежища и ориентация млекопитающих
Питание, убежища и ориентация млекопитающих Строение клетки. Роберт Гук
Строение клетки. Роберт Гук Биогеохимические циклы
Биогеохимические циклы Экологический час Синичкин день
Экологический час Синичкин день Породы кроликов
Породы кроликов Обратные связи в природе Мирошиков И. 9 «А»
Обратные связи в природе Мирошиков И. 9 «А» Методы изучения регуляторных районов генов
Методы изучения регуляторных районов генов ГМО - за или против?
ГМО - за или против?