Содержание
- 3. Гидролиз – это реакция обменного разложения веществ водой. Hydro – вода Lysis – разложение, распад.
- 4. Сила оснований Сильные основания – это основания, образованные щелочными и щелочноземельными металлами (LiOH, NaOH и т.д)
- 5. Сила бескислородных кислот Слабые – H2S, HF,H2Se Остальные кислоты – сильные:HCl,HBr,HI
- 6. Сила кислородсодержащих кислот Любую кислоту можно представить в виде ЭОm(ОН)n Если m=0,1-слабые m=2,3-сильные Пример H2SO4 SО2(ОН)2
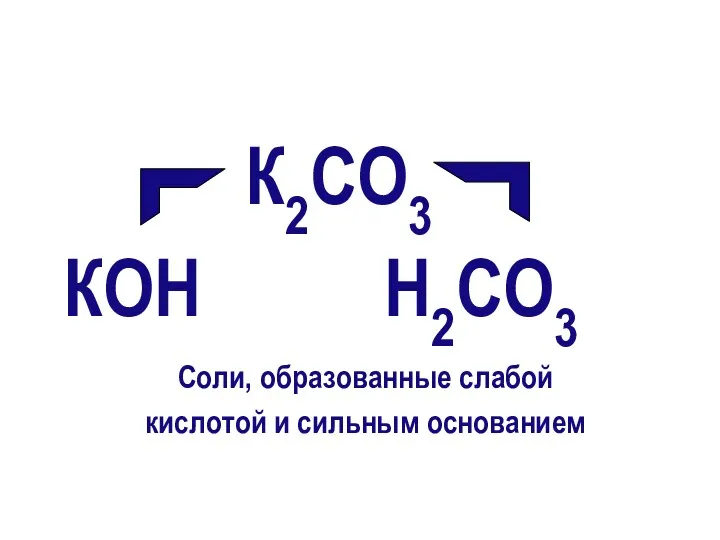
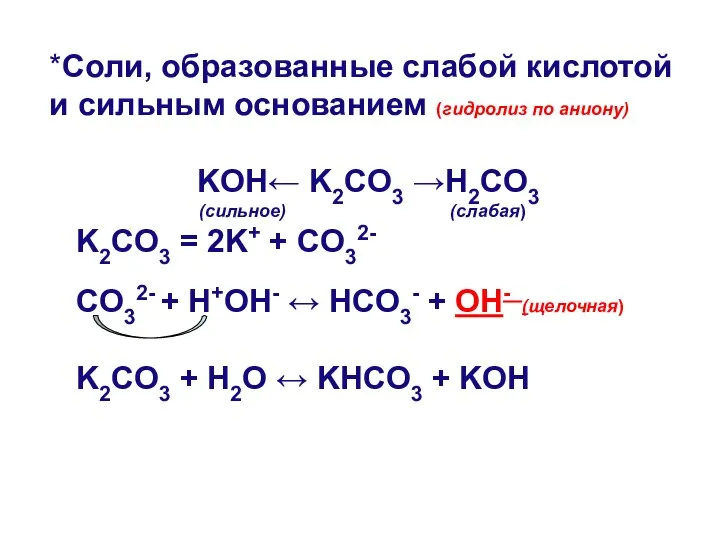
- 7. К2СO3 КОН Н2СO3 Соли, образованные слабой кислотой и сильным основанием
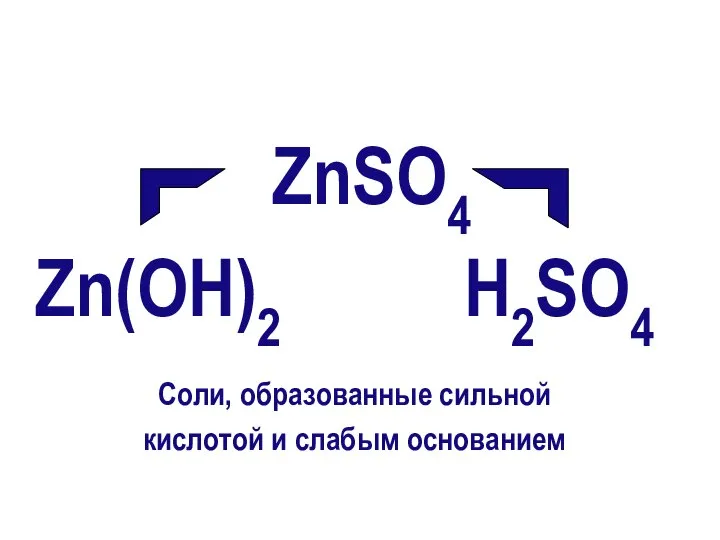
- 8. ZnSO4 Zn(ОН)2 Н2SO4 Соли, образованные сильной кислотой и слабым основанием
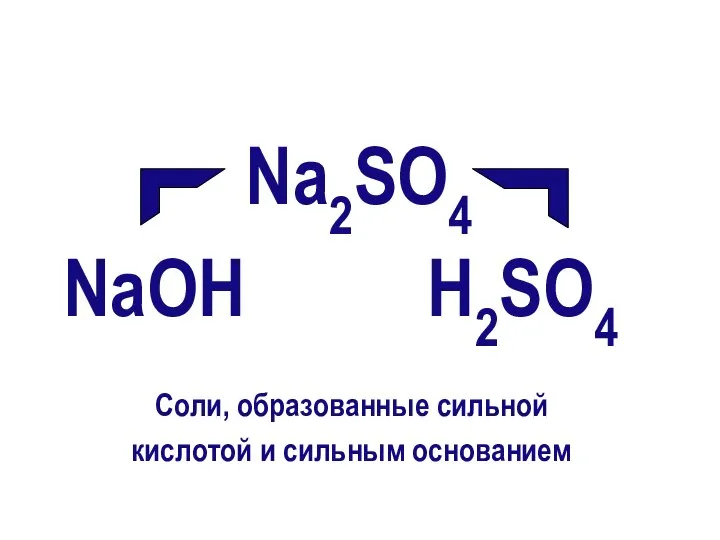
- 9. Na2SO4 NaОН Н2SO4 Соли, образованные сильной кислотой и сильным основанием
- 10. Al2S3 Al(ОН)3 Н2S Соли, образованные слабой кислотой и слабым основанием
- 11. *Соли, образованные слабой кислотой и сильным основанием (гидролиз по аниону) KOH← K2CO3 →H2CO3 (сильное) (слабая) K2CO3
- 12. Гидролиз сульфита натрия Гидролиз силиката лития Гидролиз фосфата калия Задание
- 13. *Соли, образованные сильной кислотой и слабым основанием (гидролиз по катиону) Zn(OH)2 ← ZnSO4 → H2SO4 (
- 14. Гидролиз нитрата алюминия Гидролиз хлорида железа (III) Гидролиз иодида аммония Задание
- 15. *Соли, образованные слабой кислотой и слабым основанием (гидролиз по катиону и аниону) Al(OH)3 ← Al2S3 →
- 16. *Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются рН = 7
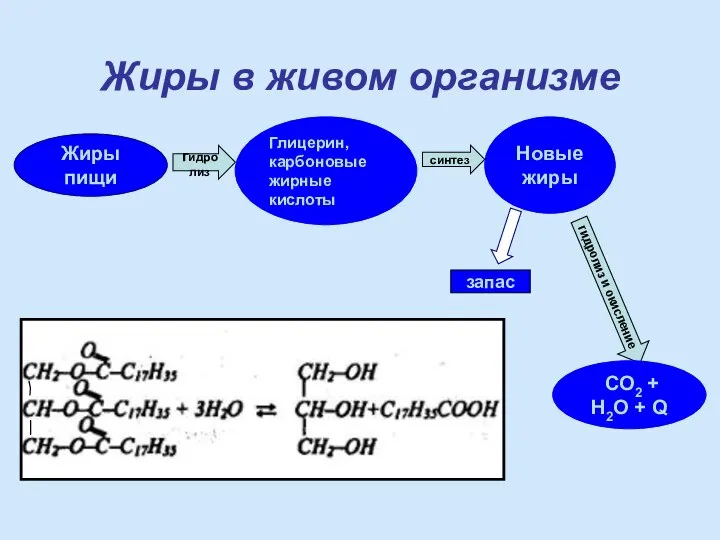
- 17. Жиры пищи Глицерин, карбоновые жирные кислоты Новые жиры гидролиз синтез гидролиз и окисление СО2 + Н2О
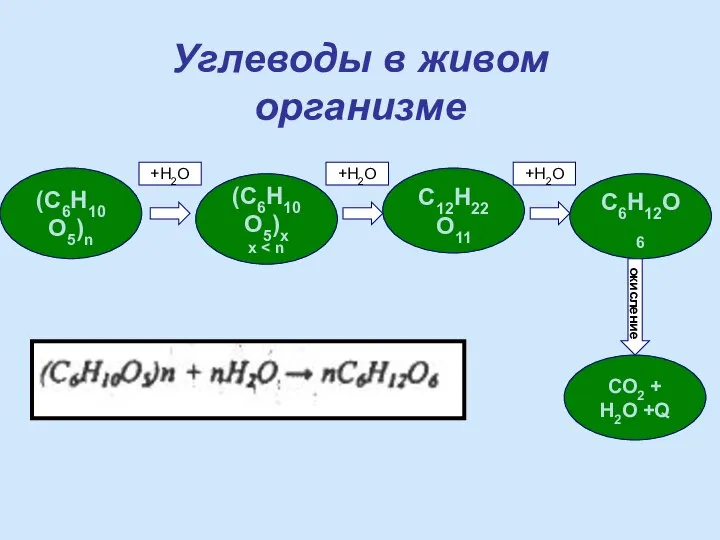
- 18. (С6Н10О5)n (C6H10O5)x x C12H22O11 C6H12O6 СО2 + Н2О +Q +H2O +H2O +H2O окисление Углеводы в живом
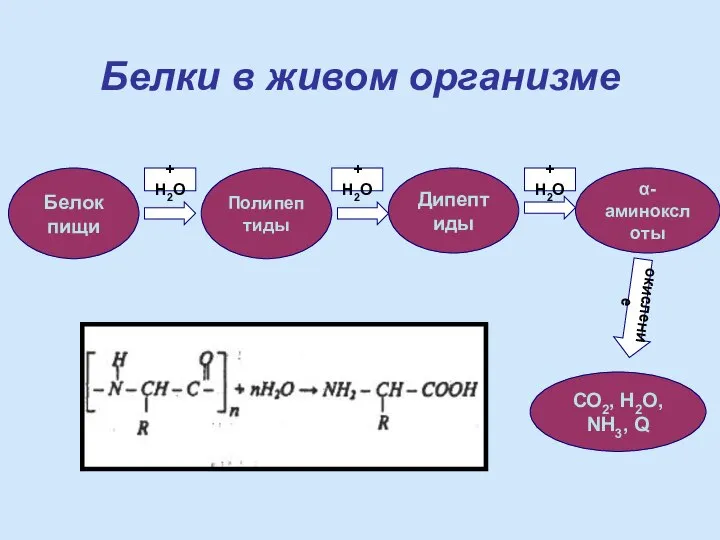
- 19. Белки в живом организме Белок пищи Полипептиды Дипептиды α-аминокслоты СО2, Н2О, NH3, Q окисление + Н2О
- 21. Скачать презентацию










 Внутреннее строение млекопитающих
Внутреннее строение млекопитающих Нервная система
Нервная система Любопытные факты о страусах
Любопытные факты о страусах  Что такое молоко? Ученик 9 «А» класса МОУ СОШ №15 Никифоров Сергей Проверила Соловова Е.А.
Что такое молоко? Ученик 9 «А» класса МОУ СОШ №15 Никифоров Сергей Проверила Соловова Е.А. Презентация на тему "Спинной мозг" - скачать презентации по Биологии
Презентация на тему "Спинной мозг" - скачать презентации по Биологии Девонский период
Девонский период Значение бактерий
Значение бактерий Тигры. Научное описание
Тигры. Научное описание Презентация на тему "Воробей" - скачать бесплатно презентации по Биологии
Презентация на тему "Воробей" - скачать бесплатно презентации по Биологии Строение и функции
Строение и функции Презентация на тему Витамин А
Презентация на тему Витамин А Тип связи между акацией бычерогой и муравьями?
Тип связи между акацией бычерогой и муравьями? Презентация на тему "Нарушения слуха" - скачать бесплатно презентации по Биологии
Презентация на тему "Нарушения слуха" - скачать бесплатно презентации по Биологии Аттестационная работа. Рабочая программа дополнительного образования Цветы в нашем доме
Аттестационная работа. Рабочая программа дополнительного образования Цветы в нашем доме Пентозний цикл (Пентозомонофосфатний шлях)
Пентозний цикл (Пентозомонофосфатний шлях) Дельфины
Дельфины Решу ОГЭ
Решу ОГЭ Перелетные птицы. Осень
Перелетные птицы. Осень Биогеоценология Экосистема и биогеоценоз
Биогеоценология Экосистема и биогеоценоз Schnuffi, der kleine Igel
Schnuffi, der kleine Igel Особенности химического строения клетки
Особенности химического строения клетки Кафедра микробиологии, вирусологии та имунологии Микробиологический контроль лекарственных средств в условиях аптечного пр
Кафедра микробиологии, вирусологии та имунологии Микробиологический контроль лекарственных средств в условиях аптечного пр Процессы в живой природе. 5 класс
Процессы в живой природе. 5 класс Термодинамика биосферы. Геохимия
Термодинамика биосферы. Геохимия Мышцы, их строение и функции
Мышцы, их строение и функции Презентация на тему Царство: Животные Тип: Членистоногие Подтип: Хелицеровые Класс: Паукообразные
Презентация на тему Царство: Животные Тип: Членистоногие Подтип: Хелицеровые Класс: Паукообразные Просо. Описание сортов
Просо. Описание сортов Ферментациялау үрдісін бағалау
Ферментациялау үрдісін бағалау