Содержание
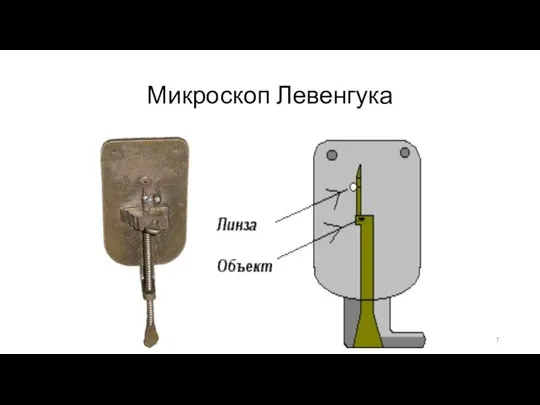
- 6. История изучения Микроскоп изобрели то ли отец и сын Янсены (Голландия, примерно 1590 г.), то ли
- 7. Микроскоп Левенгука
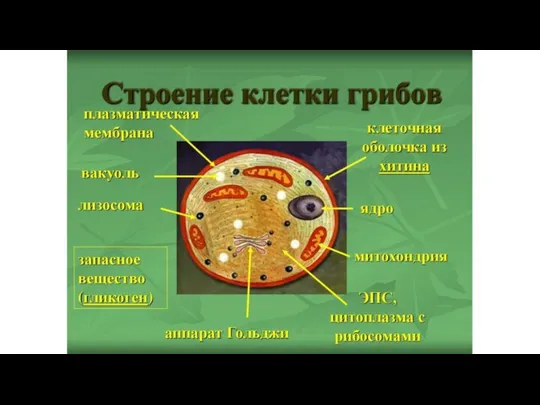
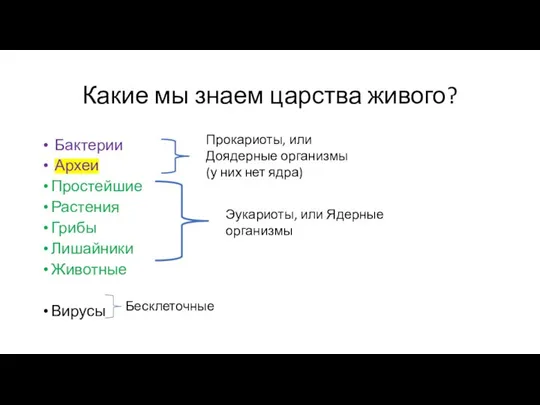
- 8. Какие мы знаем царства живого? Бактерии Археи Простейшие Растения Грибы Лишайники Животные Вирусы Эукариоты, или Ядерные
- 9. Клеточная теория 1838-39гг. Маттиас Шлейден и Теодор Шванн создали клеточную теорию Основные положения: Все организмы состоят
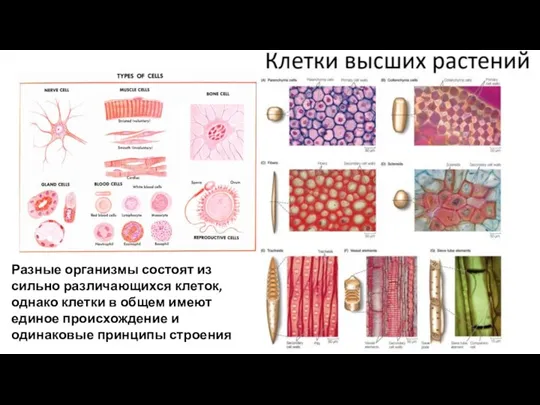
- 10. Разные организмы состоят из сильно различающихся клеток, однако клетки в общем имеют единое происхождение и одинаковые
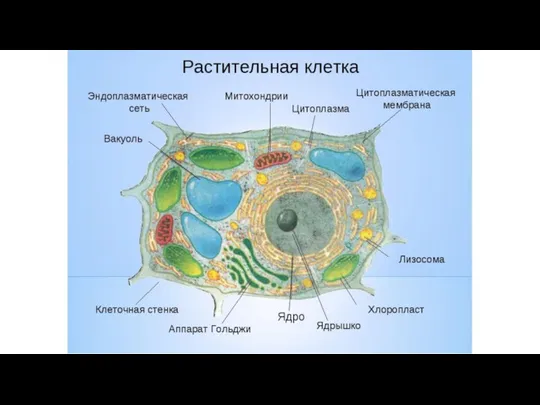
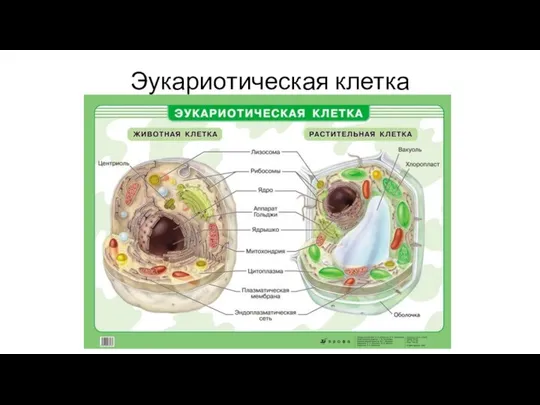
- 11. Эукариотическая клетка
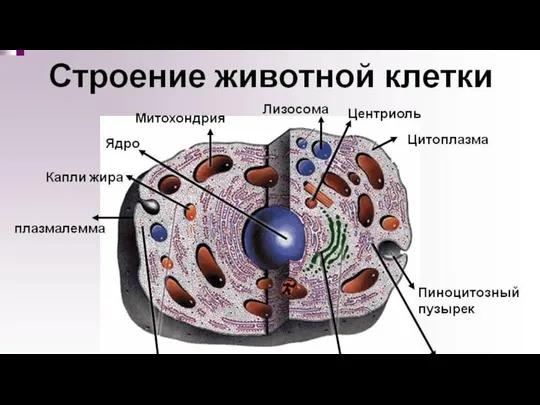
- 12. Любая клетка Плазматическая (клеточная) мембрана Цитоплазма (содержащая рибосомы) Скопление ДНК (в ядре или нуклеоид) Прежде, чем
- 13. Типы химических связей Ковалентная неполярная Ковалентная полярная Металлическая Ионная Водородные Гидрофобные взаимодействия То, что зеленым –
- 14. Металлы Металлические свойства: электро- и теплопроводность, ковкость, металлический блеск Металлические свойства – из-за строения металлов (в
- 15. Металлы и неметаллы Металлы – мало электронов на внешнем слое, поэтому любят их отдавать Неметаллы –
- 16. Ковалентная связь – между неметаллами Ковалентная неполярная связь Возникает между одинаковыми атомами За счет образования общей
- 17. Ионная связь Ионная связь: Между металлами и неметаллами За счет притяжения зарядов (ионов) Натрий отдает электрон
- 18. Водородные связи Водородная связь – связь электромагнитной природы, она возможна, когда в молекуле есть сильноэлектроотрицательный атом,
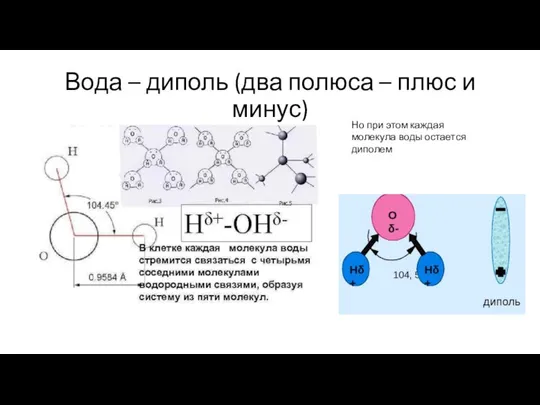
- 19. Вода – диполь (два полюса – плюс и минус) Но при этом каждая молекула воды остается
- 20. «Аномальные» свойства воды Очень высокая теплоемкость – что такое тепло? Тепло – движение молекул; из-за водородных
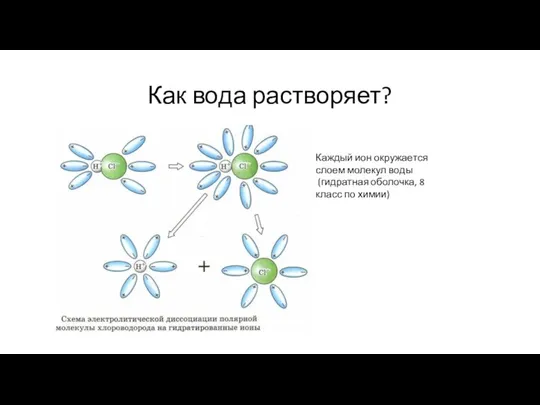
- 21. Как вода растворяет? Каждый ион окружается слоем молекул воды (гидратная оболочка, 8 класс по химии)
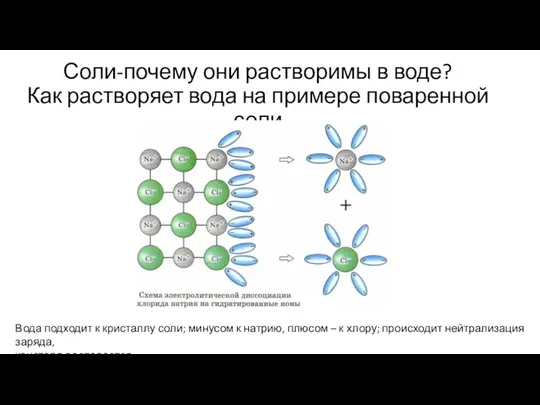
- 22. Соли-почему они растворимы в воде? Как растворяет вода на примере поваренной соли Вода подходит к кристаллу
- 23. Полярные и неполярные молекулы (нужно знать, какие из этих молекул/частиц полярны, а какие нет) Вода Углекислый
- 25. Полярные, неполярные – столько терминов ☹ Гидрофильный = полярные или заряженные Гидрофобный = Неполярный Заряженные частицы
- 26. Плазмалемма Проницаема для малых (просто так большие молекулы обычно внутрь не проходят) молекул, но не для
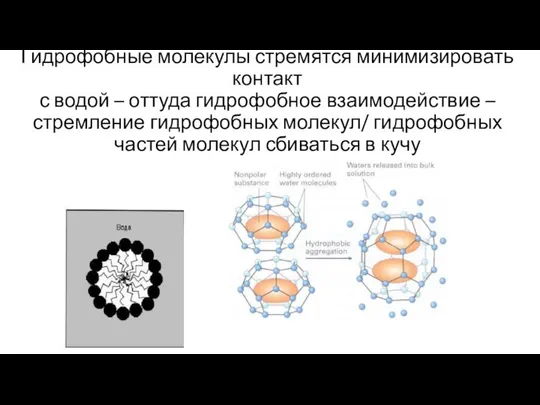
- 27. Гидрофобные молекулы стремятся минимизировать контакт с водой – оттуда гидрофобное взаимодействие – стремление гидрофобных молекул/ гидрофобных
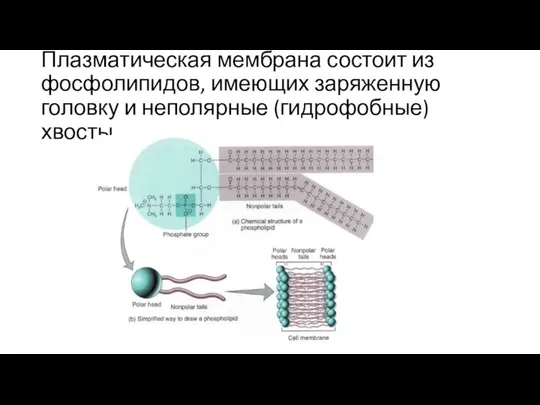
- 28. Плазматическая мембрана состоит из фосфолипидов, имеющих заряженную головку и неполярные (гидрофобные) хвосты
- 30. Скачать презентацию















 Ива - род древесных растений семейства Ивовых
Ива - род древесных растений семейства Ивовых Выполнила: Наплёкова Екатерина
Выполнила: Наплёкова Екатерина Природное сообщество. Экосистема
Природное сообщество. Экосистема Аттестационная работа. Программа научного общества учащихся Экология и биология
Аттестационная работа. Программа научного общества учащихся Экология и биология Интерактивная экскурсия по Парку птиц Фазанье царство
Интерактивная экскурсия по Парку птиц Фазанье царство Увеличительные приборы Задачи: познакомиться с устройством лупы и светового микроскопа, научиться работать с ним; сформиров
Увеличительные приборы Задачи: познакомиться с устройством лупы и светового микроскопа, научиться работать с ним; сформиров Антропогенез «Создает человека природа, но развивает и образует его общество». &
Антропогенез «Создает человека природа, но развивает и образует его общество». & Наследственность и окружающая среда
Наследственность и окружающая среда Почки. Проксимальная и дистальная реабсорбция
Почки. Проксимальная и дистальная реабсорбция Естественный отбор, его формы
Естественный отбор, его формы Строение растений Повторяем…
Строение растений Повторяем… Нервова система, її значення і розвиток у різних тварин. Подразливість як загальна властивість тварин
Нервова система, її значення і розвиток у різних тварин. Подразливість як загальна властивість тварин Осьминоги, или спрутовые
Осьминоги, или спрутовые Деление клетки. Митоз
Деление клетки. Митоз Кошки и собаки
Кошки и собаки  Гельминоцидное и антимикробное действие фенолгликозидов коры осины. Экспериментальные и клинические исследования
Гельминоцидное и антимикробное действие фенолгликозидов коры осины. Экспериментальные и клинические исследования Методы и средства защиты растений от болезней
Методы и средства защиты растений от болезней Ткани животных
Ткани животных Презентация на тему Презентация амурский тигр
Презентация на тему Презентация амурский тигр Презентация на тему "Животные сибири" - скачать презентации по Биологии
Презентация на тему "Животные сибири" - скачать презентации по Биологии Тип Моллюски или Мягкотелые
Тип Моллюски или Мягкотелые Моллюски. Характеристика и систематика типа Моллюски. Основные прогрессивные черты организации
Моллюски. Характеристика и систематика типа Моллюски. Основные прогрессивные черты организации Репликация днк. Схема синтеза днк в репликативной вилке
Репликация днк. Схема синтеза днк в репликативной вилке Дифференциальная психофизиология (часть 2)
Дифференциальная психофизиология (часть 2) Гуморальная регуляция физиологических функций организма
Гуморальная регуляция физиологических функций организма Гормоны и уверенное публичное выступление
Гормоны и уверенное публичное выступление Презентация на тему "Проблемы экологии" - скачать бесплатно презентации по Биологии
Презентация на тему "Проблемы экологии" - скачать бесплатно презентации по Биологии Активный центр белка и его взаимодействие с лигандом
Активный центр белка и его взаимодействие с лигандом