Содержание
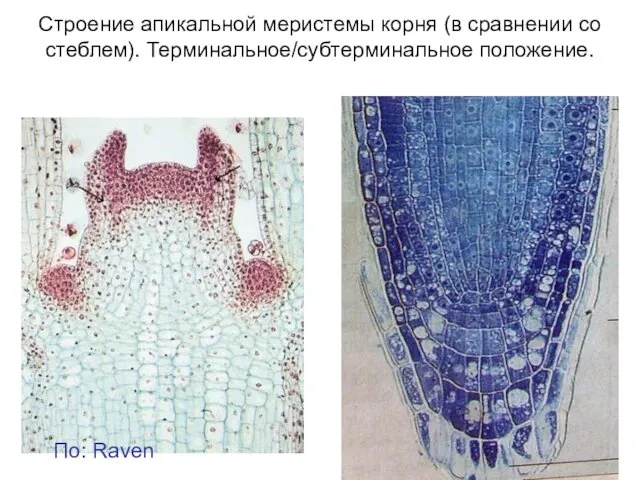
- 2. Строение апикальной меристемы корня (в сравнении со стеблем). Терминальное/субтерминальное положение. По: Raven
- 3. Выделение зон связано с их производными. Теория гистогенов. Промеристема (покоящийся центр), каллиптроген, периблема, плерома.
- 4. “Закрытый” и “открытый” типы апикальной меристемы корня. По: Raven
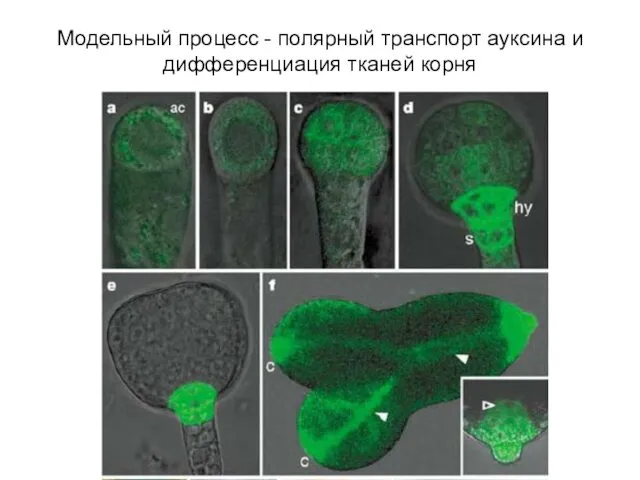
- 5. Модельный процесс - полярный транспорт ауксина и дифференциация тканей корня
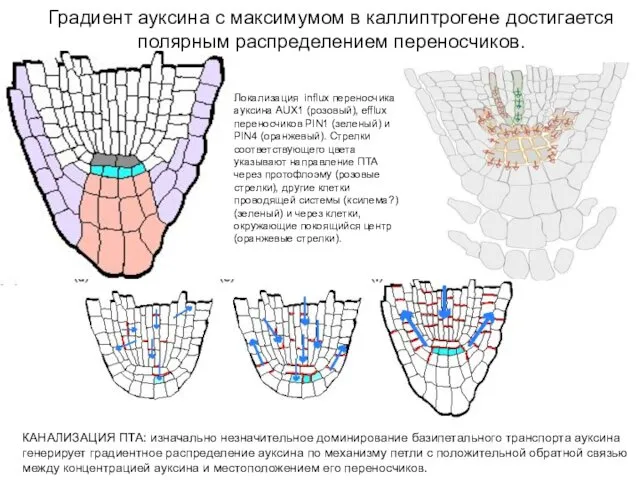
- 6. Градиент ауксина с максимумом в каллиптрогене достигается полярным распределением переносчиков. КАНАЛИЗАЦИЯ ПТА: изначально незначительное доминирование базипетального
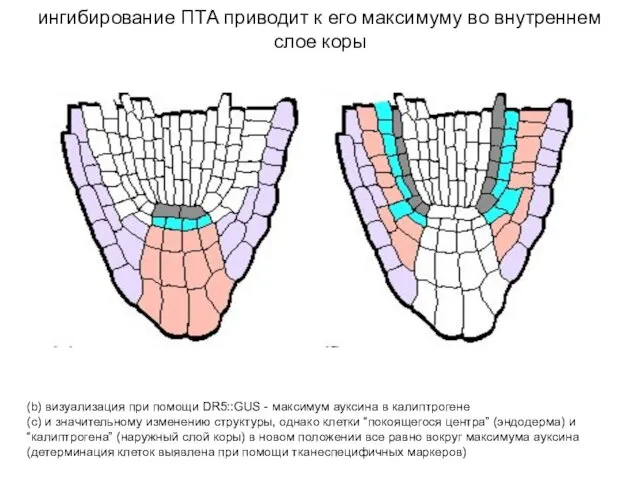
- 7. (b) визуализация при помощи DR5::GUS - максимум ауксина в калиптрогене (c) и значительному изменению структуры, однако
- 8. Экспрессия индуцируемого ауксином промотера DR5 A-F (А) Максимальная экспрессия DR5rev::PEH A в каллиптрогене и верхнем ярусе
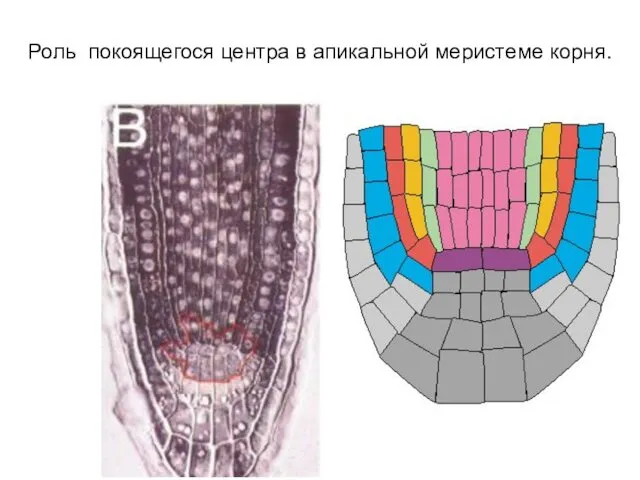
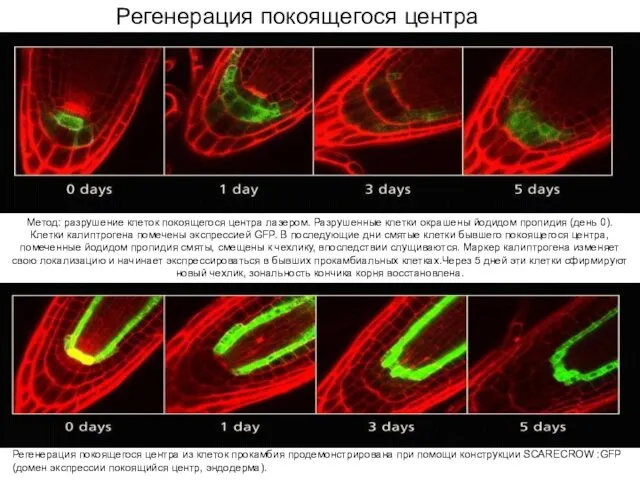
- 9. Роль покоящегося центра в апикальной меристеме корня.
- 10. Root Development. Ben Scheres, Philip Benfey, and Liam Dolan, pages 1–18.The Arabidopsis Book, eds. C.R. Somerville
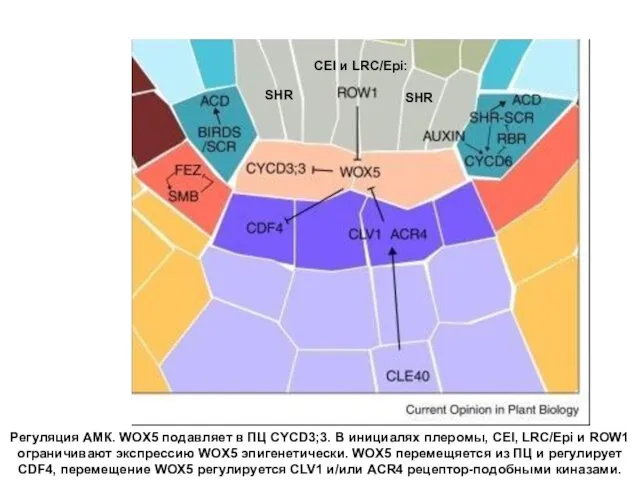
- 11. Регуляция АМК. WOX5 подавляет в ПЦ CYCD3;3. В инициалях плеромы, CEI, LRC/Epi и ROW1 ограничивают экспрессию
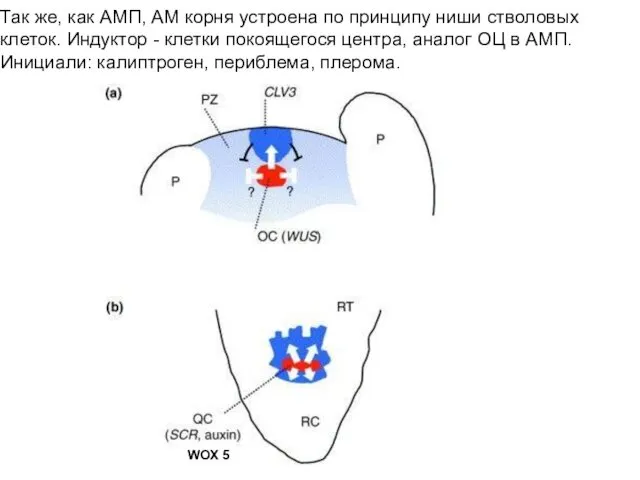
- 12. Так же, как АМП, АМ корня устроена по принципу ниши стволовых клеток. Индуктор - клетки покоящегося
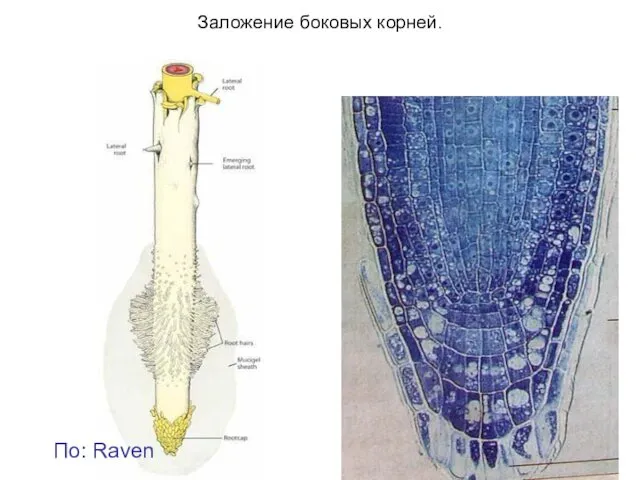
- 13. Заложение боковых корней. По: Raven
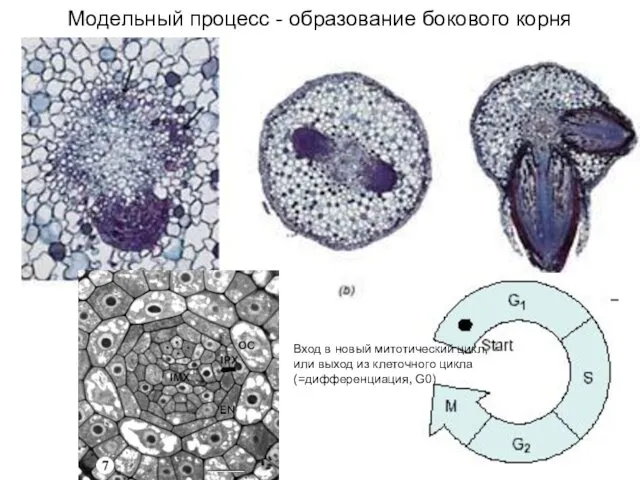
- 14. Модельный процесс - образование бокового корня Вход в новый митотический цикл, или выход из клеточного цикла
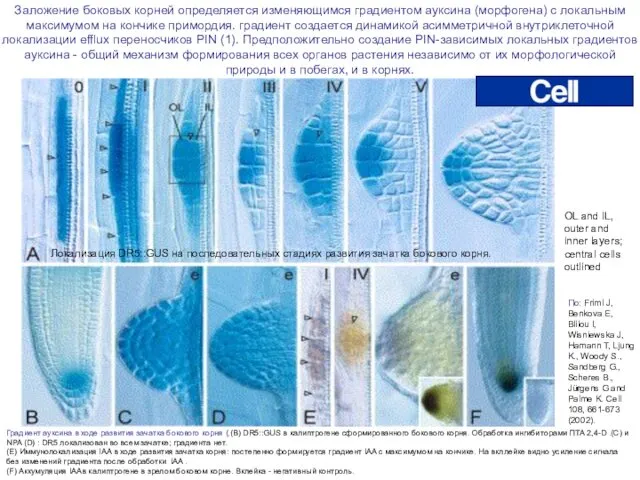
- 15. Градиент ауксина в ходе развития зачатка бокового корня (.(B) DR5::GUS в калиптрогене сформированного бокового корня. Обработка
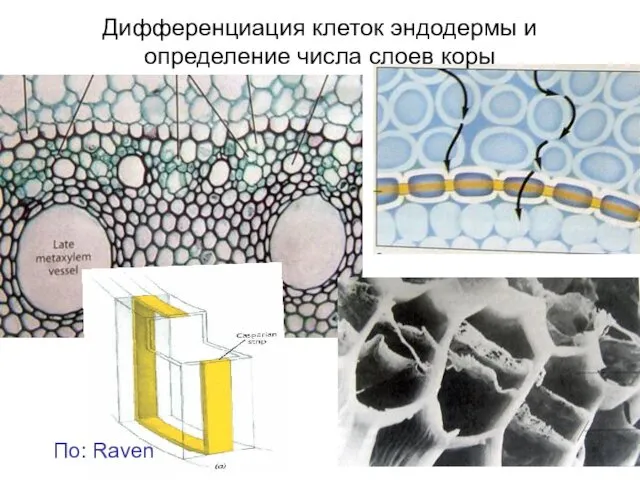
- 16. По: Raven Дифференциация клеток эндодермы и определение числа слоев коры
- 17. Дифференциация клеток эндодермы и определение числа слоев коры По: Rost
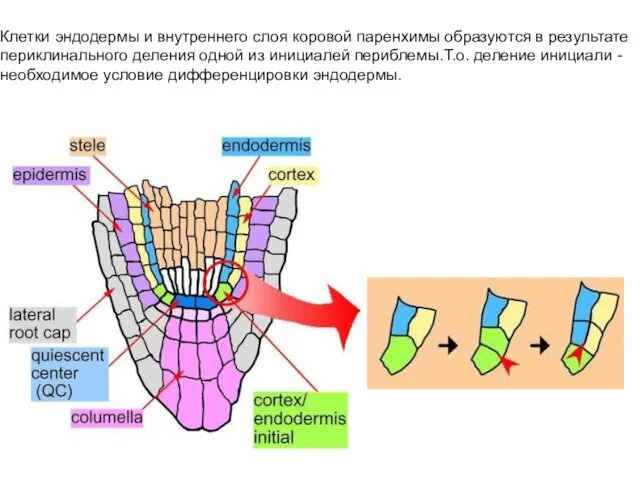
- 18. Клетки эндодермы и внутреннего слоя коровой паренхимы образуются в результате периклинального деления одной из инициалей периблемы.Т.о.
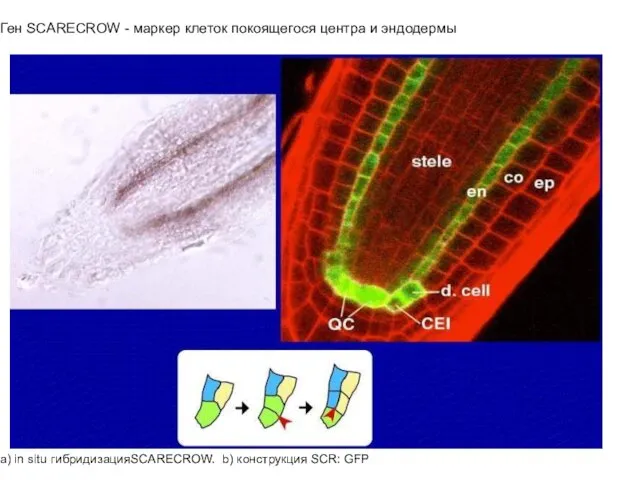
- 19. Ген SCARECROW - маркер клеток покоящегося центра и эндодермы a) in situ гибридизацияSCARECROW. b) конструкция SCR:
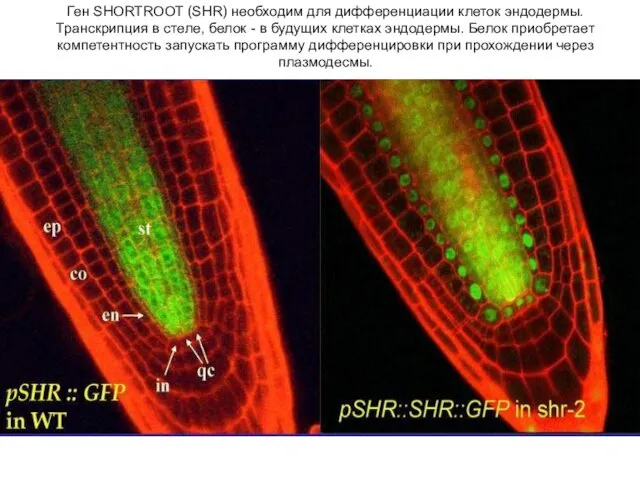
- 20. Ген SHORTROOT (SHR) необходим для дифференциации клеток эндодермы. Транскрипция в стеле, белок - в будущих клетках
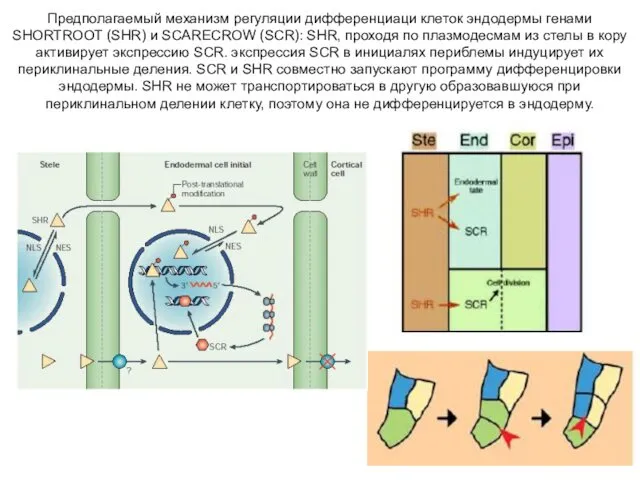
- 21. Предполагаемый механизм регуляции дифференциаци клеток эндодермы генами SHORTROOT (SHR) и SCARECROW (SCR): SHR, проходя по плазмодесмам
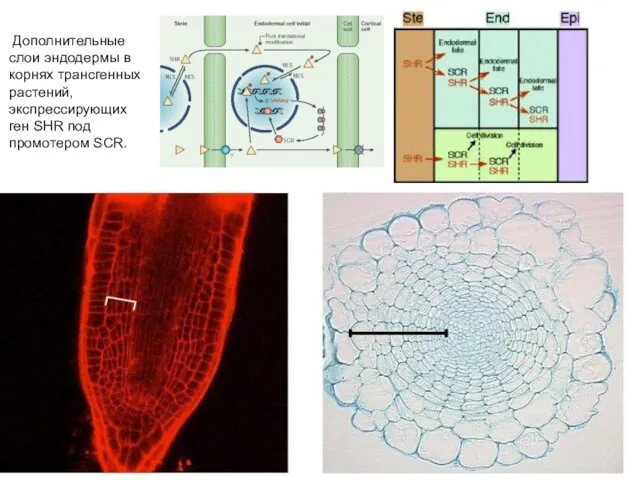
- 22. Дополнительные слои эндодермы в корнях трансгенных растений, экспрессирующих ген SHR под промотером SCR.
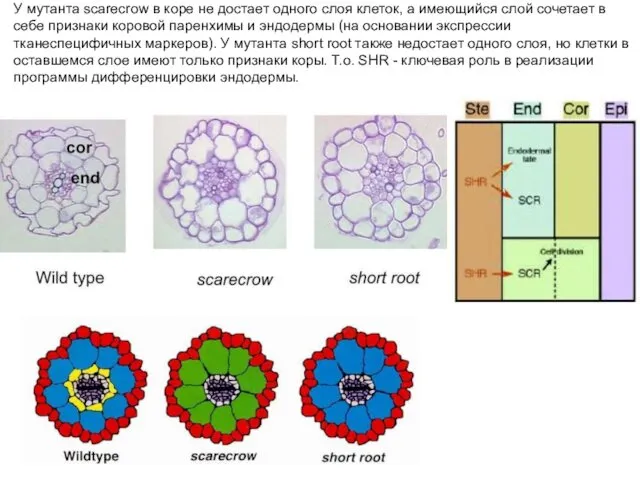
- 23. У мутанта scarecrow в коре не достает одного слоя клеток, а имеющийся слой сочетает в себе
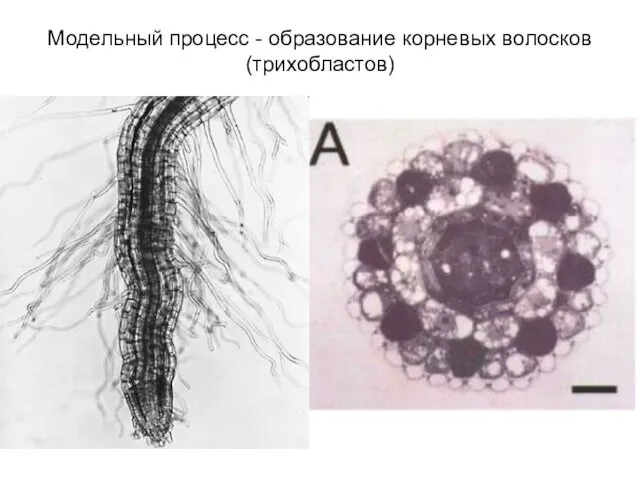
- 24. Модельный процесс - образование корневых волосков (трихобластов)
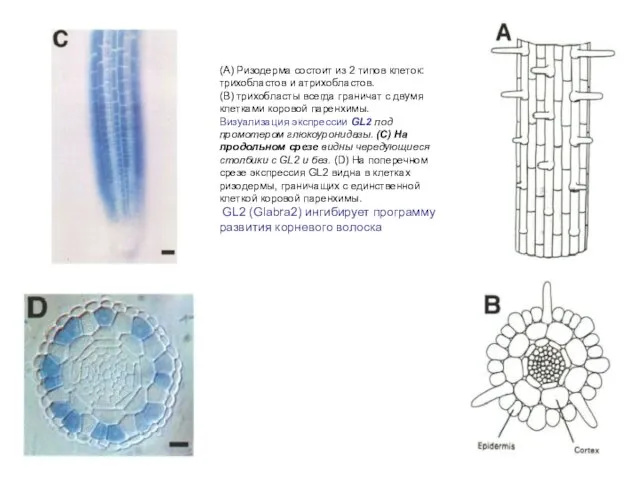
- 25. (A) Ризодерма состоит из 2 типов клеток: трихобластов и атрихобластов. (B) трихобласты всегда граничат с двумя
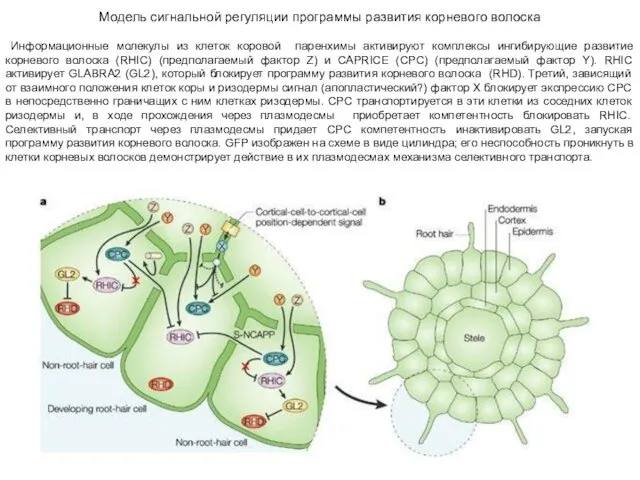
- 26. Модель сигнальной регуляции программы развития корневого волоска Информационные молекулы из клеток коровой паренхимы активируют комплексы ингибирующие
- 27. Латеральные меристемы: прокамбий, камбий. Их производные.
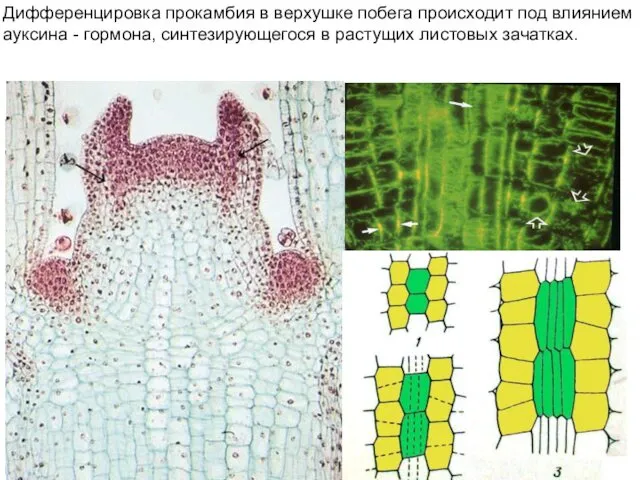
- 29. Дифференцировка прокамбия в верхушке побега происходит под влиянием ауксина - гормона, синтезирующегося в растущих листовых зачатках.
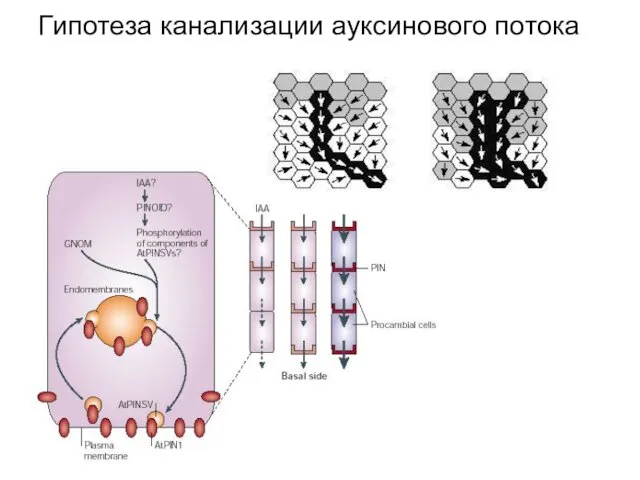
- 30. Гипотеза канализации ауксинового потока
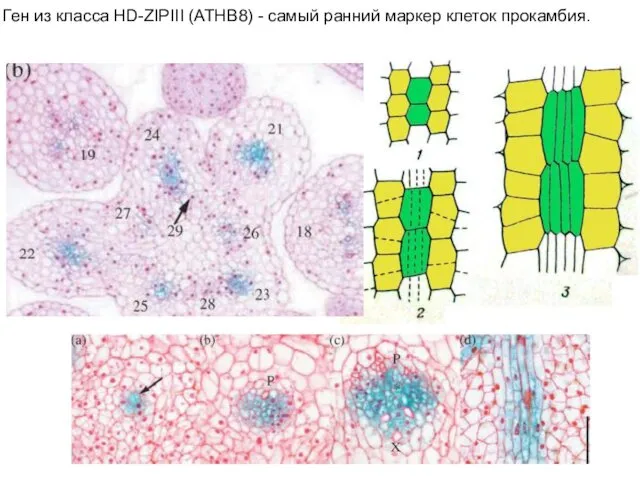
- 31. Ген из класса HD-ZIPIII (ATHB8) - самый ранний маркер клеток прокамбия.
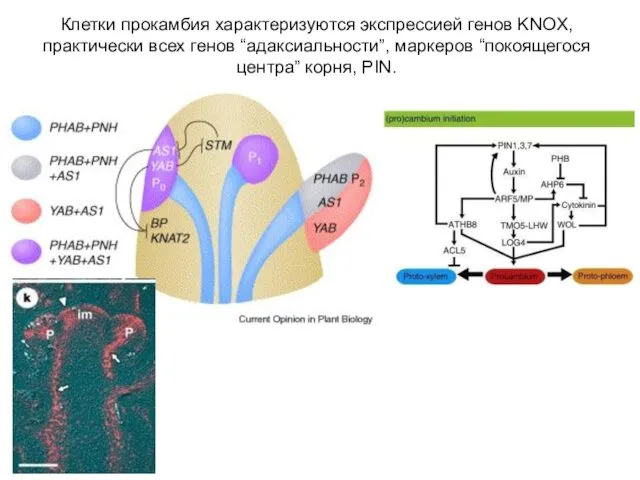
- 32. Клетки прокамбия характеризуются экспрессией генов KNOX, практически всех генов “адаксиальности”, маркеров “покоящегося центра” корня, PIN.
- 33. Сходства и различия прокамбия и камбия.
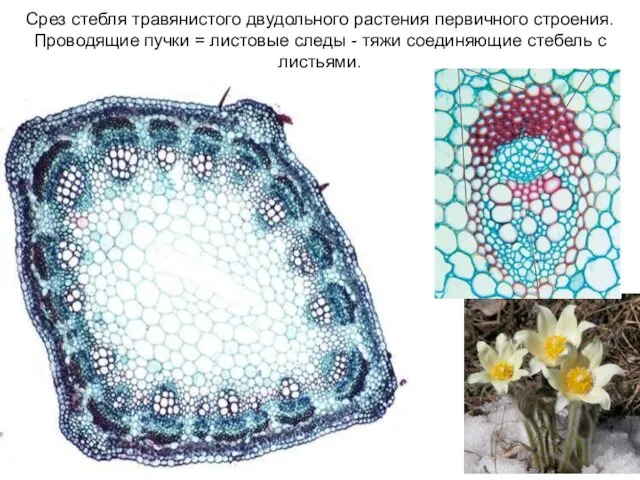
- 34. Срез стебля травянистого двудольного растения первичного строения. Проводящие пучки = листовые следы - тяжи соединяющие стебель
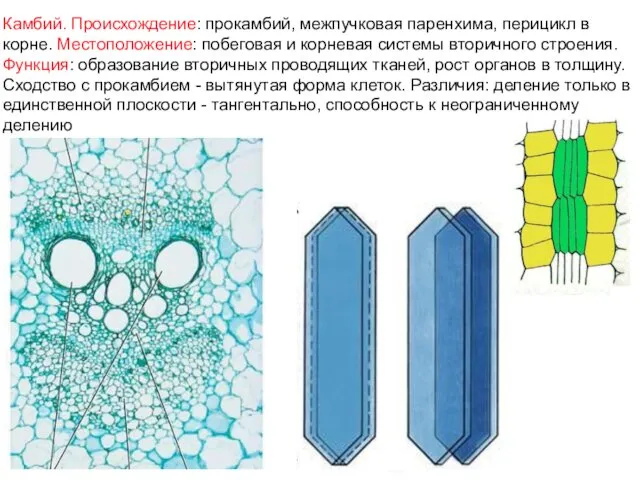
- 35. Камбий. Происхождение: прокамбий, межпучковая паренхима, перицикл в корне. Местоположение: побеговая и корневая системы вторичного строения. Функция:
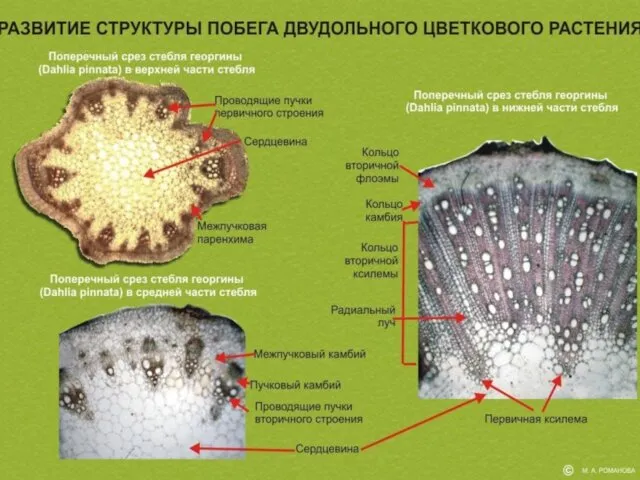
- 36. Образовние камбия - еще одной “бессмертной” ткани и переход от пучкового строения стебля к кольцевому
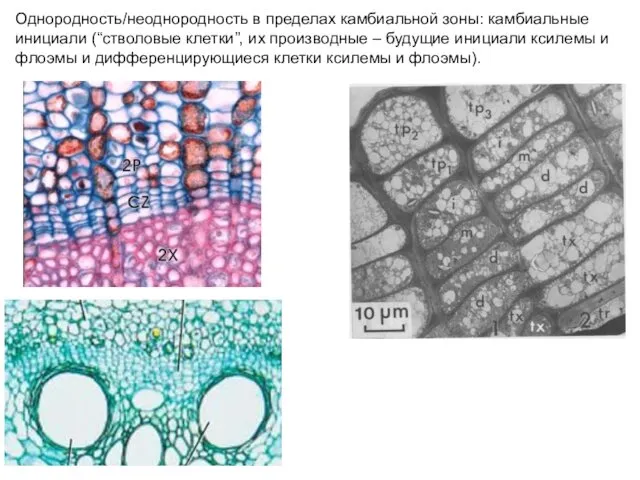
- 38. Однородность/неоднородность в пределах камбиальной зоны: камбиальные инициали (“стволовые клетки”, их производные – будущие инициали ксилемы и
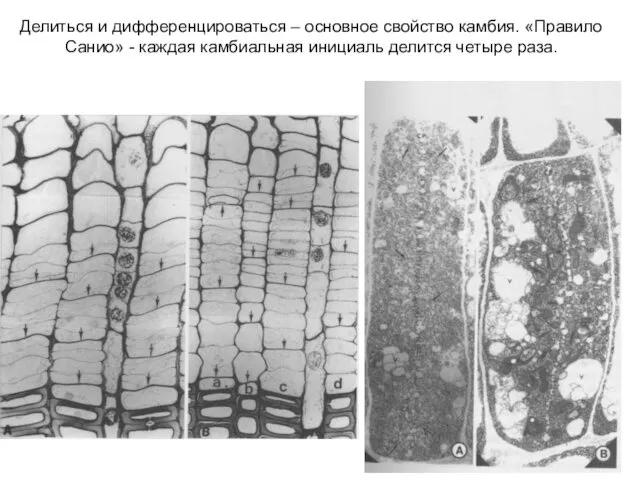
- 39. Делиться и дифференцироваться – основное свойство камбия. «Правило Санио» - каждая камбиальная инициаль делится четыре раза.
- 40. Nature Reviews Molecular Cell Biology 2; 33-39 (2001); Laurie G. Smith PLANT CELL DIVISION: BUILDING WALLS
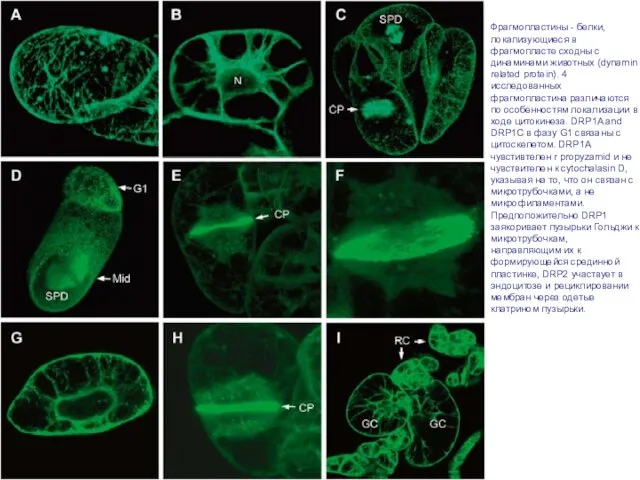
- 41. Phragmoplastin dynamics: multiple forms, microtubule association and their roles in cell plate formation in plants Zonglie
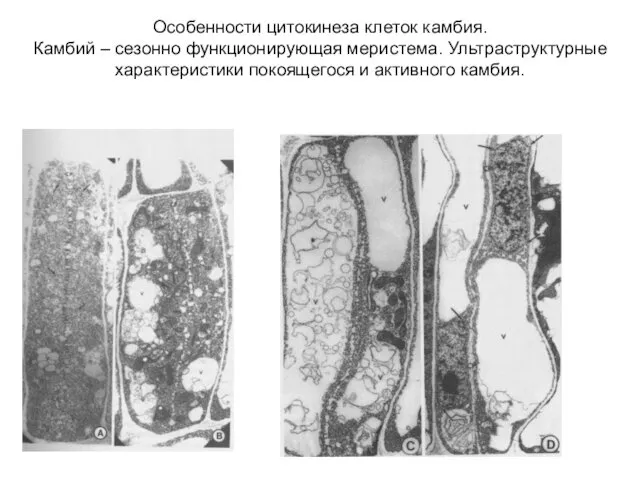
- 42. Особенности цитокинеза клеток камбия. Камбий – сезонно функционирующая меристема. Ультраструктурные характеристики покоящегося и активного камбия.
- 43. Камбий – еще одна ниша стволовых клеток в теле растения?
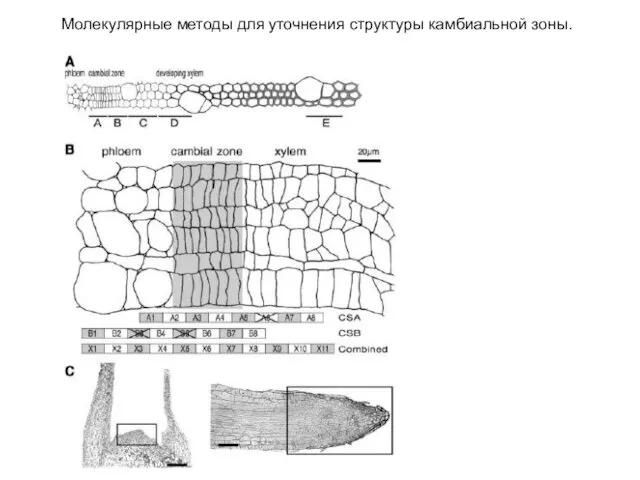
- 44. Молекулярные методы для уточнения структуры камбиальной зоны.
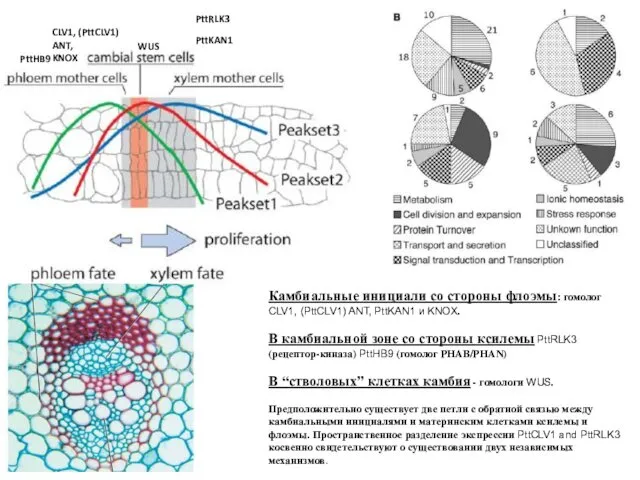
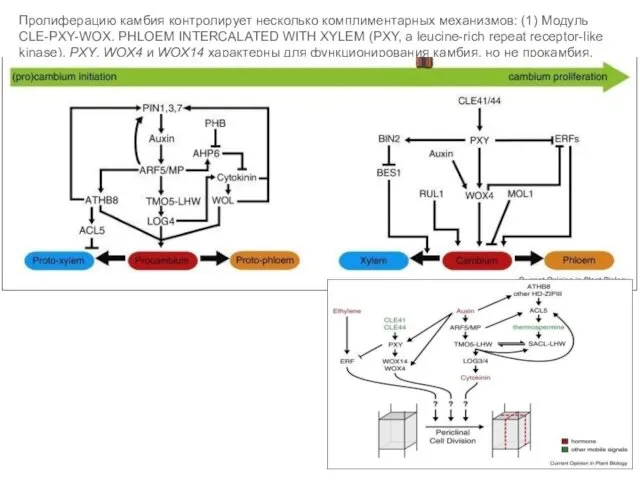
- 47. Камбиальные инициали со стороны флоэмы: гомолог CLV1, (PttCLV1) ANT, PttKAN1 и KNOX. В камбиальной зоне со
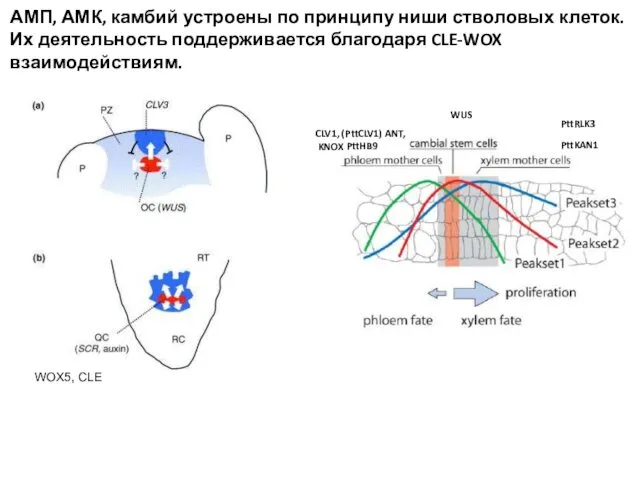
- 48. АМП, АМК, камбий устроены по принципу ниши стволовых клеток. Их деятельность поддерживается благодаря CLE-WOX взаимодействиям. WOX5,
- 49. Пролиферацию камбия контролирует несколько комплиментарных механизмов: (1) Модуль CLE-PXY-WOX. PHLOEM INTERCALATED WITH XYLEM (PXY, a leucine-rich
- 50. Транскрипционные факторы - “мегарегуляторы” “мегапрограмм” развития KNOX CLE (CLAVATA-подобные) WOX (WUS-подобные) HD-ZIP III KANADI и YABBY
- 51. Экспрессия ТФ нередко находится под контролем фитогормонов ФИТОГОРМОНЫ, органические вещества небольшого молекулярного веса, образуемые в малых
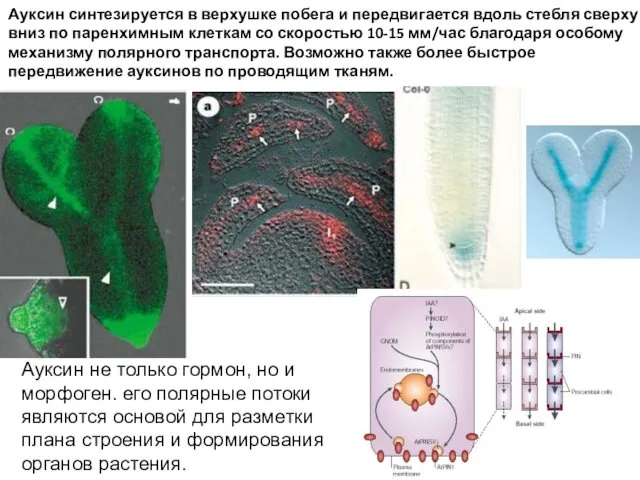
- 52. Ауксин синтезируется в верхушке побега и передвигается вдоль стебля сверху вниз по паренхимным клеткам со скоростью
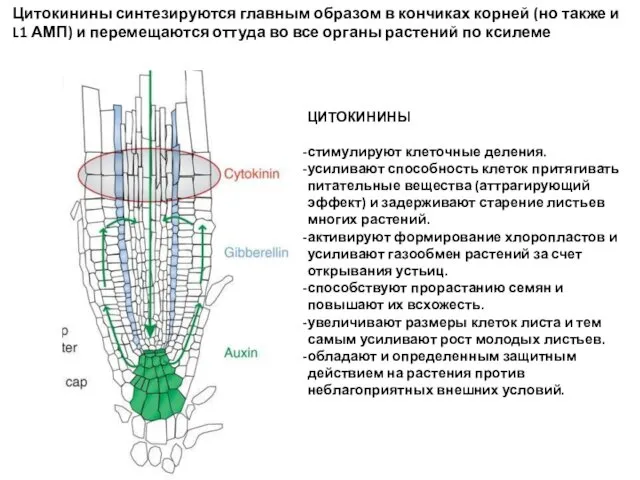
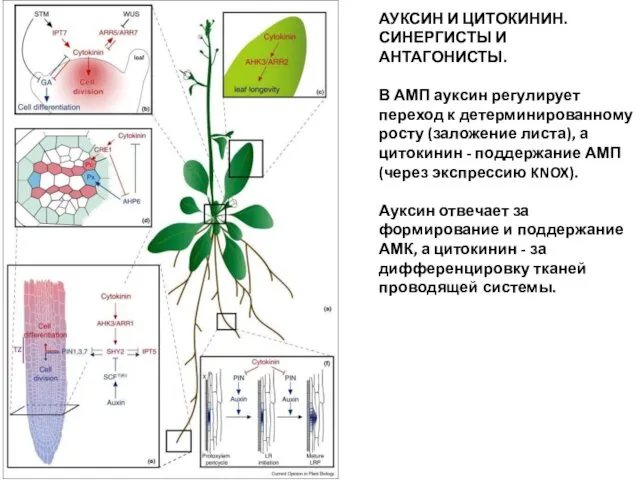
- 53. Цитокинины синтезируются главным образом в кончиках корней (но также и L1 АМП) и перемещаются оттуда во
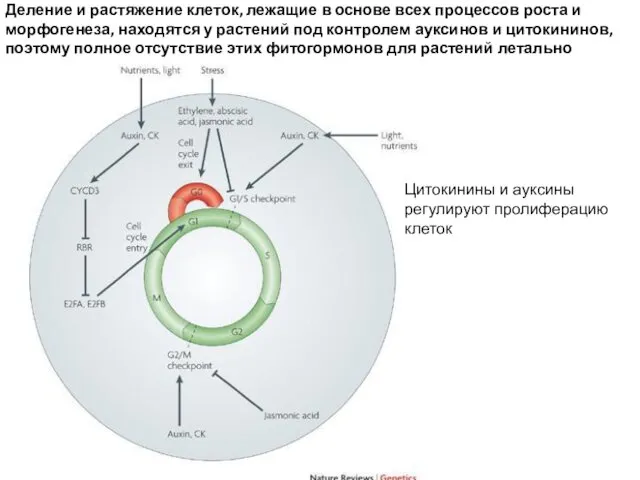
- 54. Mitogenic signals are required for proper progression of the cell cycle. A lack of these signals
- 55. Формирование корней на побегах Формирование корней в каллусе Формирование каллуса Развитие придаточных почек Развитие пазушных почек
- 56. Molecular mechanisms of cytokinin action in different Arabidopsis plant organs. (a) Cartoon of an adult Arabidopsis
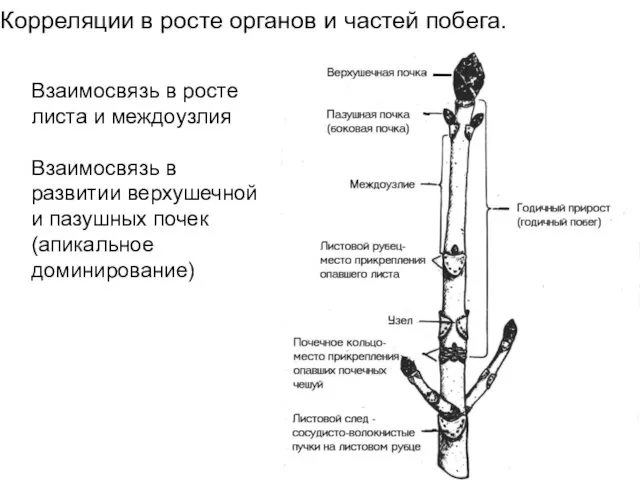
- 57. Корреляции в росте органов и частей побега. Взаимосвязь в росте листа и междоузлия Взаимосвязь в развитии
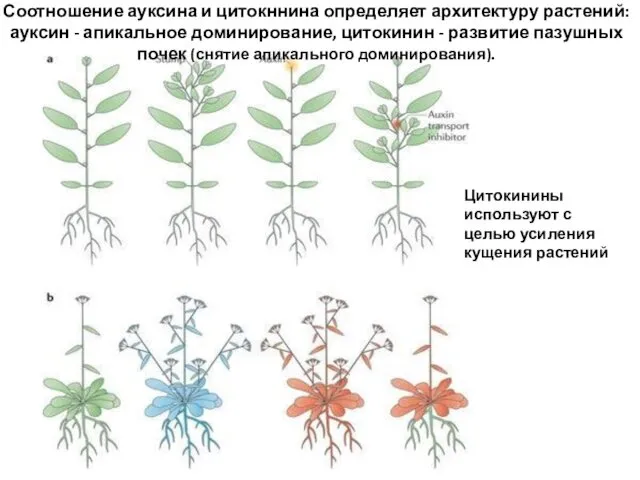
- 58. Соотношение ауксина и цитокннина определяет архитектуру растений: ауксин - апикальное доминирование, цитокинин - развитие пазушных почек
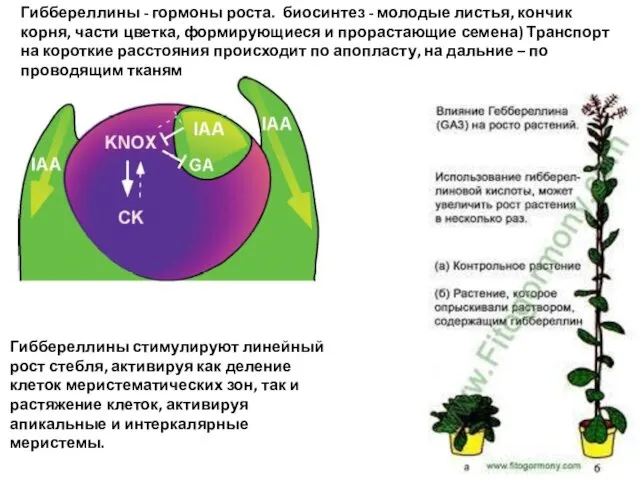
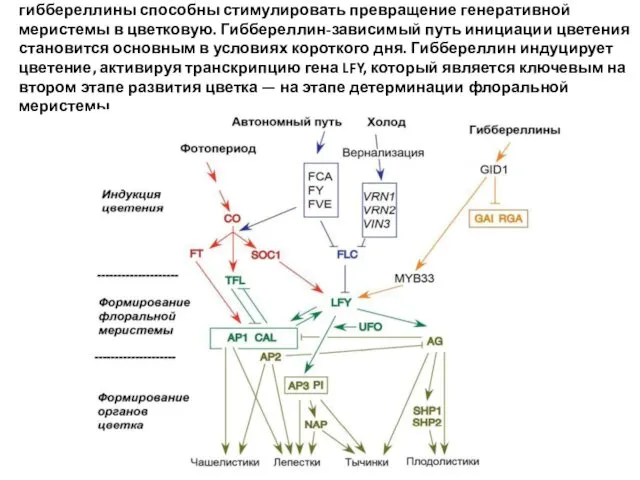
- 59. Гиббереллины - гормоны роста. биосинтез - молодые листья, кончик корня, части цветка, формирующиеся и прорастающие семена)
- 60. гиббереллины способны стимулировать превращение генеративной меристемы в цветковую. Гиббереллин-зависимый путь инициации цветения становится основным в условиях
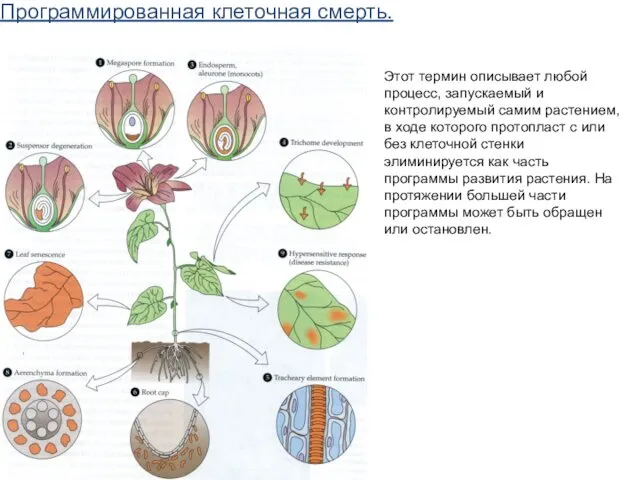
- 61. Программированная клеточная смерть. Этот термин описывает любой процесс, запускаемый и контролируемый самим растением, в ходе которого
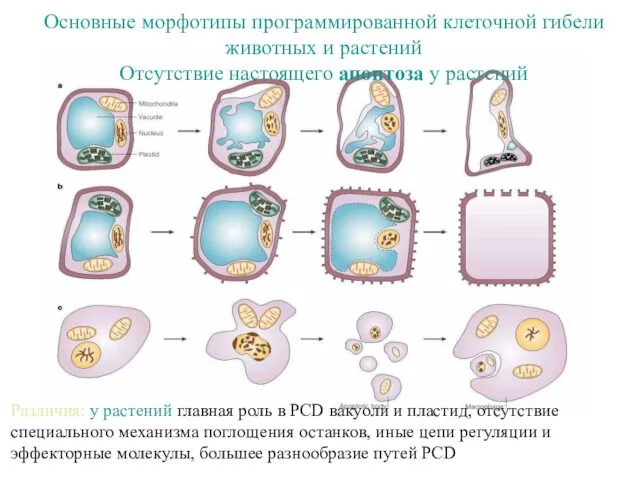
- 62. Основные морфотипы программированной клеточной смерти гибели у растений 1. Гиперчувствительная реакция (HR) или патогенез. Относительно быстро
- 63. Различия: у растений главная роль в PCD вакуоли и пластид, отсутствие специального механизма поглощения останков, иные
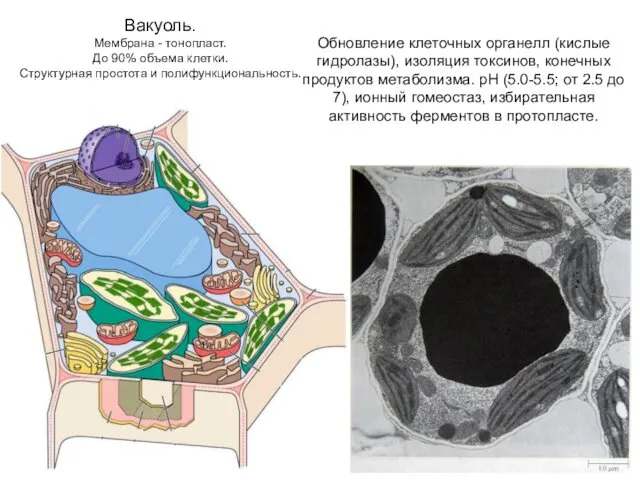
- 64. Вакуоль. Мембрана - тонопласт. До 90% объема клетки. Структурная простота и полифункциональность. Обновление клеточных органелл (кислые
- 65. Программированная клеточная смерть. Автофагия. самоперевариванивание посредством автофагосом с последующей секрецией их содержимого в центральную вакуоль (атофагия)
- 66. Программированная клеточная смерть. Автофагия, остановленная на полпути. Интактная плазмалемма. Ситовидные элементы.
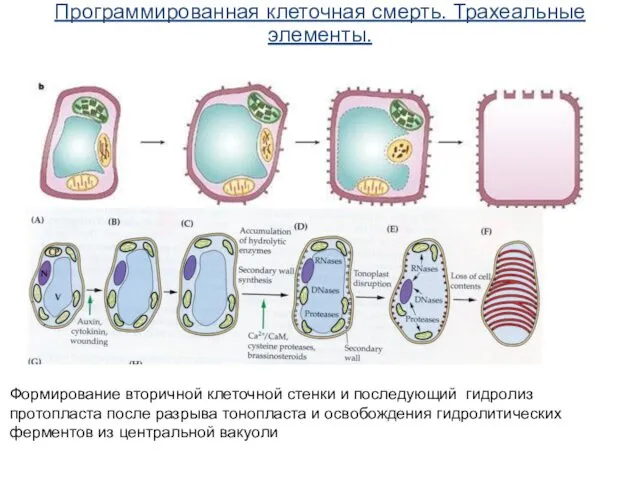
- 67. Программированная клеточная смерть. Трахеальные элементы. Формирование вторичной клеточной стенки и последующий гидролиз протопласта после разрыва тонопласта
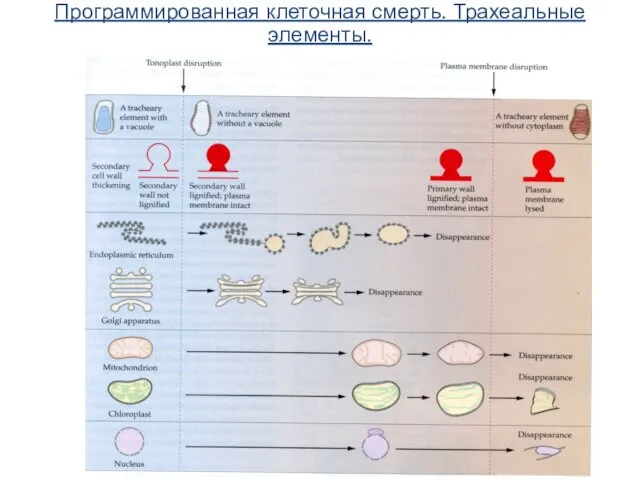
- 68. Программированная клеточная смерть. Трахеальные элементы.
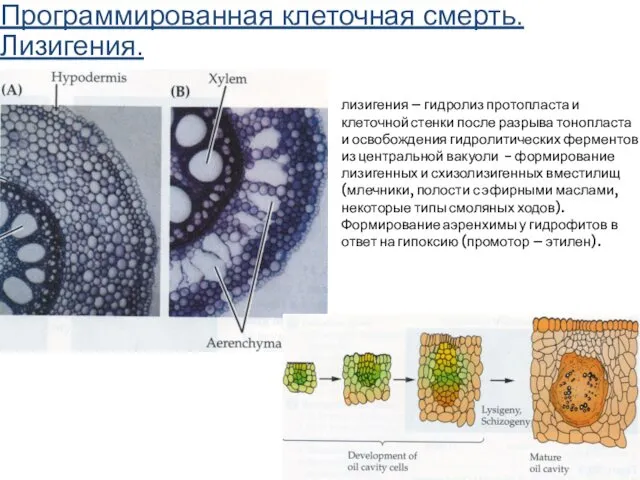
- 69. Программированная клеточная смерть. Лизигения. лизигения – гидролиз протопласта и клеточной стенки после разрыва тонопласта и освобождения
- 70. Старение. Хромопласты. Основные пигменты каротиноиды, ксантофиллы. Окраска цветков, плодов, осенних листьев. Многочисленные масляные тельца. упорядоченная разборка
- 71. БРАССИНОСТЕРОИДЫ, группа природных регуляторов роста растений, производные ненасыщенных оксистероидов с лактонной группой в кольце В. Ускоряют
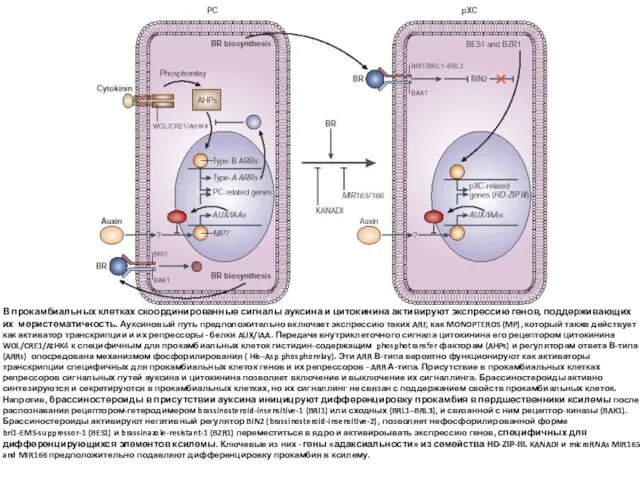
- 72. В прокамбиальных клетках скоординированные сигналы ауксина и цитокинина активируют экспрессию генов, поддерживающих их меристематичность. Ауксиновый путь
- 73. in vitro трансдифференцировка клеток мезофилла (MC) в элементы ксилемы. Стадия 1. Утрата способности к фотосинтезу и
- 74. АБК в листьях, а также в корневом чехлике. Транспорт на короткие расстояния происходит путем диффузии, на
- 75. Стрессовые воздействия (ранения, водный дефицит, низкая температура), а также высокие концентрации ауксинов и, иногда, цитокининов резко
- 76. Механизм действия фитогормонов в основных чертах сходен с механизмом действия гормонов животных. Чувствительные клетки воспринимают гормон
- 78. Скачать презентацию























 Грибы съедобные и несъедобные
Грибы съедобные и несъедобные Половое и бесполое размножение Обобщение
Половое и бесполое размножение Обобщение Микроскопические грибы в жизни человека
Микроскопические грибы в жизни человека Как зимуют травы, кустарники, деревья
Как зимуют травы, кустарники, деревья Половая система
Половая система Высшая нервная деятельность. Высшие мозговые функции
Высшая нервная деятельность. Высшие мозговые функции Размножение организмов 6 класс - Презентация
Размножение организмов 6 класс - Презентация Головной мозг
Головной мозг Анализаторы. Органы чувств. Глаз. Ухо
Анализаторы. Органы чувств. Глаз. Ухо Биологические свойства вирусов
Биологические свойства вирусов Особливості Хамелеону
Особливості Хамелеону Состав йогурта с картофельной клетчаткой
Состав йогурта с картофельной клетчаткой Сходство и различия клеток растений грибов и животных
Сходство и различия клеток растений грибов и животных Рептилии. Происхождение рептилий
Рептилии. Происхождение рептилий Систематика эукариотов и прокариотов. Морфология микроорганизмов (лекции №1)
Систематика эукариотов и прокариотов. Морфология микроорганизмов (лекции №1) Ткани животных
Ткани животных Презентация на тему Генетически модифицированные продукты
Презентация на тему Генетически модифицированные продукты Химический состав клетки. Белки (протеины)
Химический состав клетки. Белки (протеины) Особенности строения и жизнедеятельности Ракообразных
Особенности строения и жизнедеятельности Ракообразных Презентация на тему "Привычки и здоровье" - скачать презентации по Биологии
Презентация на тему "Привычки и здоровье" - скачать презентации по Биологии МИНЗДРАВ И МЫ ПРЕДУПРЕЖДАЕМ... Выполнила учащаяся 6 класса Исмоилова Луиза Руководитель проекта учитель ИКТ
МИНЗДРАВ И МЫ ПРЕДУПРЕЖДАЕМ... Выполнила учащаяся 6 класса Исмоилова Луиза Руководитель проекта учитель ИКТ  Селекция – эволюция, направляемая человеком
Селекция – эволюция, направляемая человеком Антропогенные экосистемы С.Е. ДРОМАШКО
Антропогенные экосистемы С.Е. ДРОМАШКО  Растения-паразиты Презентация к уроку экологии в 6 классе
Растения-паразиты Презентация к уроку экологии в 6 классе  Жан Батист Ламарк. 1744 ― 1828
Жан Батист Ламарк. 1744 ― 1828 Мутации
Мутации Физиология ретикулярной формации
Физиология ретикулярной формации Формула цветка
Формула цветка