Содержание
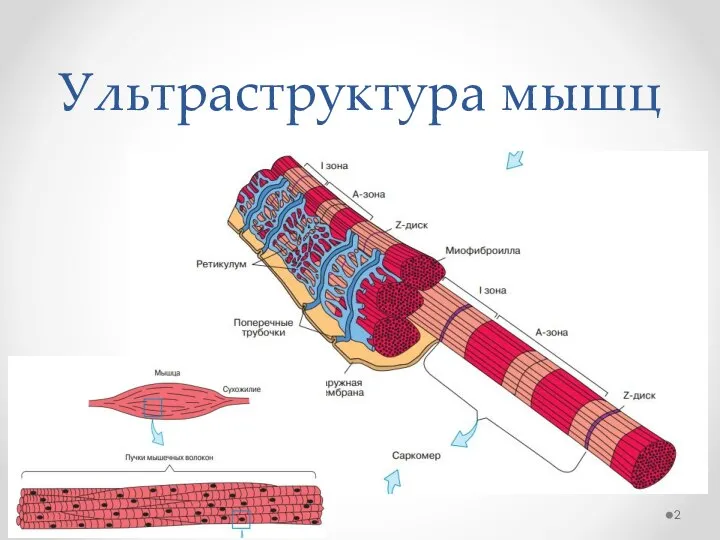
- 2. Ультраструктура мышц
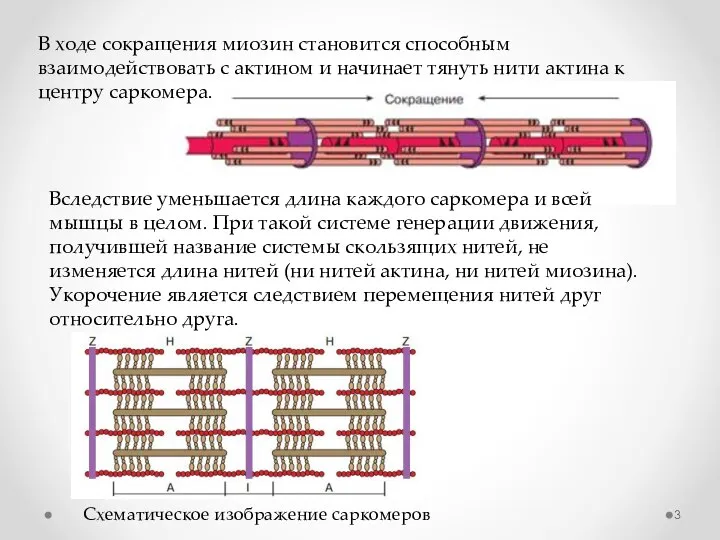
- 3. Схематическое изображение саркомеров В ходе сокращения миозин становится способным взаимодействовать с актином и начинает тянуть нити
- 4. Строение и свойство актина Актин был открыт в 1948 году венгерским биохимиком Бруно Штраубом. Мономеры актина
- 5. Строение и свойства миозина В состав молекулы миозина скелетных мышц входят шесть полипептидных цепей — две
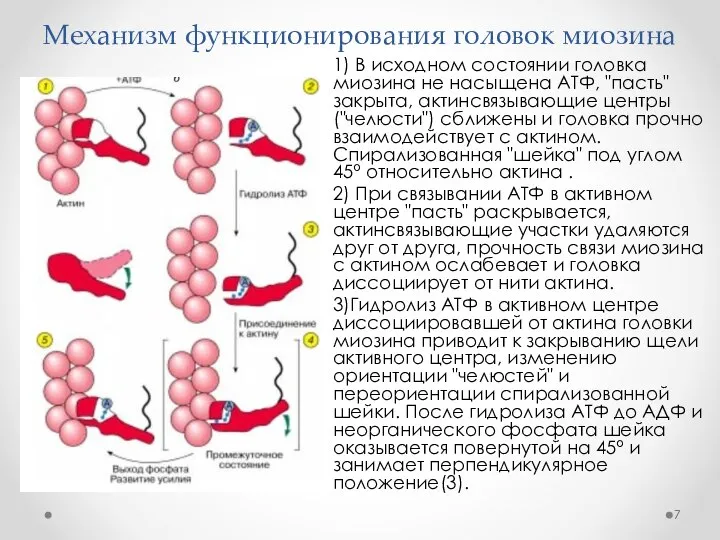
- 6. Механизм функционирования головок миозина В головке миозина можно выявить три основные части. N-концевая часть головки миозина
- 7. Механизм функционирования головок миозина 1) В исходном состоянии головка миозина не насыщена АТФ, "пасть" закрыта, актинсвязывающие
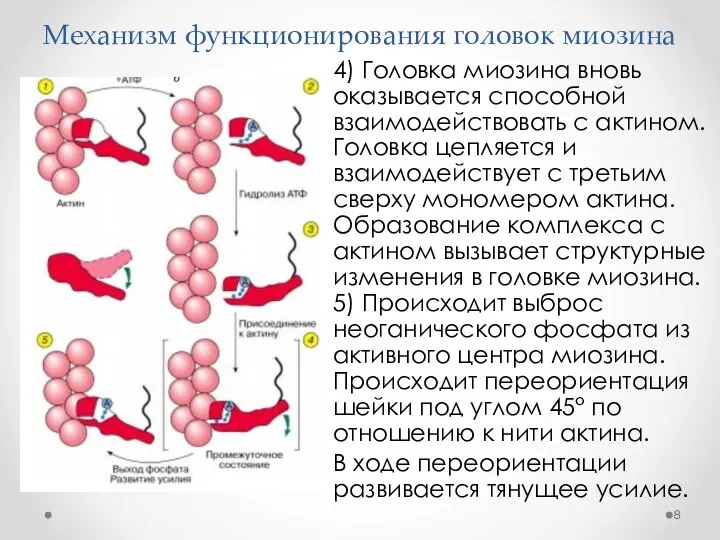
- 8. Механизм функционирования головок миозина 4) Головка миозина вновь оказывается способной взаимодействовать с актином. Головка цепляется и
- 9. Миозиновый тип регуляции сократительной активности Простейший способ миозиновой регуляции описан для некоторых мышц моллюсков. Миозин моллюсков
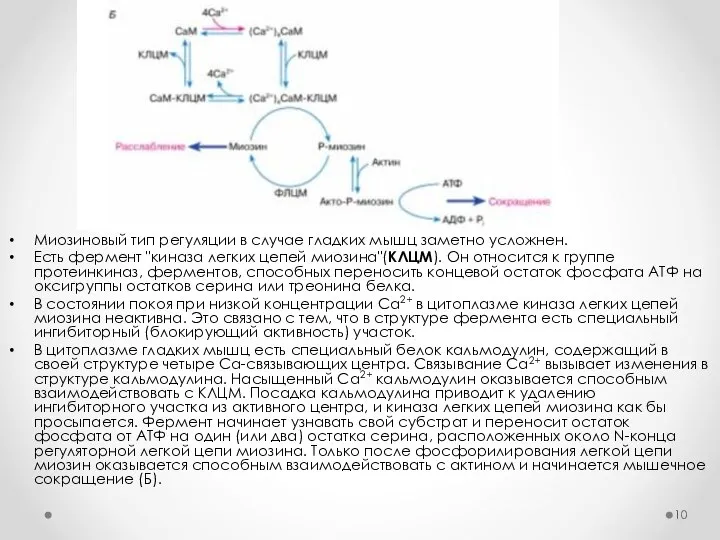
- 10. Миозиновый тип регуляции в случае гладких мышц заметно усложнен. Есть фермент "киназа легких цепей миозина"(КЛЦМ). Он
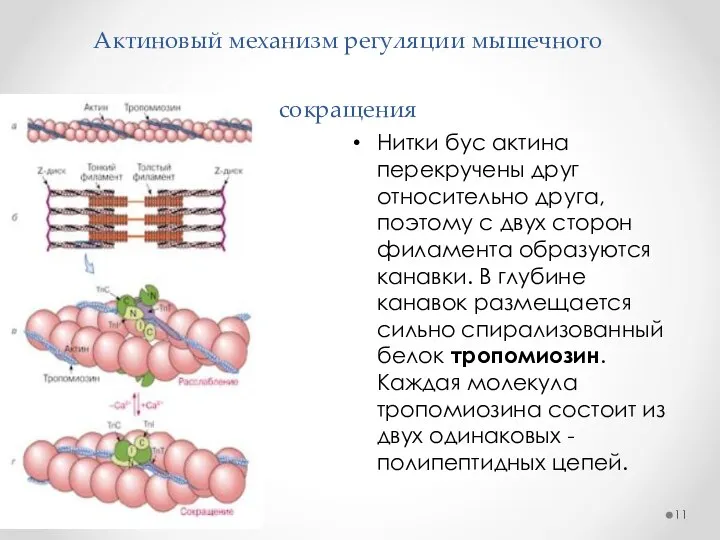
- 11. Актиновый механизм регуляции мышечного сокращения Нитки бус актина перекручены друг относительно друга, поэтому с двух сторон
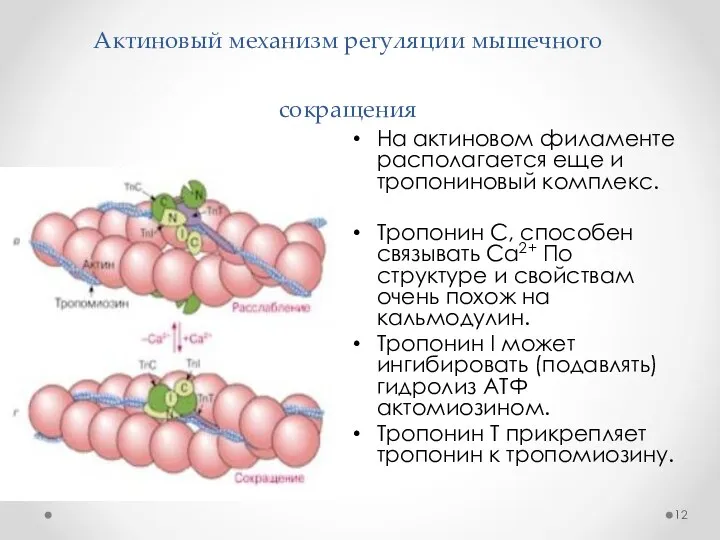
- 12. Актиновый механизм регуляции мышечного сокращения На актиновом филаменте располагается еще и тропониновый комплекс. Тропонин С, способен
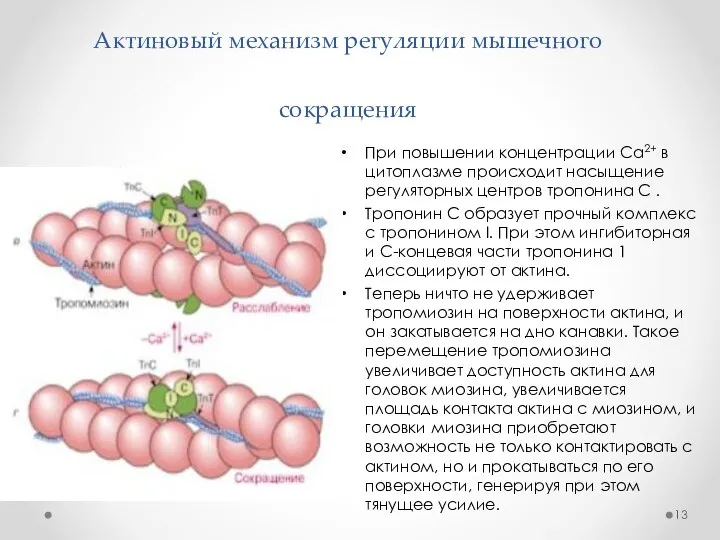
- 13. Актиновый механизм регуляции мышечного сокращения При повышении концентрации Са2+ в цитоплазме происходит насыщение регуляторных центров тропонина
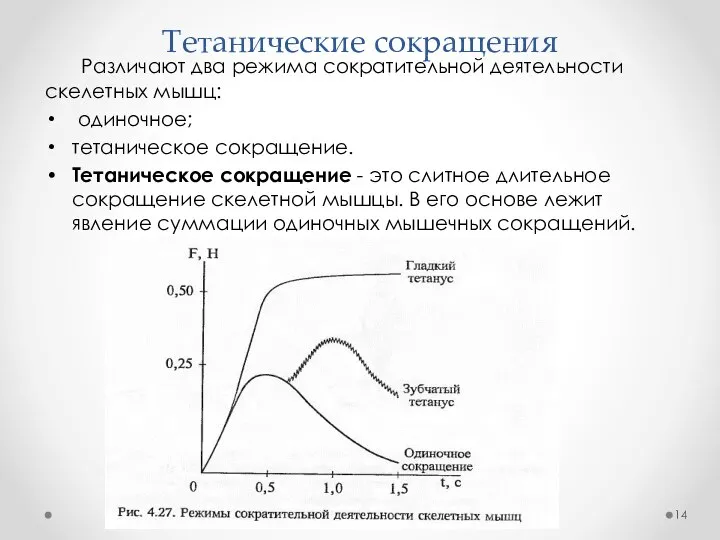
- 14. Тетанические сокращения Различают два режима сократительной деятельности скелетных мышц: одиночное; тетаническое сокращение. Тетаническое сокращение - это
- 16. Скачать презентацию




 Презентация на тему "Вид – эволюционная единица, его критерии и структура" - скачать презентации по Биологии
Презентация на тему "Вид – эволюционная единица, его критерии и структура" - скачать презентации по Биологии Аттестационная работа. Программа элективного курса Сложные вопросы в изучении биологии
Аттестационная работа. Программа элективного курса Сложные вопросы в изучении биологии Транспорт химических веществ в биологических мембранах
Транспорт химических веществ в биологических мембранах Мезозойская эра
Мезозойская эра Полевые цветы
Полевые цветы Обратные связи в природе Мирошиков И. 9 «А»
Обратные связи в природе Мирошиков И. 9 «А» Пищеварение в ротовой полости _
Пищеварение в ротовой полости _ АТЕРОСКЛЕРОЗ БОЛЕЗНЬ ЦИВИЛИЗАЦИИ Шидьюсова Анастасия 243 группа
АТЕРОСКЛЕРОЗ БОЛЕЗНЬ ЦИВИЛИЗАЦИИ Шидьюсова Анастасия 243 группа  Общая физиология нервной системы
Общая физиология нервной системы Бактреии. Что раньше: клеточное строение или наличие ядра?
Бактреии. Что раньше: клеточное строение или наличие ядра? English riddles. Животные
English riddles. Животные Биомеханика
Биомеханика Птицы жарких стран
Птицы жарких стран Дигибридное скрещивание (тема и дата записываются в тетрадь по биологии)
Дигибридное скрещивание (тема и дата записываются в тетрадь по биологии) Лисица обыкновенная
Лисица обыкновенная Ткани растений
Ткани растений Презентация к уроку биологии на тему: «Иммунитет» 8 класс Выполнила: учитель химии и биологии НОУ СОШ «Кристалл» Жданова Надежда
Презентация к уроку биологии на тему: «Иммунитет» 8 класс Выполнила: учитель химии и биологии НОУ СОШ «Кристалл» Жданова Надежда  Проблема индивидуальности человека в современной науке
Проблема индивидуальности человека в современной науке Презентация на тему "Общая Характеристика водорослей" - скачать презентации по Биологии
Презентация на тему "Общая Характеристика водорослей" - скачать презентации по Биологии Областной конкурс Областной конкурс «Учитель года-2007» Светлана Александровна Головкина, учитель биологии МОУ СОШ №19 г. Ми
Областной конкурс Областной конкурс «Учитель года-2007» Светлана Александровна Головкина, учитель биологии МОУ СОШ №19 г. Ми Мелколиственные леса как кормовые угодья
Мелколиственные леса как кормовые угодья Головной мозг. Ствол, мозжечок, конечный мозг
Головной мозг. Ствол, мозжечок, конечный мозг Гуморальна регуляція вісцеральних функцій
Гуморальна регуляція вісцеральних функцій Презентация на тему "Пиелонефрит" - скачать бесплатно презентации по Биологии
Презентация на тему "Пиелонефрит" - скачать бесплатно презентации по Биологии World without bees. What if all the bees die out?
World without bees. What if all the bees die out? Тип Кольчатые черви
Тип Кольчатые черви Животный мир Астраханской области
Животный мир Астраханской области Презентация на тему "Кристаллические решетки" - скачать презентации по Биологии
Презентация на тему "Кристаллические решетки" - скачать презентации по Биологии