Содержание
- 2. Вопросы из билетов по теме Понятие о биологической ценности белков. Роль белков в питании. Заменимые и
- 3. Структура темы Белки: переваривание (распад до аминокислот), биологическая ценность Катаболизм азота аминокислот: Удаление аминогруппы из аминокислоты
- 4. Полезно выучить структуры: Аланин/пируват (из гликолиза) Аспартат / оксалоацетат (из ЦТК) Глутамат / α-кетоглутарат (из ЦТК)
- 5. БЕЛКИ: ПЕРЕВАРИВАНИЕ
- 6. Переваривание белков: ферменты Общая характеристика: ферменты, расщепляющие пептидные связи (= переваривание) называются протеазы. Это гидролазы (класс
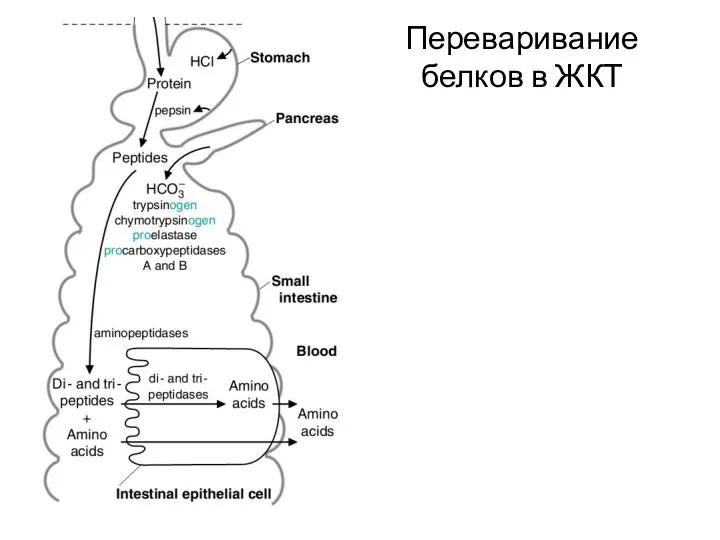
- 7. Переваривание белков в ЖКТ
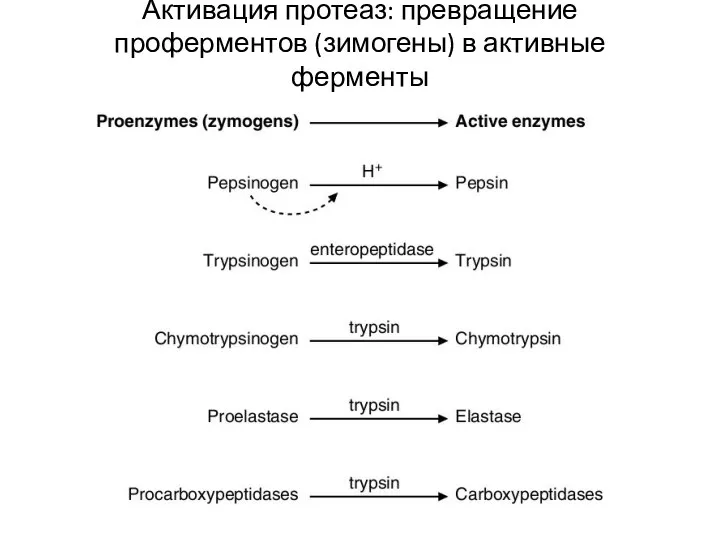
- 8. Активация протеаз: превращение проферментов (зимогены) в активные ферменты
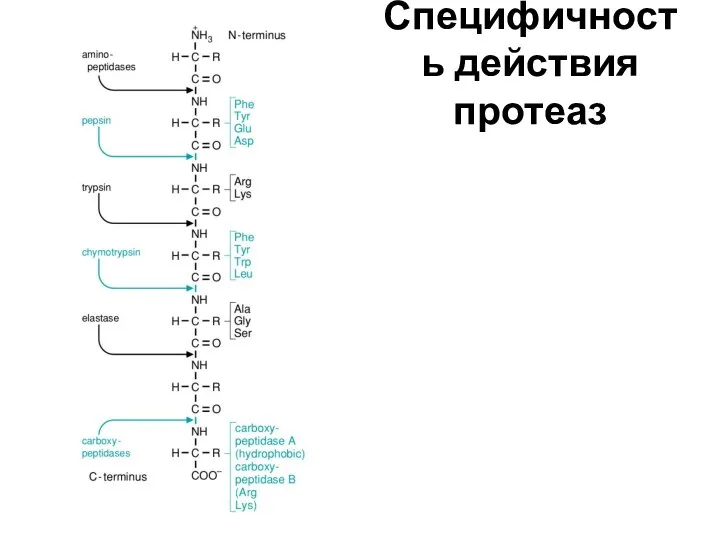
- 9. Специфичность действия протеаз
- 10. Активация химотрипсина в кишечнике: показаны изменения в цепи, но не забываем, что в реальности в пространстве
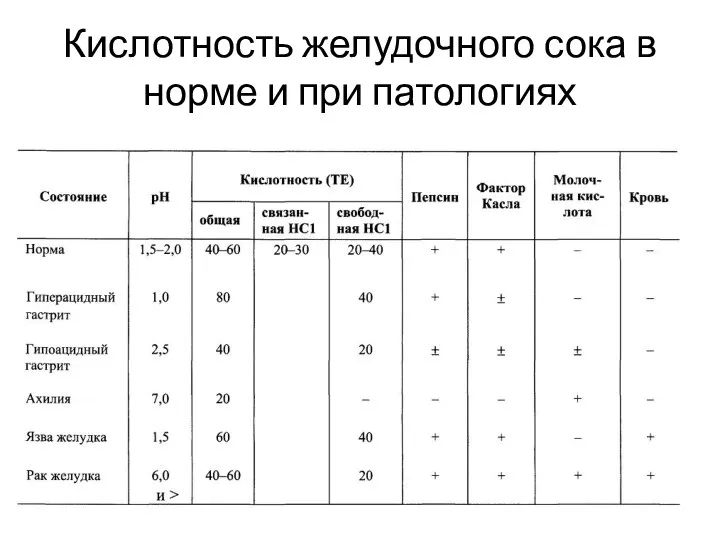
- 11. Кислотность желудочного сока в норме и при патологиях
- 12. Кислотность желудочного сока В желудочном соке есть несколько факторов, которые обусловливают его кислотность. Это не только
- 13. Количественный анализ желудочного сока Задача: определить количество кислоты в образце желудочного сока Принцип метода: титрование Когда
- 14. Биологическая ценность белка Зависит от содержания заменимых аминокислот (животный белок наиболее сбалансирован по содержанию заменимых и
- 15. Содержание белка (граммы) в 100 граммах мяса и продуктов растительного происхождения Стейк (говядина, жареный) Арахис (сырой)
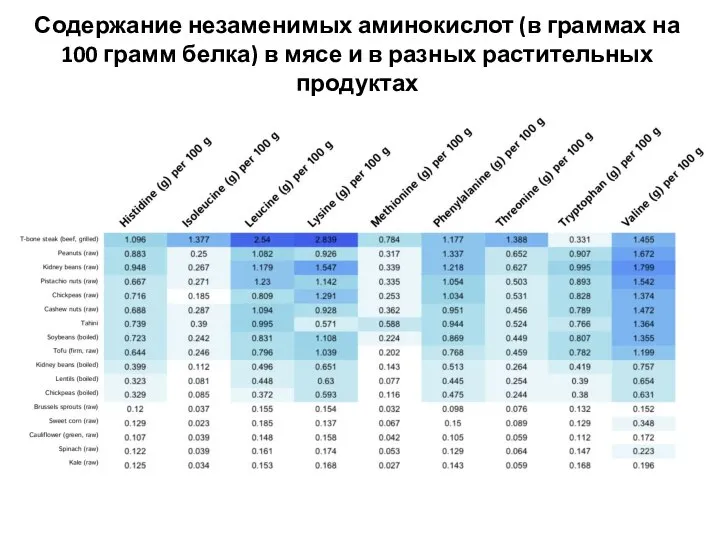
- 16. Содержание незаменимых аминокислот (в граммах на 100 грамм белка) в мясе и в разных растительных продуктах
- 17. КАТАБОЛИЗМ АМИНОКИСЛОТ
- 18. Катаболизм аминокислот Аминокислоты не запасаются в организме Лишние аминокислоты разрушаются: Аминогруппа отщепляется и включается в состав
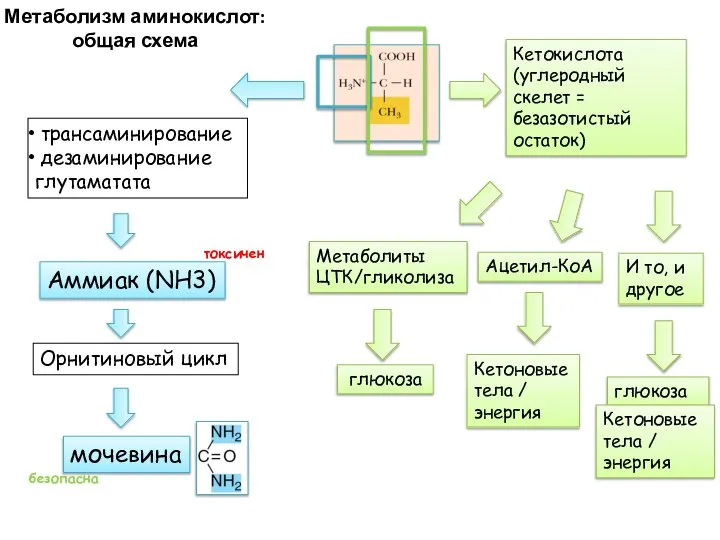
- 19. Метаболизм аминокислот: общая схема мочевина Орнитиновый цикл Аммиак (NH3) трансаминирование дезаминирование глутаматата Кетокислота (углеродный скелет =
- 20. КАТАБОЛИЗМ АЗОТА АМИНОКИСЛОТ
- 21. ТРАНС- И ДЕЗАМИНИРОВАНИЕ ВО ВСЕ СТОРОНЫ
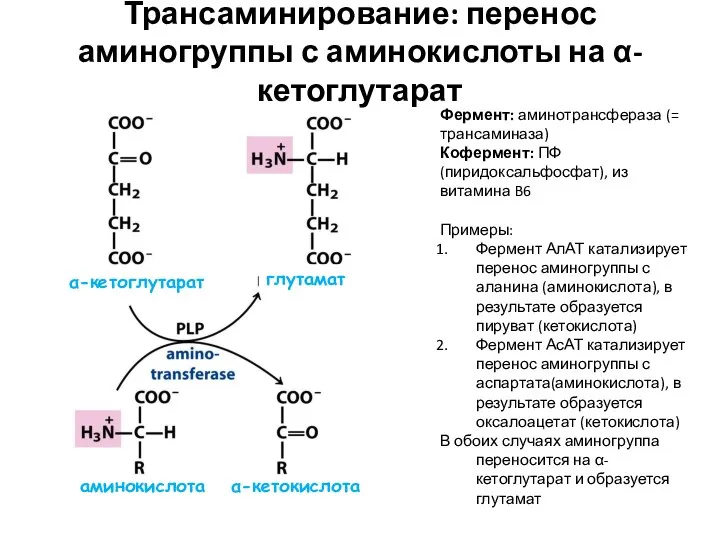
- 22. Трансаминирование Ферменты: трансаминазы (аминотрансферазы) Кофермент: ПФ (пиридоксальфосфат), из витамина В6. Всегда находится в активном центре фермента
- 23. α-кетокислота Трансаминирование: перенос аминогруппы с аминокислоты на α-кетоглутарат аминокислота α-кетоглутарат глутамат Фермент: аминотрансфераза (= трансаминаза) Кофермент:
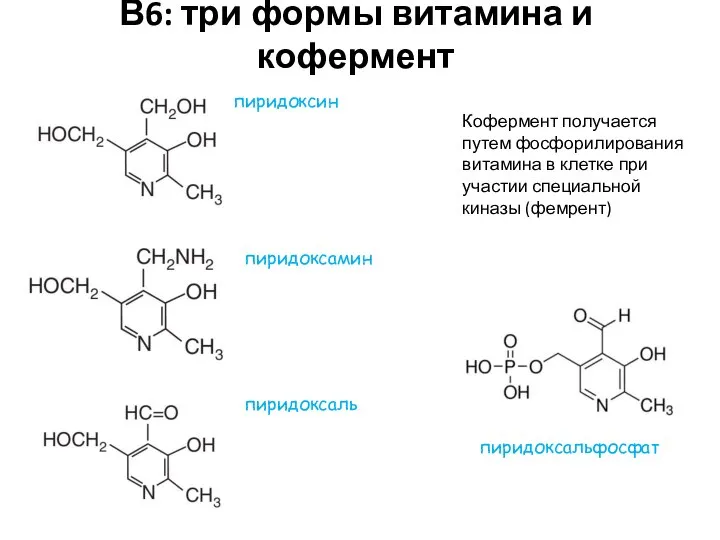
- 24. В6: три формы витамина и кофермент пиридоксин пиридоксаль пиридоксамин пиридоксальфосфат Кофермент получается путем фосфорилирования витамина в
- 25. Дезаминирование (прямое окислительное дезаминирование глутамата) В результате трансаминирования накапливается глутамат При дезаминировании от глутамата отщепляется аминогруппа,
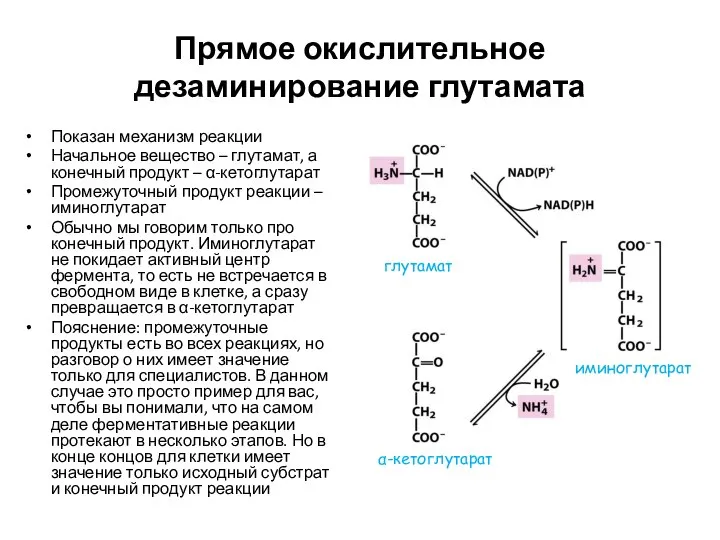
- 26. Прямое окислительное дезаминирование глутамата Показан механизм реакции Начальное вещество – глутамат, а конечный продукт – α-кетоглутарат
- 27. Трансаминирование и дезаминирование обычно работают последовательно и полностью обратимы Трансаминирование а.к. с последующим дезаминированием глутамата =
- 28. Функции Непрямое окислительное дезаминирование а.к. – этап катаболизма почти всех аминокислот Обратный процесс (трансреаминирование) – этап
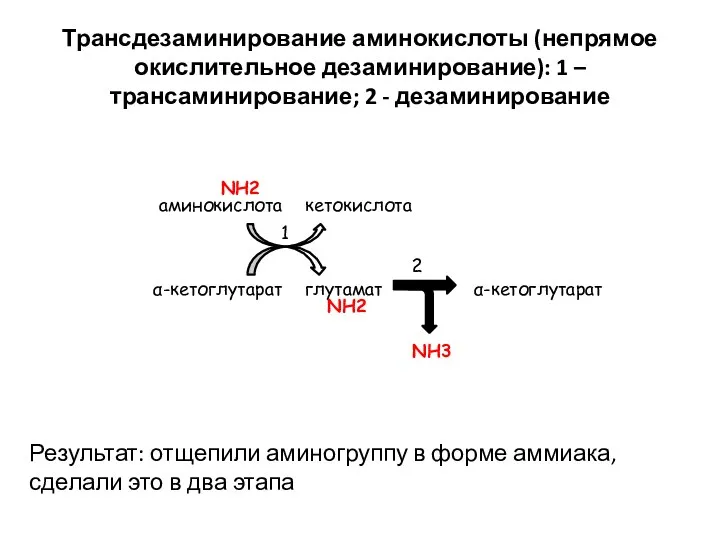
- 29. Трансдезаминирование аминокислоты (непрямое окислительное дезаминирование): 1 – трансаминирование; 2 - дезаминирование аминокислота кетокислота α-кетоглутарат глутамат α-кетоглутарат
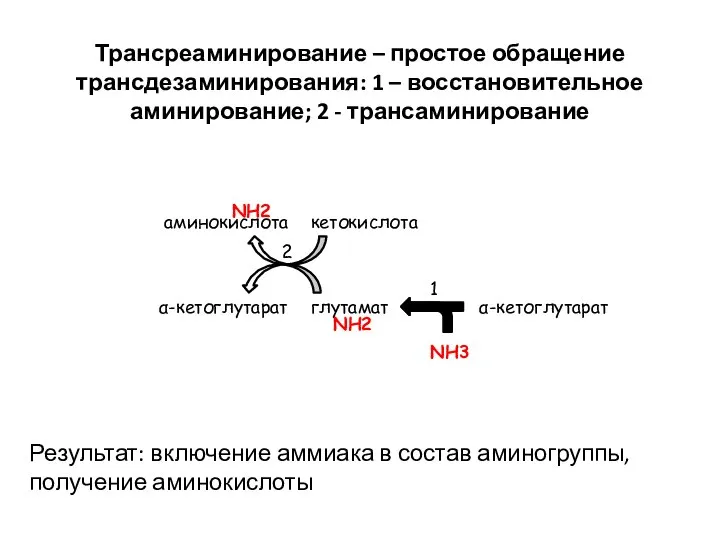
- 30. Трансреаминирование – простое обращение трансдезаминирования: 1 – восстановительное аминирование; 2 - трансаминирование аминокислота кетокислота α-кетоглутарат глутамат
- 31. ПРЯМОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
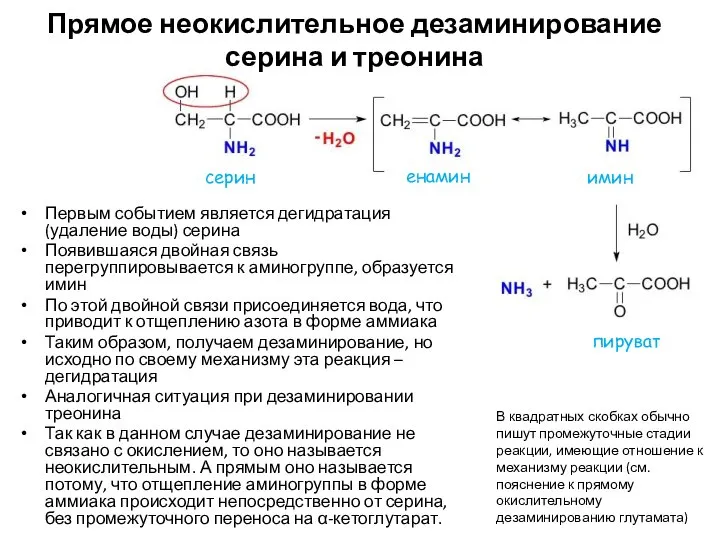
- 32. Некоторые аминокислоты могут дезаминироваться напрямую, т.е. без трансаминирования Серин, треонин. Прямое неокислительное дезаминирование. Ферменты: сериндегидратаза и
- 33. Первым событием является дегидратация (удаление воды) серина Появившаяся двойная связь перегруппировывается к аминогруппе, образуется имин По
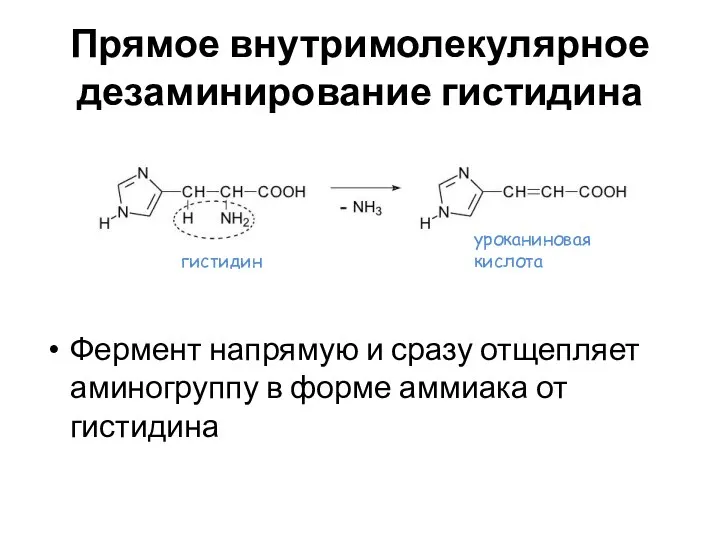
- 34. Прямое внутримолекулярное дезаминирование гистидина Фермент напрямую и сразу отщепляет аминогруппу в форме аммиака от гистидина гистидин
- 35. Сериндегидратаза, треониндегидратаза и гистидаза – примеры лиаз Лиазы (= синтазы, класс 4 в классификации ферментов) –
- 36. ОСНОВНОЙ СПОСОБ ОБЕЗВРЕЖИВАНИЯ АММИАКА: ОРНИТИНОВЫЙ ЦИКЛ (ЦИКЛ МОЧЕВИНООБРАЗОВАНИЯ, ЦИКЛ МОЧЕВИНЫ)
- 37. Цикл мочевины (орнитиновый) Схема: аммиак и аспартат приносят в цикл 2 аминогруппы. В результате серии реакций
- 38. Особенности Все участники, кроме карбамоилфосфата – аминокислоты Требует затраты энергии (3 АТФ) Фермент карбамоилфосфатсинтетаза I –
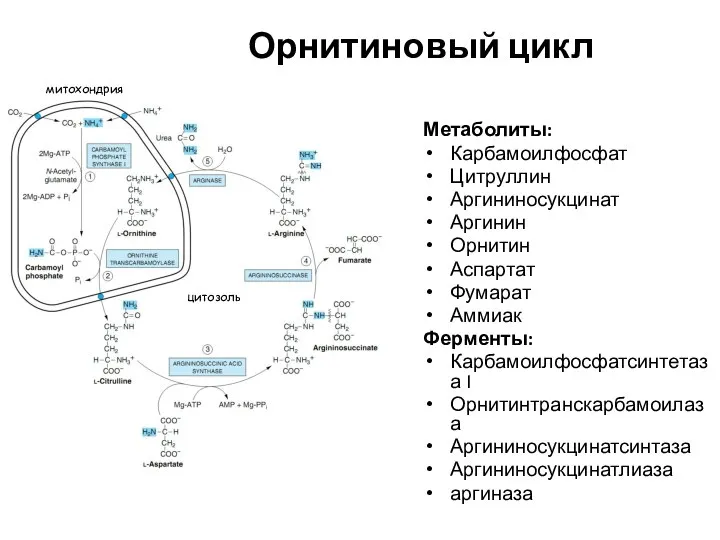
- 39. Орнитиновый цикл Метаболиты: Карбамоилфосфат Цитруллин Аргининосукцинат Аргинин Орнитин Аспартат Фумарат Аммиак Ферменты: Карбамоилфосфатсинтетаза I Орнитинтранскарбамоилаза Аргининосукцинатсинтаза
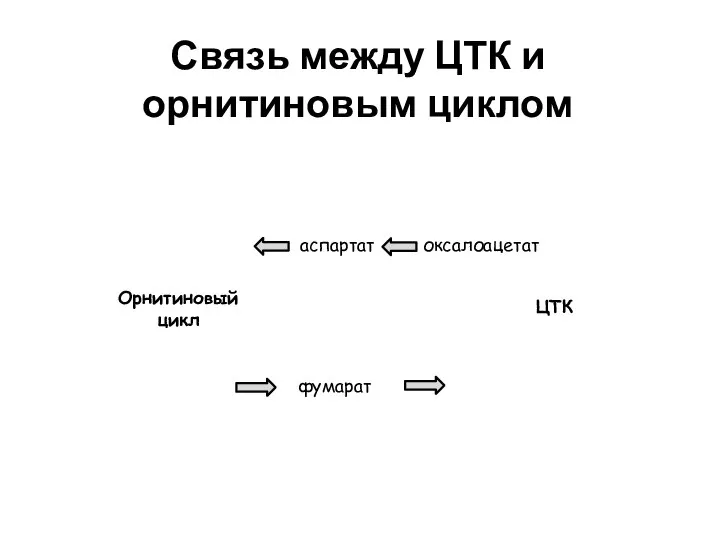
- 40. Связь между ЦТК и орнитиновым циклом ЦТК Орнитиновый цикл фумарат оксалоацетат аспартат
- 41. ДРУГИЕ СПОСОБЫ ОБЕЗВРЕЖИВАНИЯ АММИАКА
- 42. Синтез глутамина и аспарагина из аспартата и глутамата Схема: аммиак присоединяется в глутамату или аспартату Ферменты:
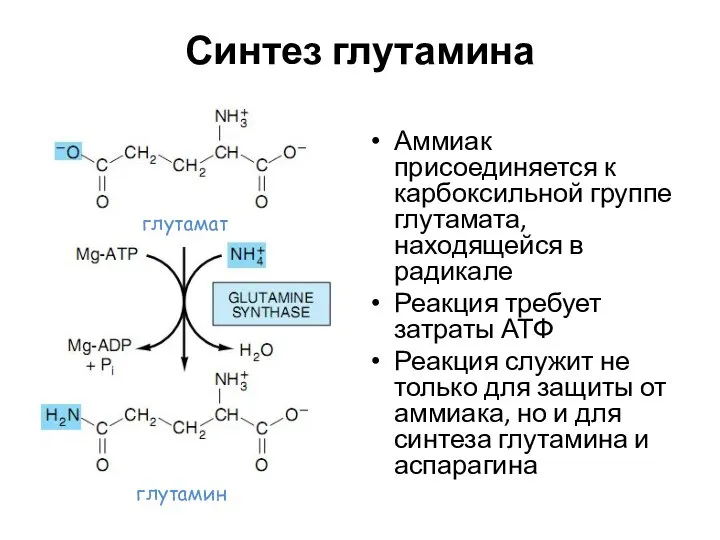
- 43. Синтез глутамина Аммиак присоединяется к карбоксильной группе глутамата, находящейся в радикале Реакция требует затраты АТФ Реакция
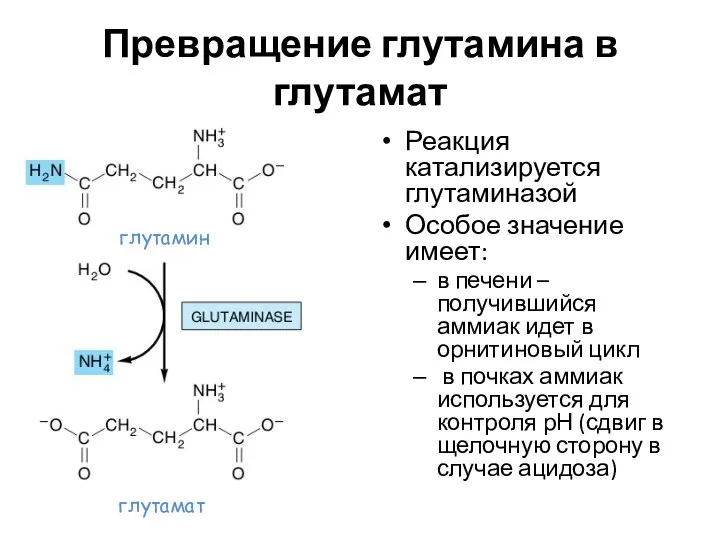
- 44. Превращение глутамина в глутамат Реакция катализируется глутаминазой Особое значение имеет: в печени –получившийся аммиак идет в
- 45. КАТАБОЛИЗМ УГЛЕРОДНЫХ СКЕЛЕТОВ АМИНОКИСЛОТ
- 46. Судьба кетокислот После трансаминирования от а.к. остается кетокислота. Разными путями она превращается в метаболиты, которые вам
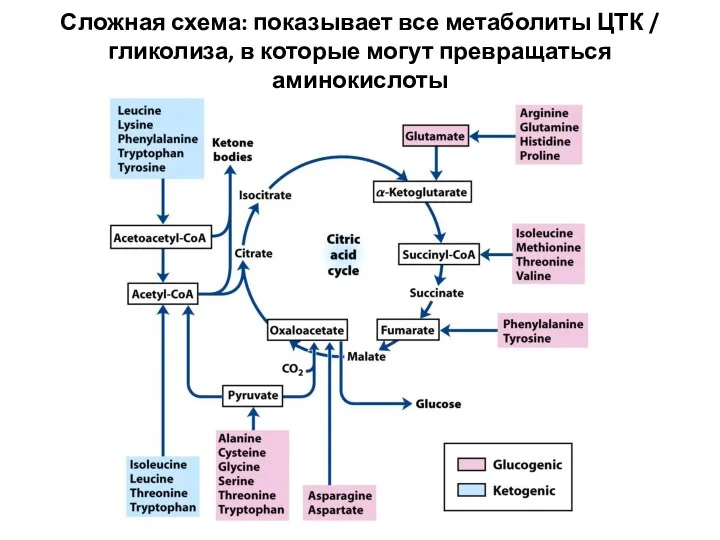
- 47. Сложная схема: показывает все метаболиты ЦТК / гликолиза, в которые могут превращаться аминокислоты
- 48. Можно запомнить распад самых простых аминокислот Простые пути распада: Аланин Аспарагин / аспартат Глутамин / глутамат
- 49. Аминокислоты, путь распада углеродных скелетов которых достаточно прост для запоминания: аланин Аланинаминотрансфераза в одну реакцию превращает
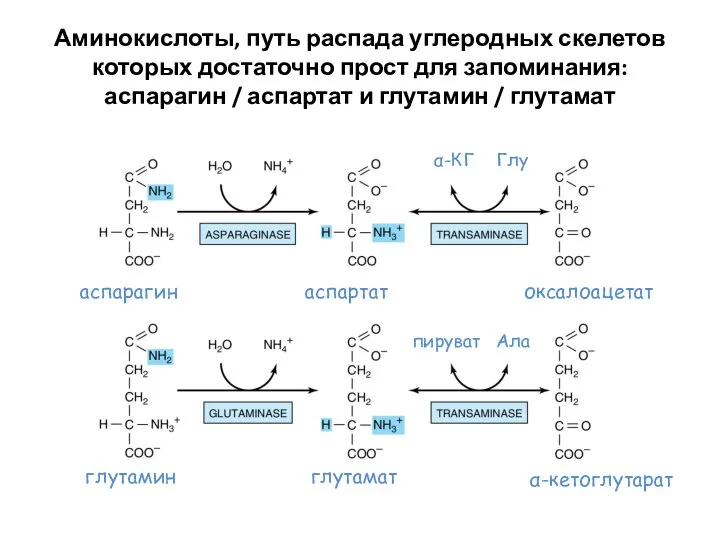
- 50. Аминокислоты, путь распада углеродных скелетов которых достаточно прост для запоминания: аспарагин / аспартат и глутамин /
- 51. СИНТЕЗ АМИНОКИСЛОТ
- 52. Заменимые синтезируются из метаболитов ЦТК или гликолиза Заменимые: Аланин (из пирувата) Серин (из 3-ФГК) Глицин (из
- 53. Можно запомнить синтез самых простых аминокислот Простые в синтезе аминокислоты: Аланин Аспарагин / аспартат Глутамин /
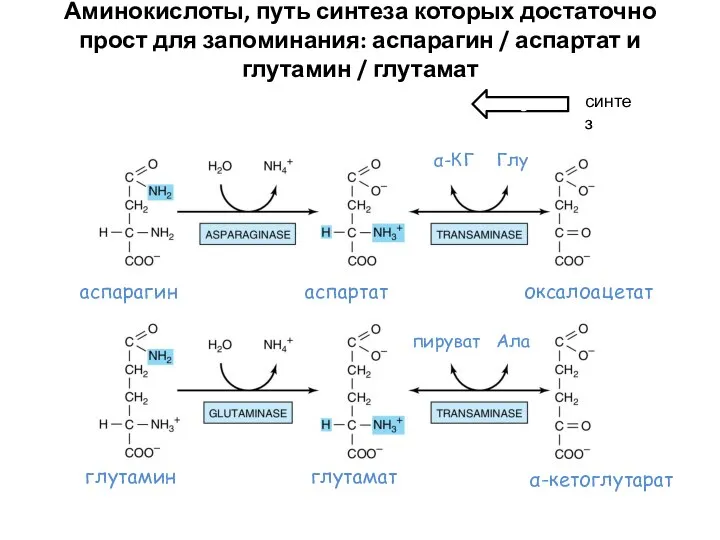
- 54. з Аминокислоты, путь синтеза которых достаточно прост для запоминания: аспарагин / аспартат и глутамин / глутамат
- 55. Аминокислоты, путь синтеза которых достаточно прост для запоминания: аланин Аланинаминотрансфераза в одну реакцию превращает пируват (метаболит
- 56. МЕТАБОЛИЗМ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
- 57. СЕРИН И ГЛИЦИН
- 58. Серин превращается в глицин в одну реакцию Фермент: серин-оксиметилтрансфераза Кофермент: ТГФК (тетрагидрофолиевая кислота), из фолиевой кислоты,
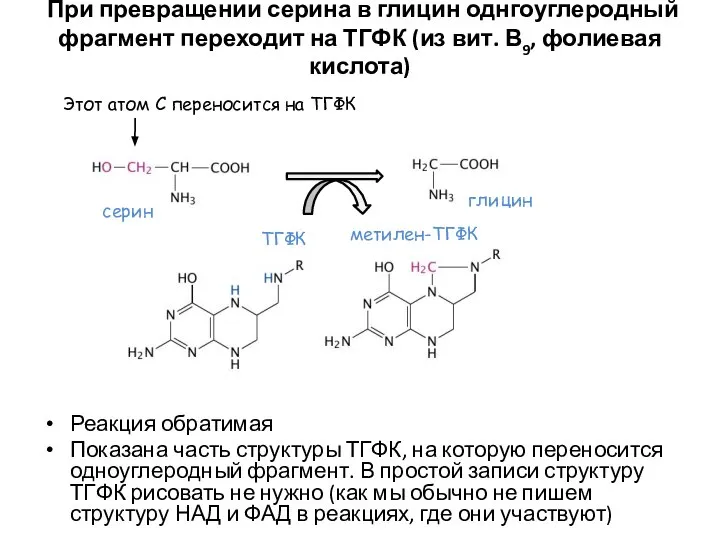
- 59. При превращении серина в глицин однгоуглеродный фрагмент переходит на ТГФК (из вит. В9, фолиевая кислота) Реакция
- 60. Когда одноуглеродный фрагмент находится на ТГФК, он может подвергаться разным модификациям. В результате получаются различные одноуглеродные
- 61. ФЕНИЛАЛАНИН И ТИРОЗИН
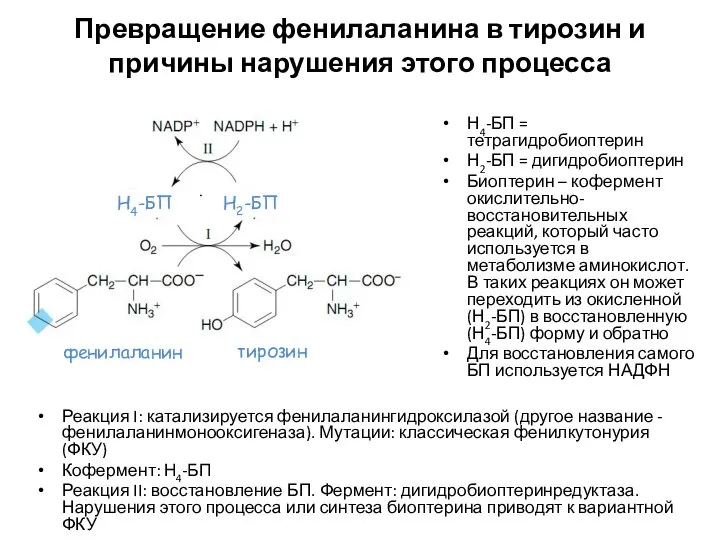
- 62. Превращение Фен и Тир Фермент: фенилаланингидроксилаза Кофермент: Н4БП (тетрагидробиоптерин) Функция: основной путь катаболизма фенилаланина Нарушения: фенилкетонурия
- 63. Превращение фенилаланина в тирозин и причины нарушения этого процесса Н4-БП = тетрагидробиоптерин Н2-БП = дигидробиоптерин Биоптерин
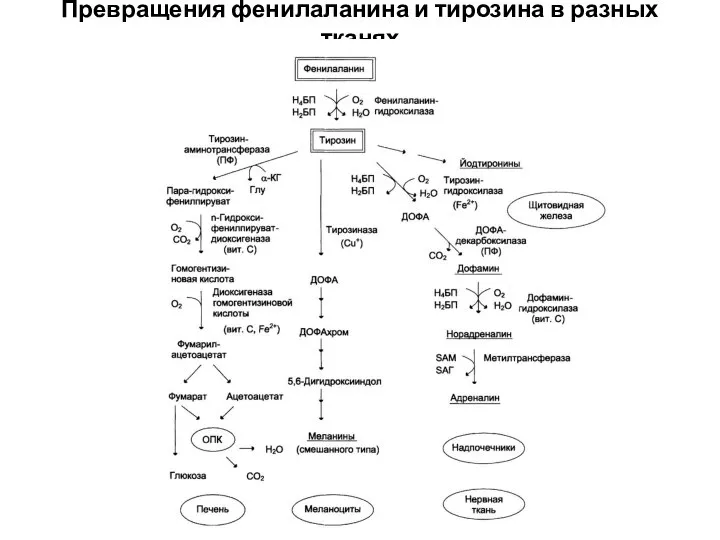
- 64. Превращения тирозина в разных тканях В печени: катаболизм (смешанная аминокислота). Нарушение катаболизма – алкаптонурия (черная моча).
- 65. Превращения фенилаланина и тирозина в разных тканях
- 66. СЕРОСОДЕРЖАЩИЕ АМИНОКИСЛОТЫ: МЕТИОНИН, ЦИСТЕИН
- 67. Функции цистеина Может синтезироваться из серина Дисульфидные мостики в белках Используется при синтезе таурина (см. парные
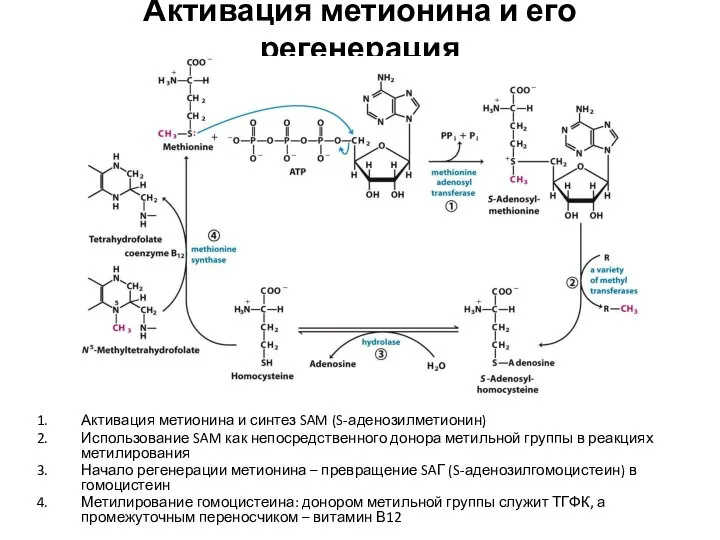
- 68. Метионин Участвует в реакциях метилирования (донор метильной группы) Сначала активируется с образованием SAM (S-аденозилметионин, т.е. присоединяет
- 69. Регенерация метионина После потери метильной группы SAM превращается в SAГ (S-аденозилгомоцистеин) SAГ превращается в гомоцистеин (отделяется
- 70. Активация метионина и его регенерация Активация метионина и синтез SAM (S-аденозилметионин) Использование SAM как непосредственного донора
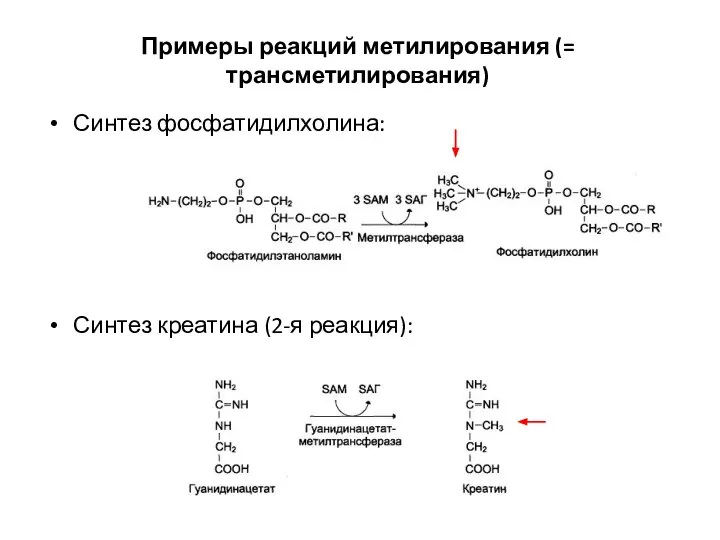
- 71. Синтез фосфатидилхолина: Синтез креатина (2-я реакция): Примеры реакций метилирования (= трансметилирования)
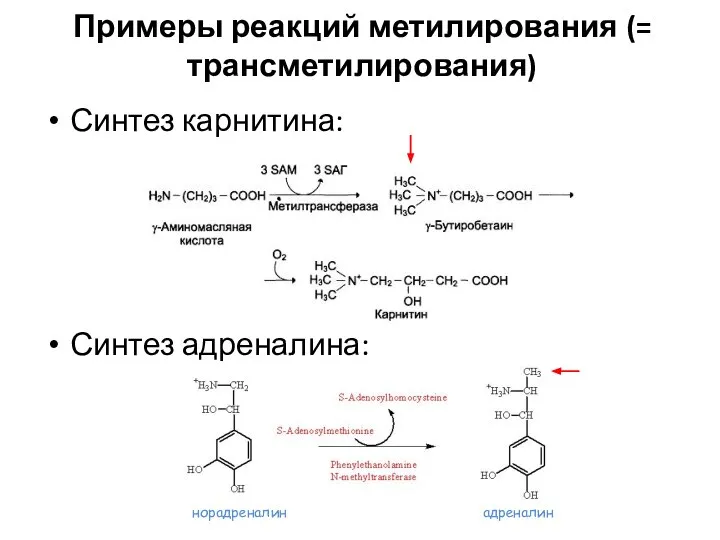
- 72. Примеры реакций метилирования (= трансметилирования) Синтез карнитина: Синтез адреналина: норадреналин адреналин
- 73. ДИКАРБОНОВЫЕ АМИНОКИСЛОТЫ (АСПАРТАТ, ГЛУТАМАТ)
- 74. Синтез: заменимые, из оксалоацетата (аспартат) и α-кетоглутарата (глутамат) Функции: В составе белков Роль в реакциях трансаминирования/дезаминирования
- 75. СПЕЦИФИЧЕСКИЕ ПРОДУКТЫ: КРЕАТИН
- 76. Креатин Синтез в 2 стадии: В почках: из глицина и аргинина образуется гуанидинацетат В печени: гуанидинацетат
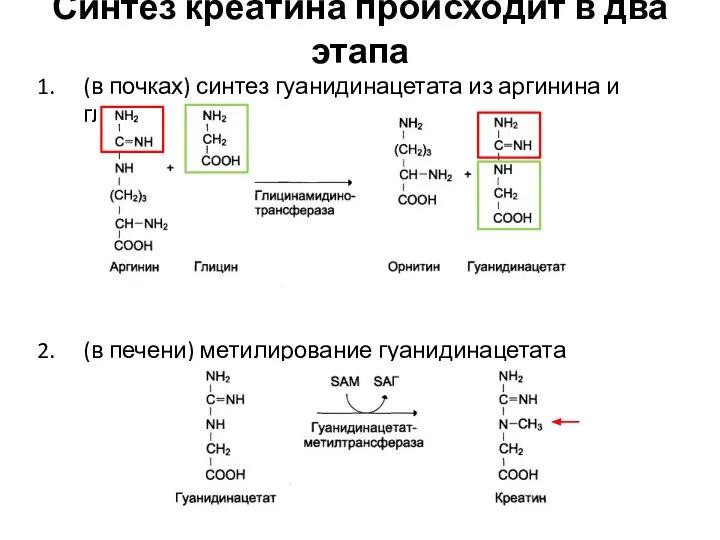
- 77. Синтез креатина происходит в два этапа (в почках) синтез гуанидинацетата из аргинина и глицина (в печени)
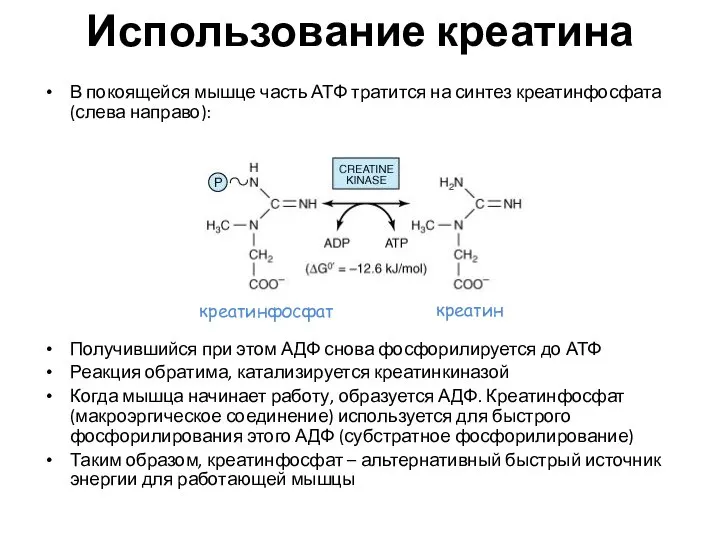
- 78. Использование креатина В покоящейся мышце часть АТФ тратится на синтез креатинфосфата (слева направо): Получившийся при этом
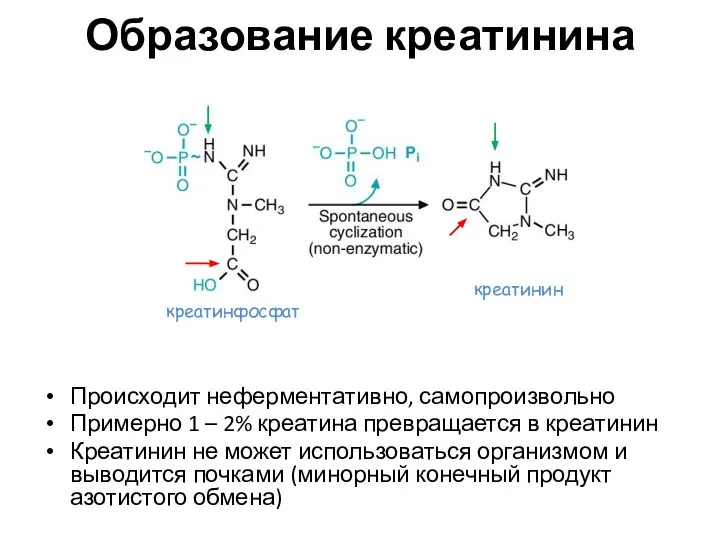
- 79. Образование креатинина Происходит неферментативно, самопроизвольно Примерно 1 – 2% креатина превращается в креатинин Креатинин не может
- 80. БИОГЕННЫЕ АМИНЫ: ДЕКАРБОКСИЛИРОВАНИЕ И ГИДРОКСИЛИРОВАНИЕ А.К.
- 81. Биогенные амины: Синтез: получаются в результате декарбоксилирования а.к. Во время синтеза также может происходить гидроксилирование и
- 82. Декарбоксилирование аминокислот дает биогенные амины Биогенные – значит, образуются в живом организме В синтезе некоторых биогенных
- 83. Предшественники биогенных аминов Тирозин: Дофамин Норадреналин Адреналин Триптофан: серотонин Глутамат: ГАМК (гамма-аминомасляная кислота) гистидин: гистамин Орнитин:
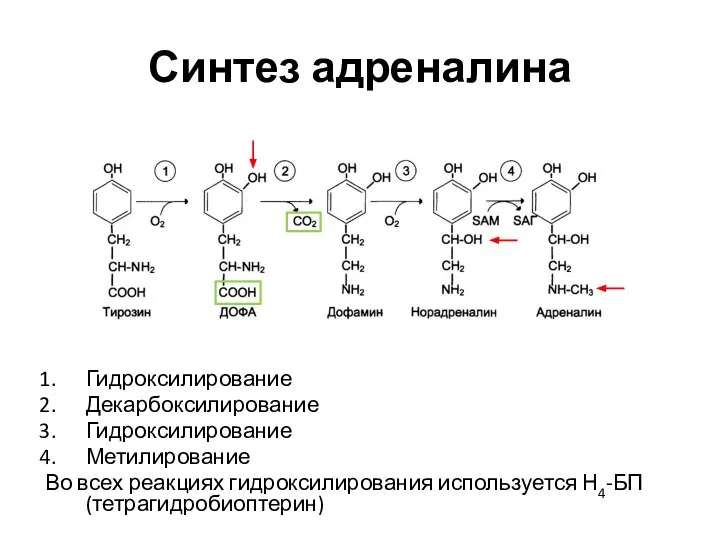
- 84. Синтез адреналина Фенилаланин → тирозин (гидроксилирование, Н4БП) Тирозин → ДОФА (диоксифенилаланин, гидроксилирование, Н4БП) ДОФА → дофамин
- 85. Синтез адреналина Гидроксилирование Декарбоксилирование Гидроксилирование Метилирование Во всех реакциях гидроксилирования используется Н4-БП (тетрагидробиоптерин)
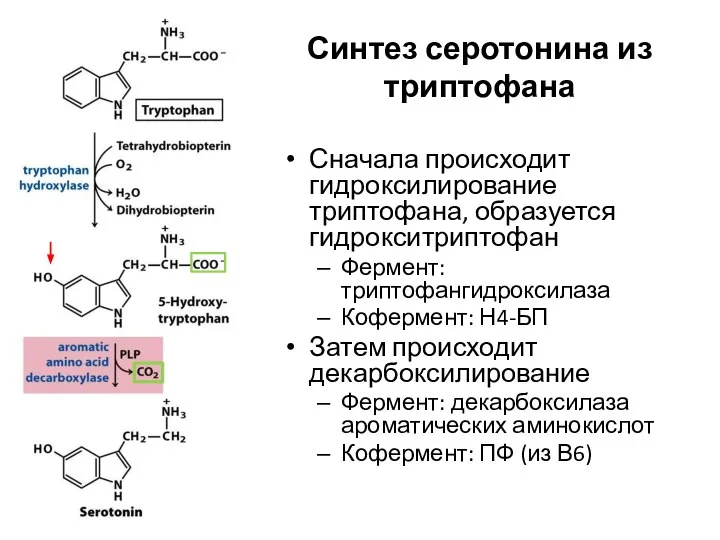
- 86. Синтез серотонина из триптофана Сначала происходит гидроксилирование триптофана, образуется гидрокситриптофан Фермент: триптофангидроксилаза Кофермент: Н4-БП Затем происходит
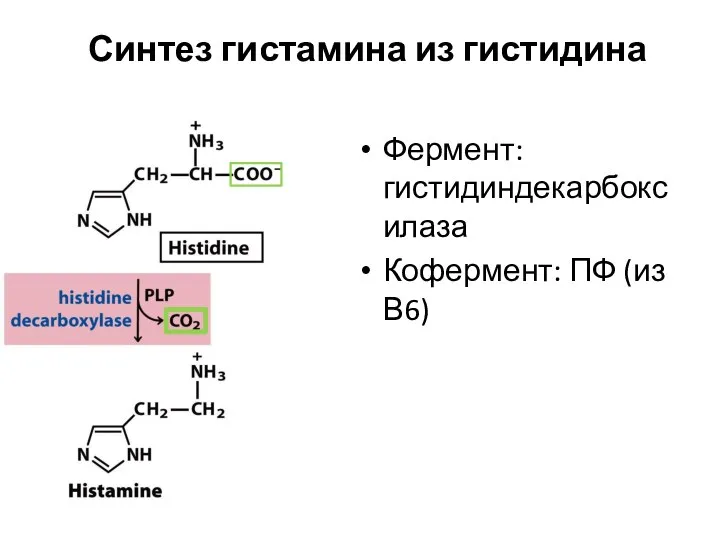
- 87. Синтез гистамина из гистидина Фермент: гистидиндекарбоксилаза Кофермент: ПФ (из В6)
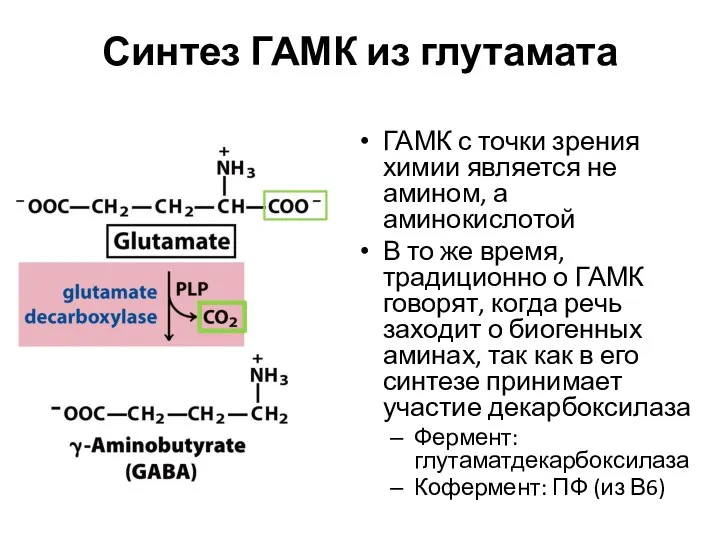
- 88. Синтез ГАМК из глутамата ГАМК с точки зрения химии является не амином, а аминокислотой В то
- 89. Инактивация биогенных аминов Схема: отщепляет аминогруппу от амина, превращая его в альдегид Фермент: МАО (моноаминооксидаза) Кофермент:
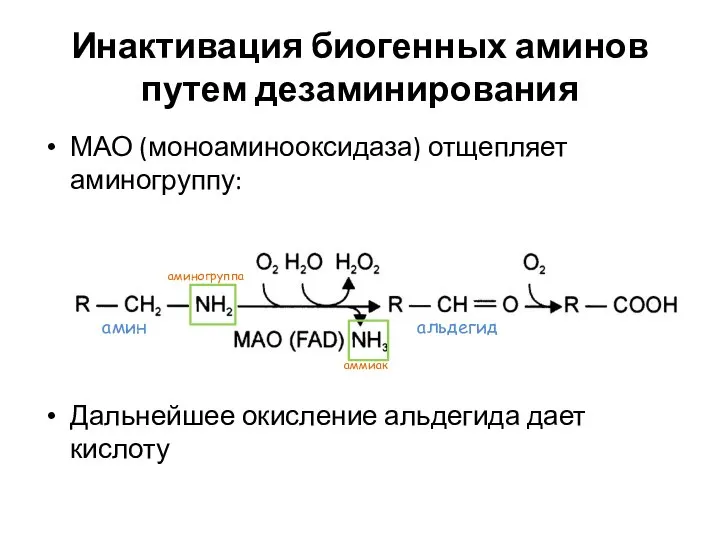
- 90. Инактивация биогенных аминов путем дезаминирования МАО (моноаминооксидаза) отщепляет аминогруппу: Дальнейшее окисление альдегида дает кислоту амин альдегид
- 91. ОКСИД АЗОТА NO
- 92. NO Синтез: из аргинина Фермент: NO-синтаза Функция: расслабление гладкой мускулатуры Предотвращение агрегации тромбоцитов Нейромедиатор Регулятор апоптоза
- 94. Скачать презентацию

























































 Животный мир Арктики
Животный мир Арктики История анатомии
История анатомии Рычаги в природе и технике
Рычаги в природе и технике Что растёт на клумбе
Что растёт на клумбе Орлан белохвост – птица 2013 года
Орлан белохвост – птица 2013 года Курс лекций по энзимиологии. Основные вопросы по 3-й лекции. Лекции 4-5
Курс лекций по энзимиологии. Основные вопросы по 3-й лекции. Лекции 4-5 Паразитизм Составитель Большаков С. В.
Паразитизм Составитель Большаков С. В.  Испарение воды растениями. Листопад
Испарение воды растениями. Листопад Осенние цветы
Осенние цветы Гидробиологический мониторинг
Гидробиологический мониторинг Презентация по биологии Шляпочные грибы
Презентация по биологии Шляпочные грибы Белые медведи
Белые медведи Необычное об обычной воде
Необычное об обычной воде Сапропель және бактериалды тыңайтқыштар және қордалар
Сапропель және бактериалды тыңайтқыштар және қордалар Презентация на тему: Работу выполнила учитель начальных классов МОУ СОШ № 4 г. Минеральные Воды Журавлева Н. Н.
Презентация на тему: Работу выполнила учитель начальных классов МОУ СОШ № 4 г. Минеральные Воды Журавлева Н. Н. Птицы города Алчевска
Птицы города Алчевска Презентация на тему "Необычные растения" - скачать бесплатно презентации по Биологии
Презентация на тему "Необычные растения" - скачать бесплатно презентации по Биологии Грибы. Викторина
Грибы. Викторина Нуклеиновые кислоты
Нуклеиновые кислоты Размножение. Митоз и мейоз
Размножение. Митоз и мейоз Призентація з біології учениці 9-А класу Короткової Христини
Призентація з біології учениці 9-А класу Короткової Христини  Загрязнение озера Байкал Pollution of Lake Baikal
Загрязнение озера Байкал Pollution of Lake Baikal Мёд
Мёд Мышечная ткань
Мышечная ткань Растения-переселенцы
Растения-переселенцы Отряд Даманы, Отряд Хоботные
Отряд Даманы, Отряд Хоботные Презентация на тему "Фрукты" - скачать бесплатно презентации по Биологии
Презентация на тему "Фрукты" - скачать бесплатно презентации по Биологии Харациновые рыбки
Харациновые рыбки