Содержание
- 2. Нуклеиновые кислоты
- 3. Нуклеиновые кислоты – это биологические полимеры, состоящие из нуклеотидов, соединенных 3ʹ-5ʹ- фосфодиэфирной связью. Существует 2 вида
- 4. Нуклеиновые кислоты состоят из нуклеотидов! Состав нуклеотидов: Азотистые основания Рибоза или дезоксирибоза («сахара») Фосфорная кислота Азотистые
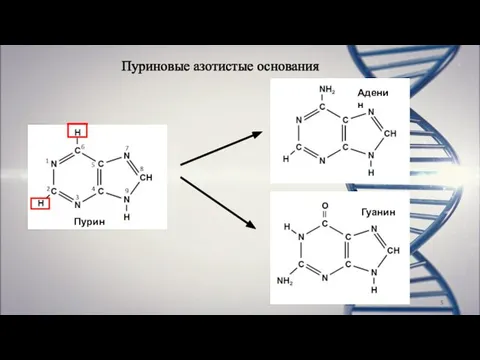
- 5. Пуриновые азотистые основания Пурин Гуанин 1 2 3 4 5 6 7 8 9
- 6. Пиримидиновые азотистые основания Пиримидин Тимин Урацил Цитозин 1 2 3 4 5 6
- 7. Нуклеозиды – продукты конденсации азотистых оснований и рибозы или дезоксирибозы. Рибоза 4′ 3′ 2′ 1′ 9
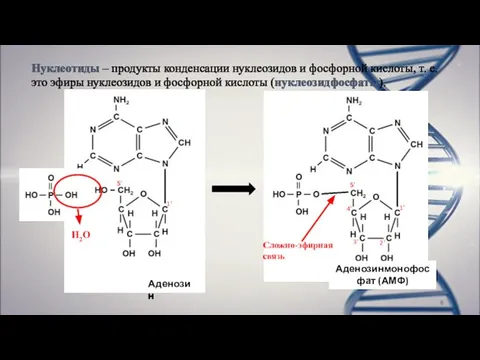
- 8. Нуклеотиды – продукты конденсации нуклеозидов и фосфорной кислоты, т. е. это эфиры нуклеозидов и фосфорной кислоты
- 9. Номенклатура Названия нуклеозидов строят на основе тривиальных названий нуклеиновых оснований, добавляя окончание -идин для производных пиримидина
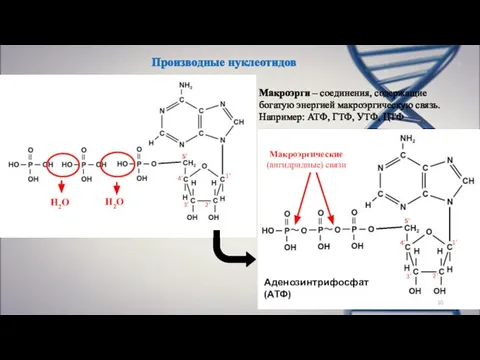
- 10. Производные нуклеотидов Н2О Н2О Макроэргические (ангидридные) связи Аденозинтрифосфат (АТФ) Макроэрги – соединения, содержащие богатую энергией макроэргическую
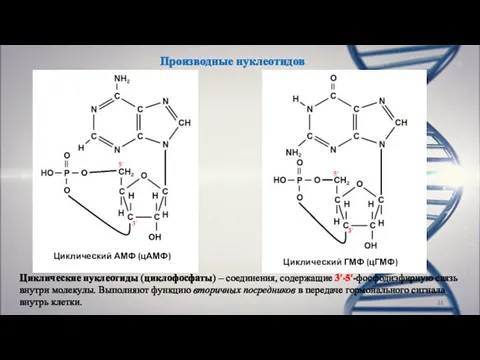
- 11. Производные нуклеотидов Циклический АМФ (цАМФ) Циклический ГМФ (цГМФ) Циклические нуклеотиды (циклофосфаты) – соединения, содержащие 3ʹ-5′-фосфодиэфирную связь
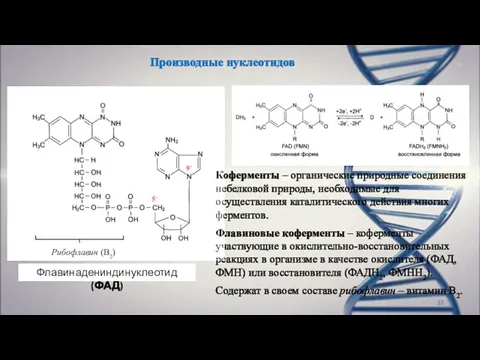
- 12. Производные нуклеотидов Флавинадениндинуклеотид (ФАД) Рибофлавин (В2) Коферменты – органические природные соединения небелковой природы, необходимые для осуществления
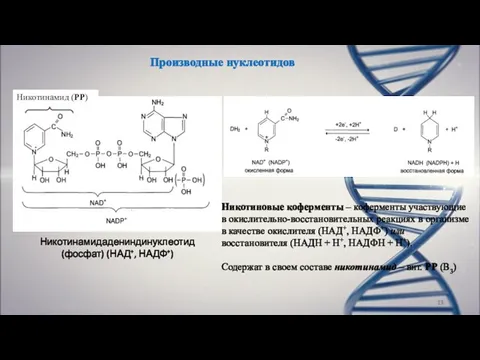
- 13. Производные нуклеотидов Никотинамидадениндинуклеотид (фосфат) (НАД+, НАДФ+) Никотиновые коферменты – коферменты участвующие в окислительно-восстановительных реакциях в организме
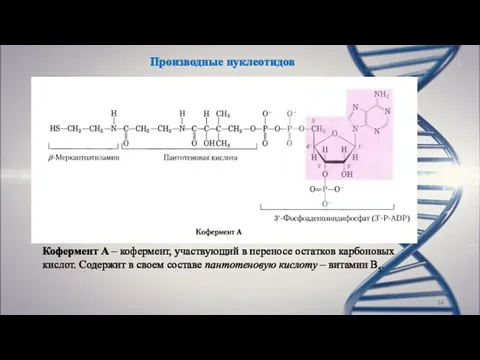
- 14. Производные нуклеотидов Кофермент А – кофермент, участвующий в переносе остатков карбоновых кислот. Содержит в своем составе
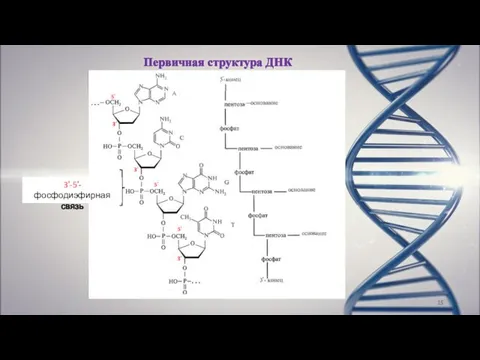
- 15. Первичная структура ДНК 3ʹ-5′-фосфодиэфирная связь 5′ 3′ 3′ 5′ 3′ 5′
- 16. Вторичная структура ДНК Фрэнсис Крик, Джеймс Уотсон и Морис Уилкинс 1953 г. – Открытие вторичной структуры
- 17. Вторичная структура ДНК Комплементарные пары оснований: аденин-тимин, гуанин-цитозин. Двойная спираль ДНК
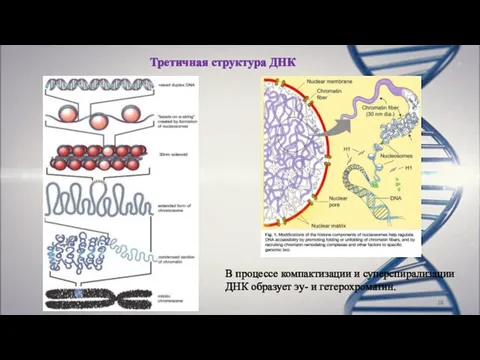
- 18. Третичная структура ДНК В процессе компактизации и суперспирализации ДНК образует эу- и гетерохроматин.
- 19. Вторичная и третичная структура РНК Вторичная структура тРНК Третичная структура тРНК
- 20. Белки
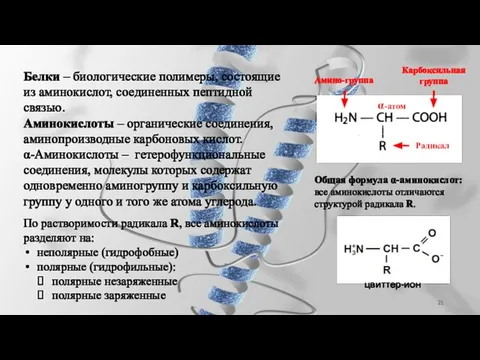
- 21. Белки – биологические полимеры, состоящие из аминокислот, соединенных пептидной связью. Аминокислоты – органические соединения, аминопроизводные карбоновых
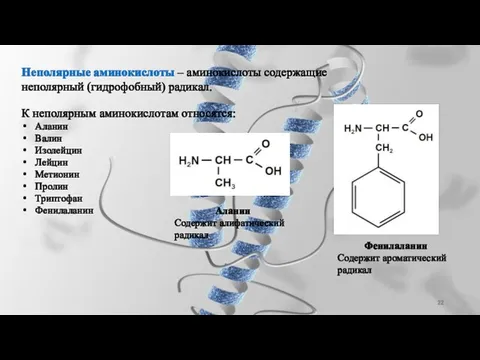
- 22. Неполярные аминокислоты – аминокислоты содержащие неполярный (гидрофобный) радикал. К неполярным аминокислотам относятся: Аланин Валин Изолейцин Лейцин
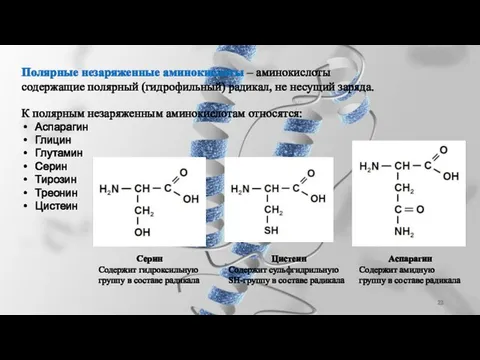
- 23. Полярные незаряженные аминокислоты – аминокислоты содержащие полярный (гидрофильный) радикал, не несущий заряда. К полярным незаряженным аминокислотам
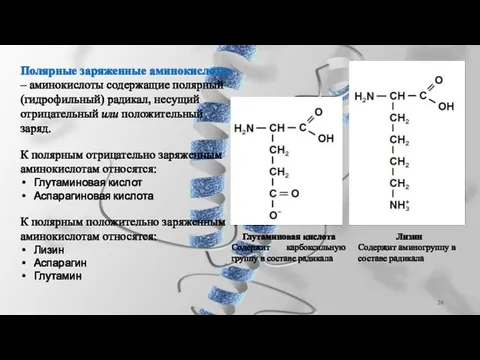
- 24. Полярные заряженные аминокислоты – аминокислоты содержащие полярный (гидрофильный) радикал, несущий отрицательный или положительный заряд. К полярным
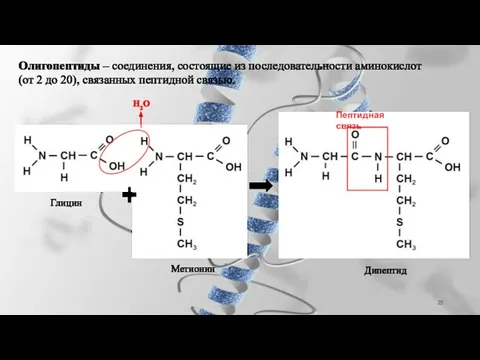
- 25. Олигопептиды – соединения, состоящие из последовательности аминокислот (от 2 до 20), связанных пептидной связью. Н2О Пептидная
- 26. Первичная структура белка – полипептидная цепь, состоящая из последовательности аминокислот (>50), соединенных пептидной связью.
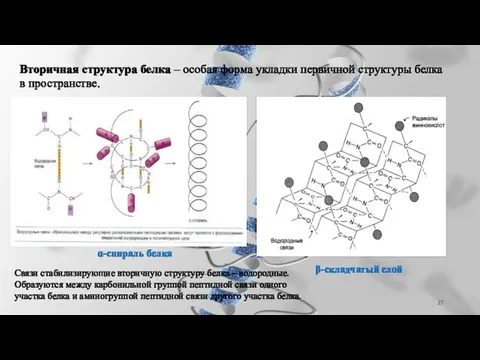
- 27. Вторичная структура белка – особая форма укладки первичной структуры белка в пространстве. β-складчатый слой α-спираль белка
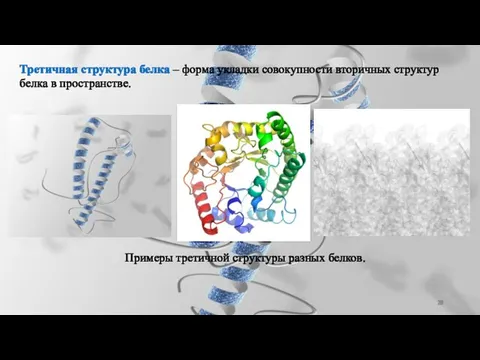
- 28. Третичная структура белка – форма укладки совокупности вторичных структур белка в пространстве. Примеры третичной структуры разных
- 29. Связи, участвующие в образовании третичной структуры белка: ионные, водородные, гидрофобные, дисульфидные. Все связи образуются между радикалами
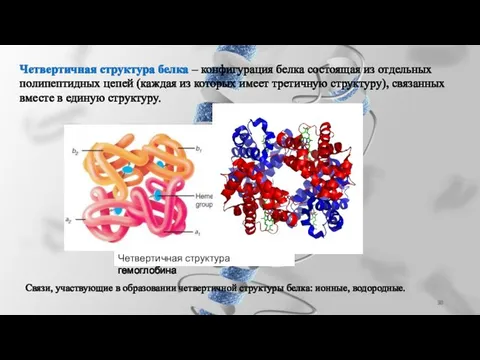
- 30. Четвертичная структура белка – конфигурация белка состоящая из отдельных полипептидных цепей (каждая из которых имеет третичную
- 31. Классификация белков В зависимости от молекулярной массы различают пептиды и белки. Пептиды имеют меньшую молекулярную массу,
- 32. Функции белков: Структурная (коллаген, эластин, кератин, интегральные белки мембран клеток). Энергетическая (источник энергии). Ферментативная (ферменты –
- 34. Скачать презентацию











 Презентация Цветок
Презентация Цветок  Биоэкология растений
Биоэкология растений Презентация на тему Неправильное питание
Презентация на тему Неправильное питание  Гипотеза происхождения жизни
Гипотеза происхождения жизни Дыхательная система человека
Дыхательная система человека Обитатели Тайги
Обитатели Тайги Видовое разнообразие флоры в Казахстане
Видовое разнообразие флоры в Казахстане Презентация на тему О птицах зимой
Презентация на тему О птицах зимой Ученица 9 «Б» класса Нежинского лицея КИЛЯЗОВА ЕКАТЕРИНА
Ученица 9 «Б» класса Нежинского лицея КИЛЯЗОВА ЕКАТЕРИНА  Тигровая викторина
Тигровая викторина Тупорылая Акула
Тупорылая Акула День моржа
День моржа Биохимия, как наука. Элементарный и молекулярный состав живых организмов
Биохимия, как наука. Элементарный и молекулярный состав живых организмов Тест по гистологии. Практика №1
Тест по гистологии. Практика №1 Кровь и остальные компоненты внутренней среды организма
Кровь и остальные компоненты внутренней среды организма Задачи по семеноводству
Задачи по семеноводству Концепции организации живых систем. Популяционно-видовой уровень живого. (Лекция 15)
Концепции организации живых систем. Популяционно-видовой уровень живого. (Лекция 15) Органы чувств
Органы чувств Теории возникновения жизни Теории возникновения жизни на Земле.
Теории возникновения жизни Теории возникновения жизни на Земле. Передача наследственной информации от ДНК к и-РНК и к белку
Передача наследственной информации от ДНК к и-РНК и к белку Экологическое загрязнение Брянской области _
Экологическое загрязнение Брянской области _ Понятие о микроорганизмах. Тема № 7/1
Понятие о микроорганизмах. Тема № 7/1 СТРУКТУРА И ФУНКЦИИ ХРОМОСОМ Автор Долгорукова С.В., учитель высшей категории МОУ гимназия № 2 Г.Екатеринбурга
СТРУКТУРА И ФУНКЦИИ ХРОМОСОМ Автор Долгорукова С.В., учитель высшей категории МОУ гимназия № 2 Г.Екатеринбурга  Презентация на тему Решение проблем с отходами
Презентация на тему Решение проблем с отходами  Томаты
Томаты Основные виды питательных веществ и их значение в питании человека
Основные виды питательных веществ и их значение в питании человека Клеточный цикл. Митоз. Стволовые клетки. Понятие о детерминации и дифференцировке
Клеточный цикл. Митоз. Стволовые клетки. Понятие о детерминации и дифференцировке Иерархия в табуне!
Иерархия в табуне!