Содержание
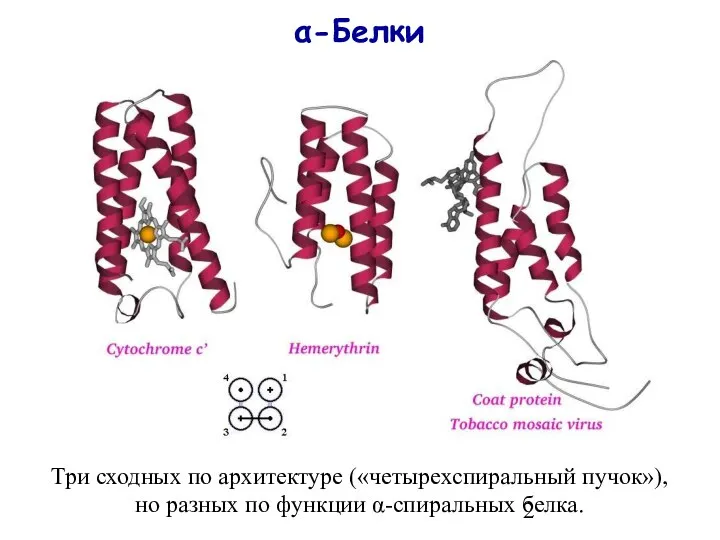
- 2. α-Белки Три сходных по архитектуре («четырехспиральный пучок»), но разных по функции α-спиральных белка.
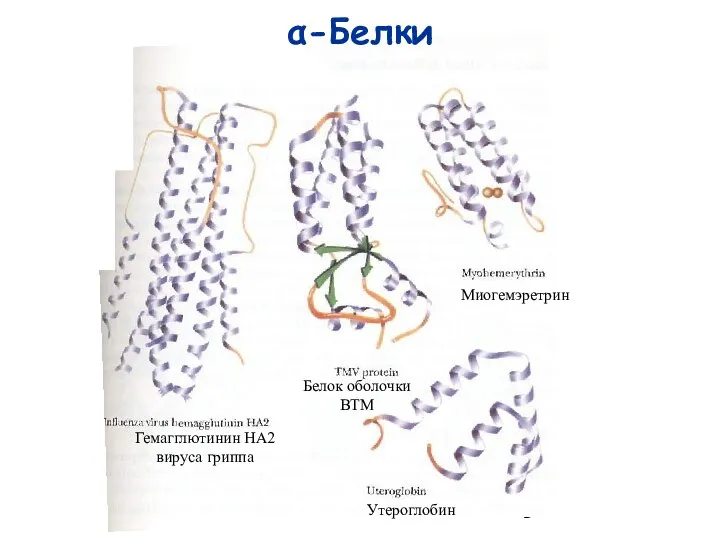
- 3. α-Белки Гемагглютинин HA2 вируса гриппа Белок оболочки ВТМ Миогемэретрин Утероглобин
- 4. Структурные мотивы (по Ефимову) Структурными мотивами принято считать пространственно организованные структурные единицы, образованные двумя, тремя и
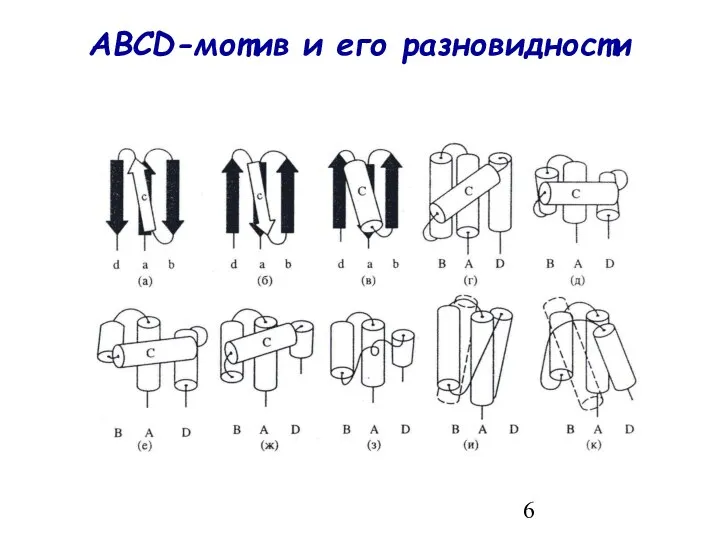
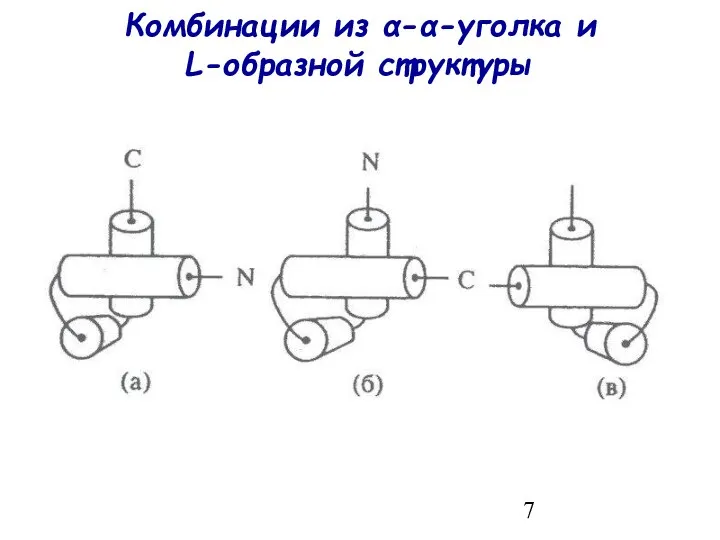
- 5. Новые структурные мотивы в α-спиральных белках Комбинации из α-α-уголка и L-образной структуры ABCD-мотив и его разновидности
- 6. ABCD-мотив и его разновидности
- 7. Комбинации из α-α-уголка и L-образной структуры
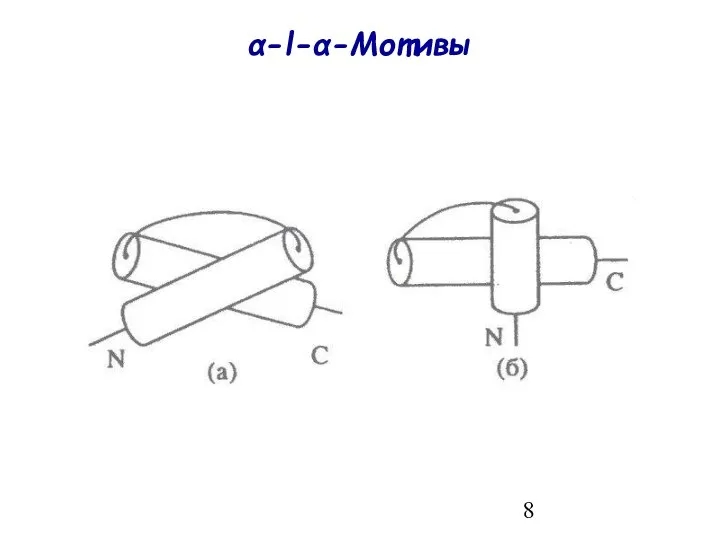
- 8. α-l-α-Мотивы
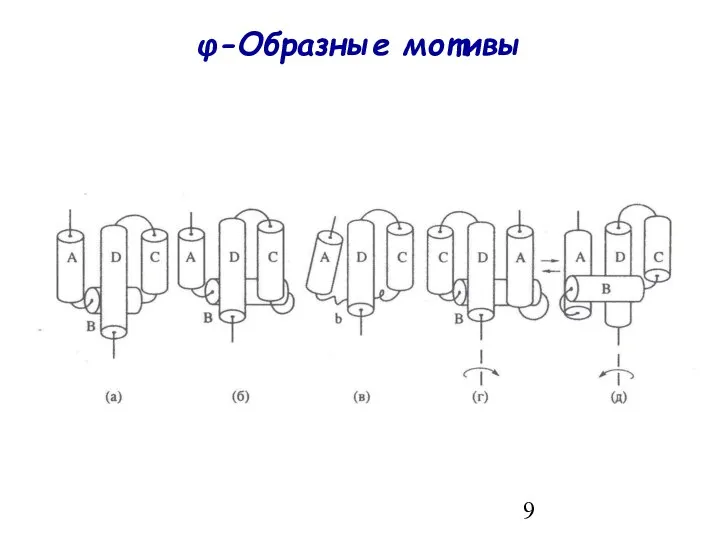
- 9. φ-Образные мотивы
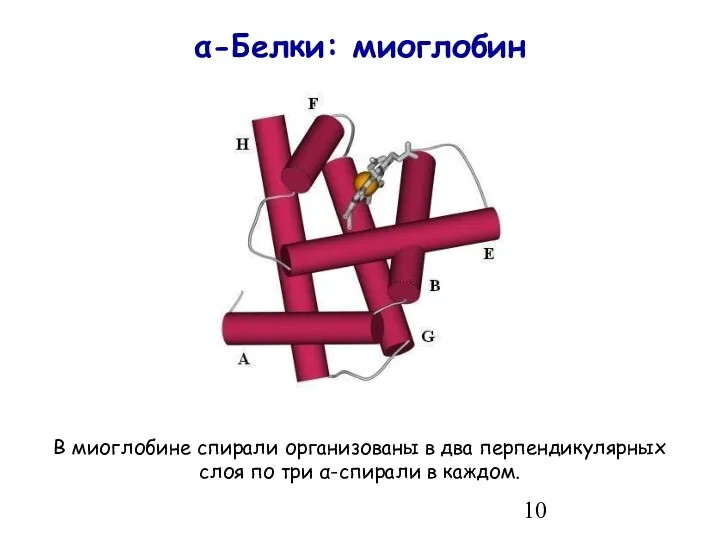
- 10. α-Белки: миоглобин В миоглобине спирали организованы в два перпендикулярных слоя по три α-спирали в каждом.
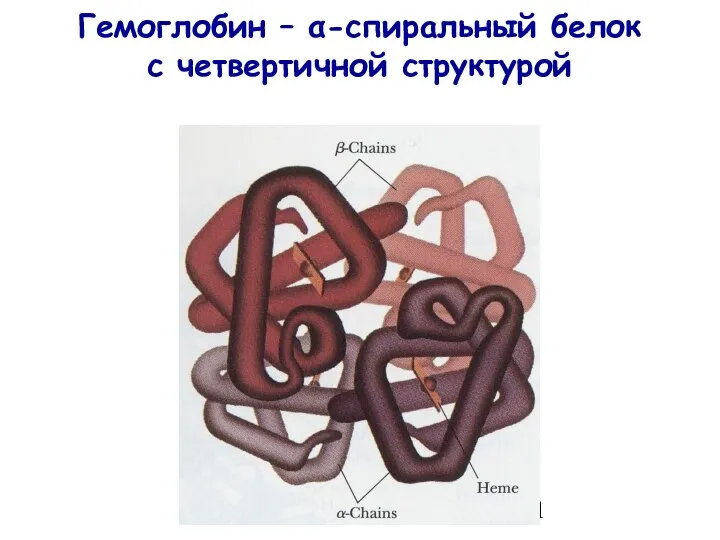
- 11. Гемоглобин – α-спиральный белок с четвертичной структурой
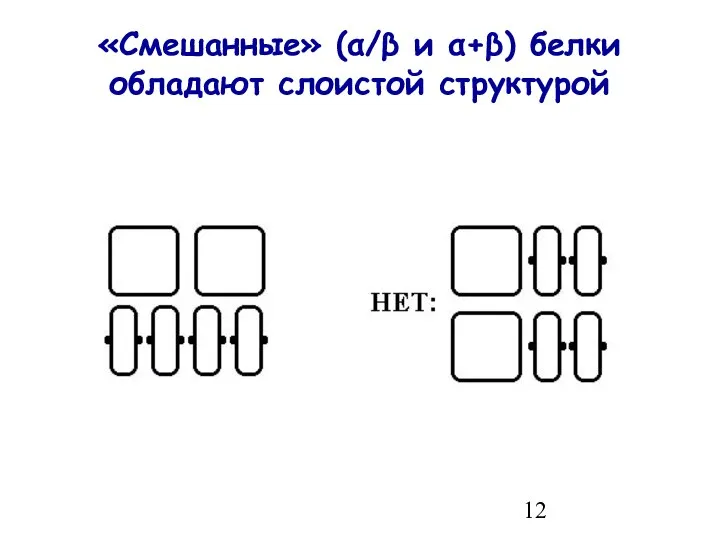
- 12. «Смешанные» (α/β и α+β) белки обладают слоистой структурой
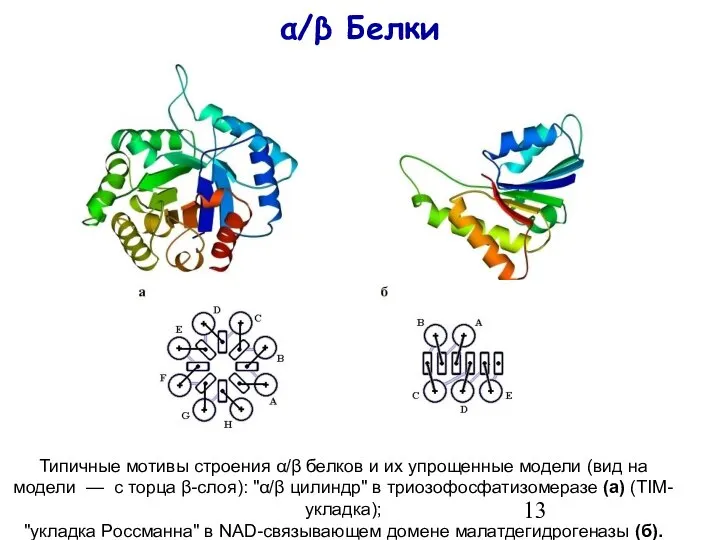
- 13. α/β Белки Типичные мотивы строения α/β белков и их упрощенные модели (вид на модели — с
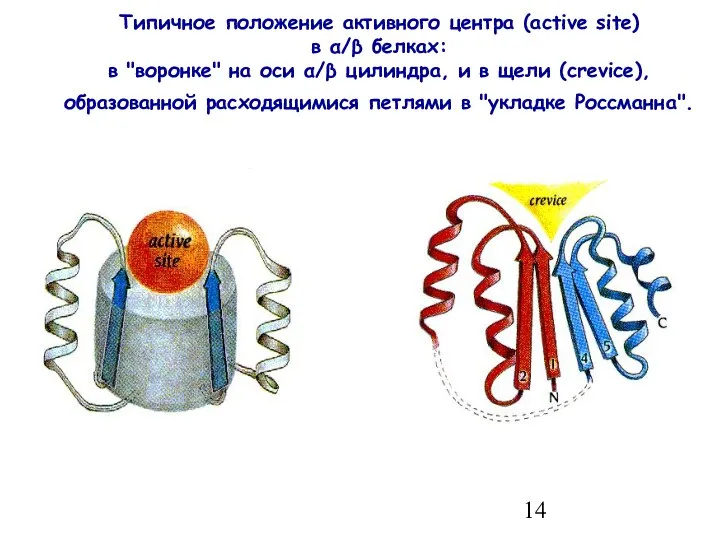
- 14. Типичное положение активного центра (active site) в α/β белках: в "воронке" на оси α/β цилиндра, и
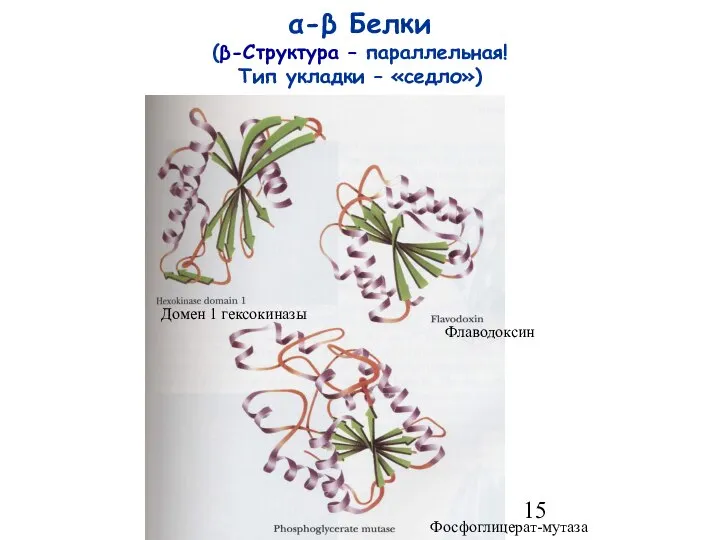
- 15. α-β Белки (β-Структура – параллельная! Тип укладки – «седло») Домен 1 гексокиназы Флаводоксин Фосфоглицерат-мутаза
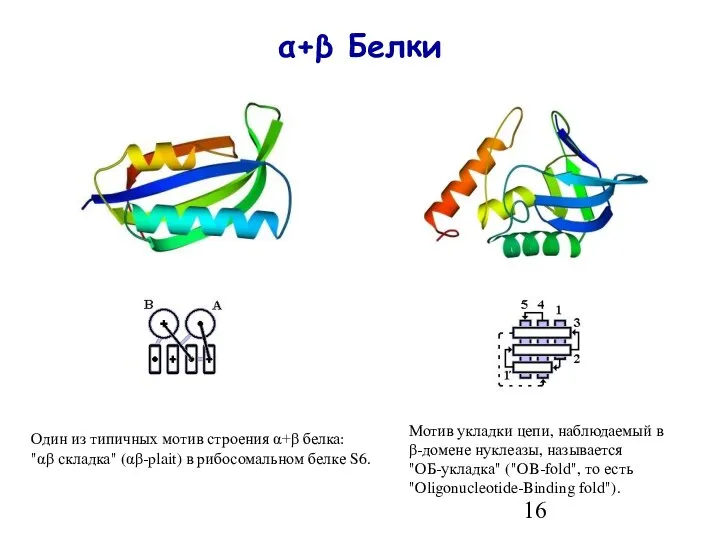
- 16. α+β Белки Один из типичных мотив строения α+β белка: "αβ складка" (αβ-plait) в рибосомальном белке S6.
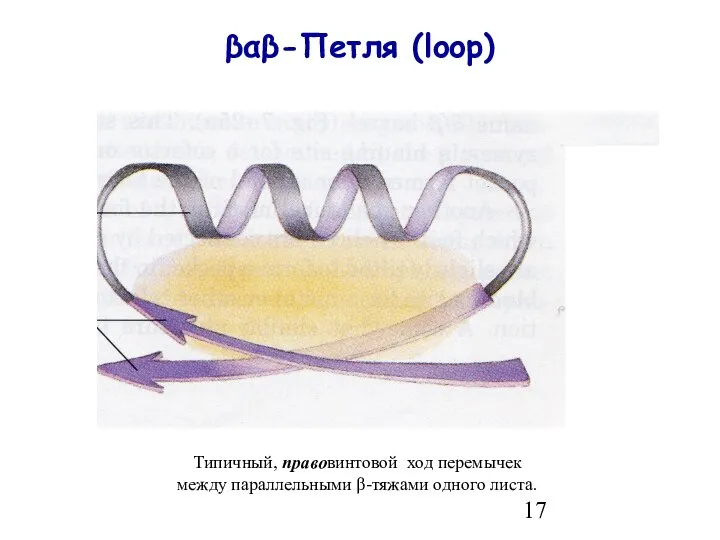
- 17. βαβ-Петля (loop) Типичный, правовинтовой ход перемычек между параллельными β-тяжами одного листа.
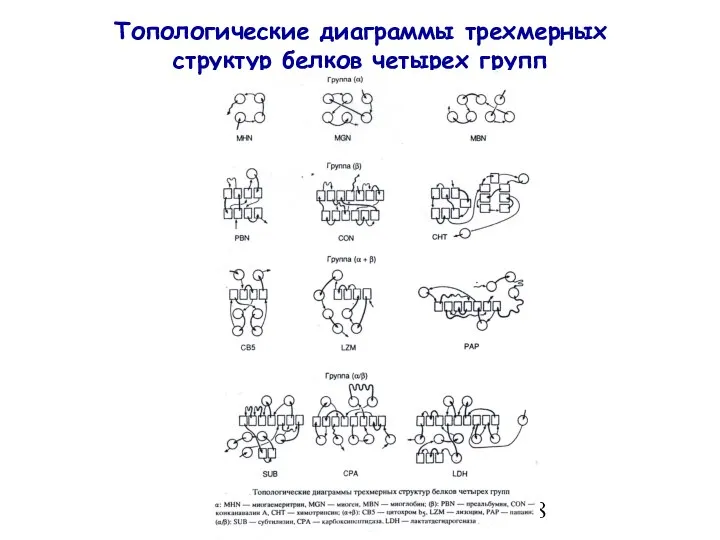
- 18. Топологические диаграммы трехмерных структур белков четырех групп
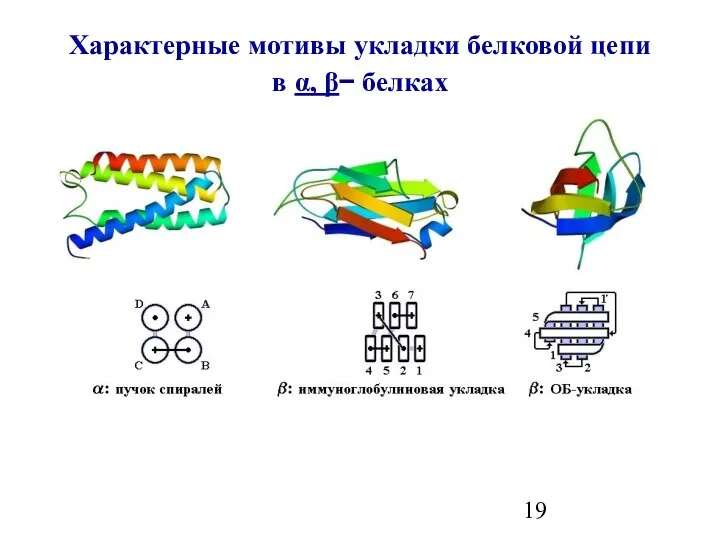
- 19. Характерные мотивы укладки белковой цепи в α, β− белках
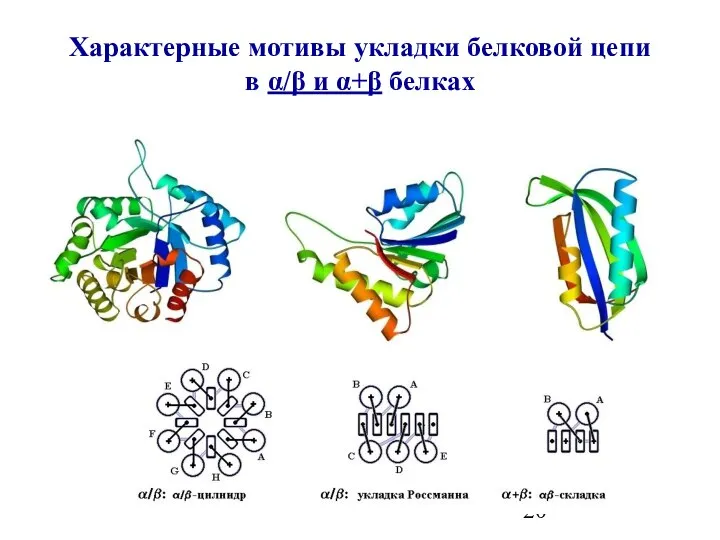
- 20. Характерные мотивы укладки белковой цепи в α/β и α+β белках
- 21. Структурные классы белков, типичные архитектуры и типичные мотивы укладки цепи (топологии)
- 22. Характерные мотивы чередования гидрофобных (·) и полярных (о) аминокислот в первичных структурах водорастворимых глобулярных белков, мембранных
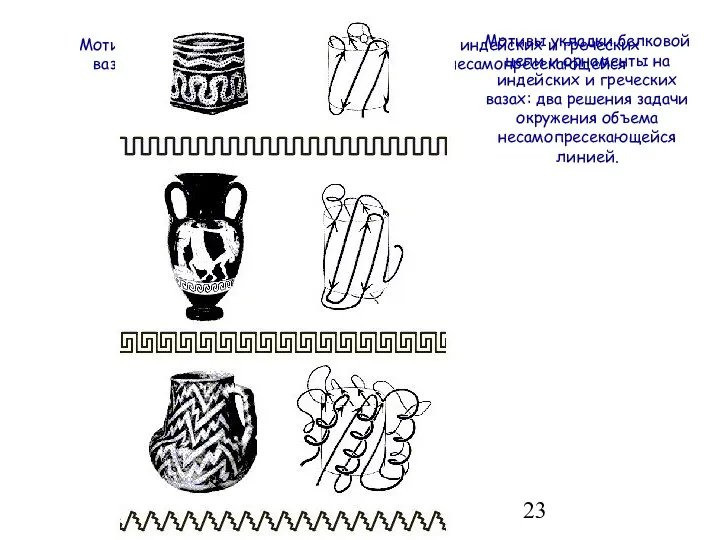
- 23. Мотивы укладки белковой цепи и орнаменты на индейских и греческих вазах: два решения задачи окружения объема
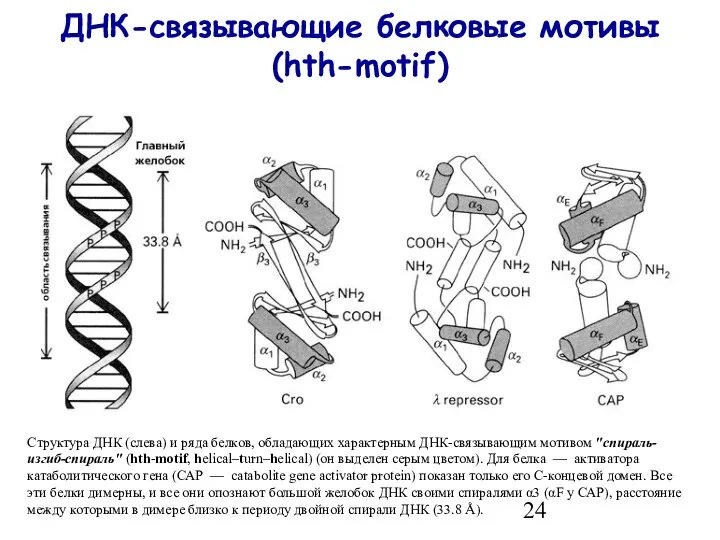
- 24. ДНК-связывающие белковые мотивы (hth-motif) Структура ДНК (слева) и ряда белков, обладающих характерным ДНК-связывающим мотивом "спираль-изгиб-спираль" (hth-motif,
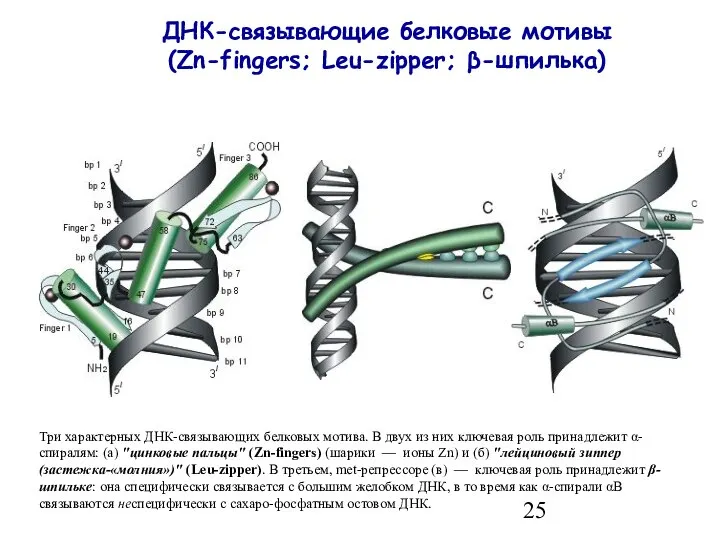
- 25. ДНК-связывающие белковые мотивы (Zn-fingers; Leu-zipper; β-шпилька) Три характерных ДНК-связывающих белковых мотива. В двух из них ключевая
- 26. Самоорганизация белков In vivo: Рибосома выдает белковую цепь постепенно, с паузами (приостановка биосинтеза цепи на «редких»
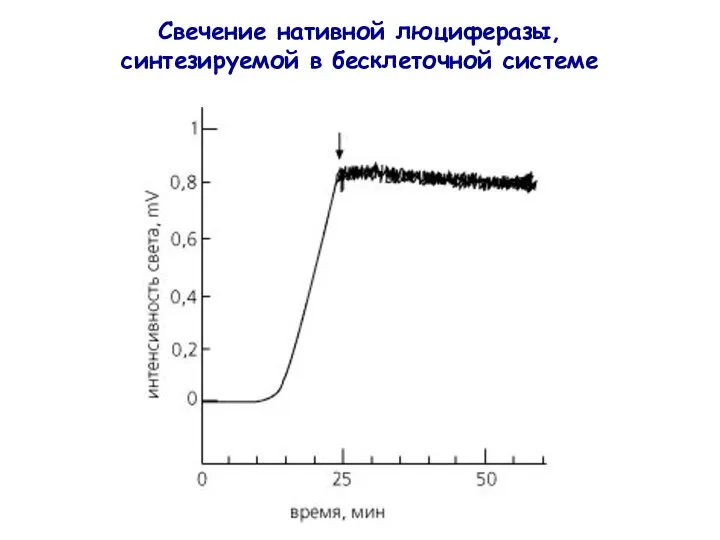
- 27. Свечение нативной люциферазы, синтезируемой в бесклеточной системе
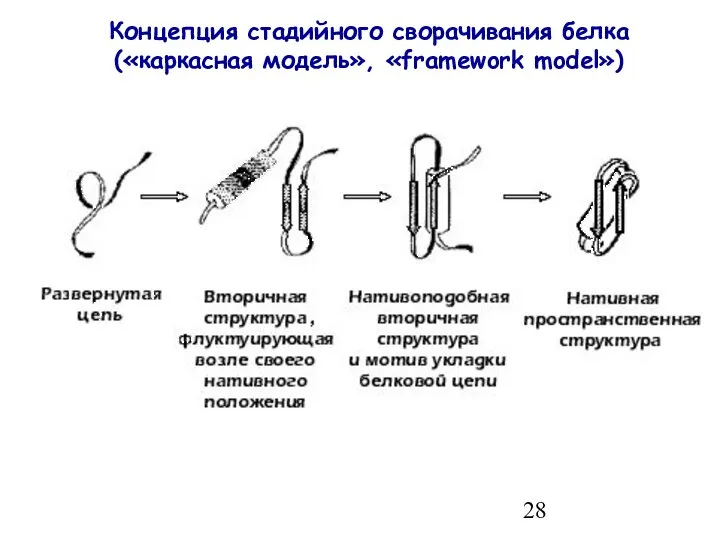
- 28. Концепция стадийного сворачивания белка («каркасная модель», «framework model»)
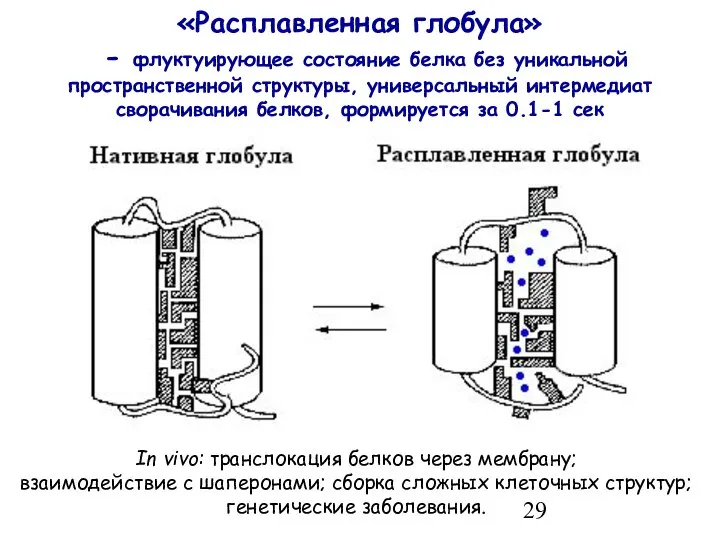
- 29. «Расплавленная глобула» - флуктуирующее состояние белка без уникальной пространственной структуры, универсальный интермедиат сворачивания белков, формируется за
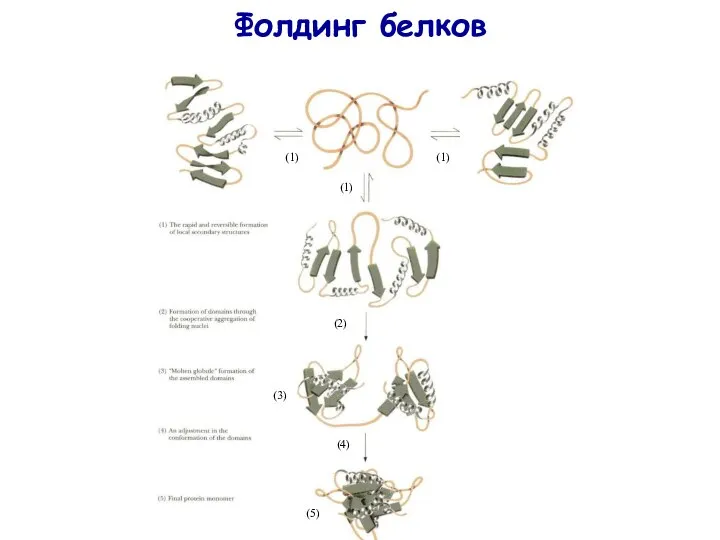
- 31. Фолдинг белков (1) (1) (1) (2) (3) (4) (5)
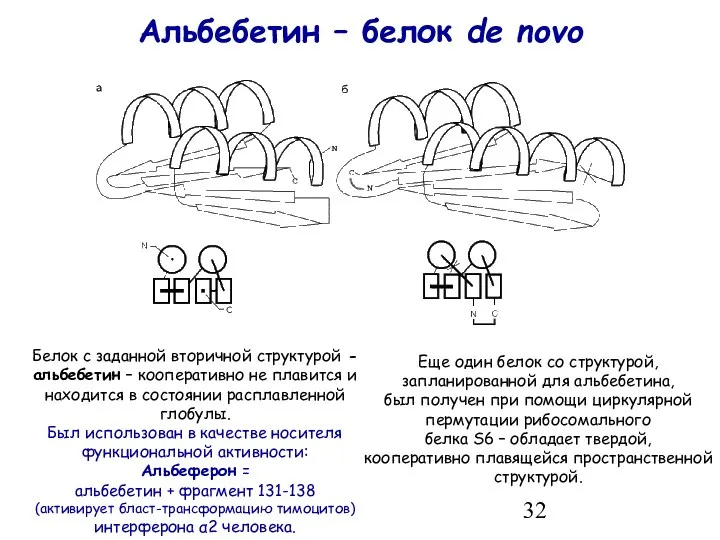
- 32. Альбебетин – белок de novo Белок с заданной вторичной структурой - альбебетин – кооперативно не плавится
- 33. Белок de novo – димер из двух β-шпилек, состоит всего из 20 АКО. Человеческий эритропоэтин (166
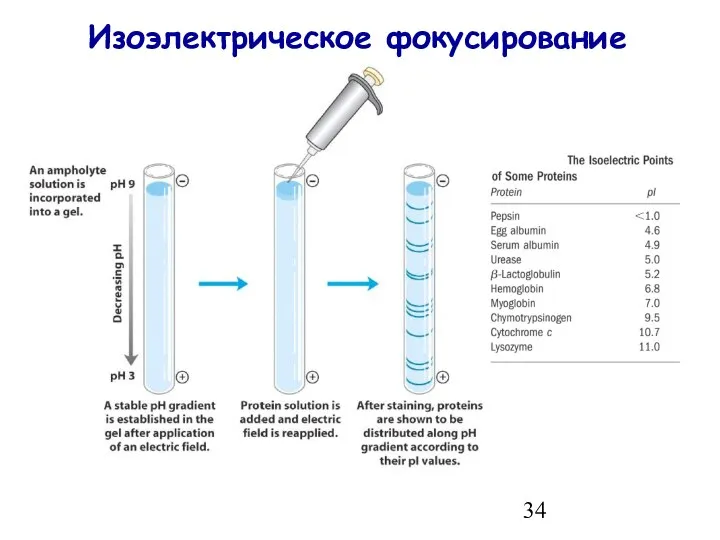
- 34. Изоэлектрическое фокусирование
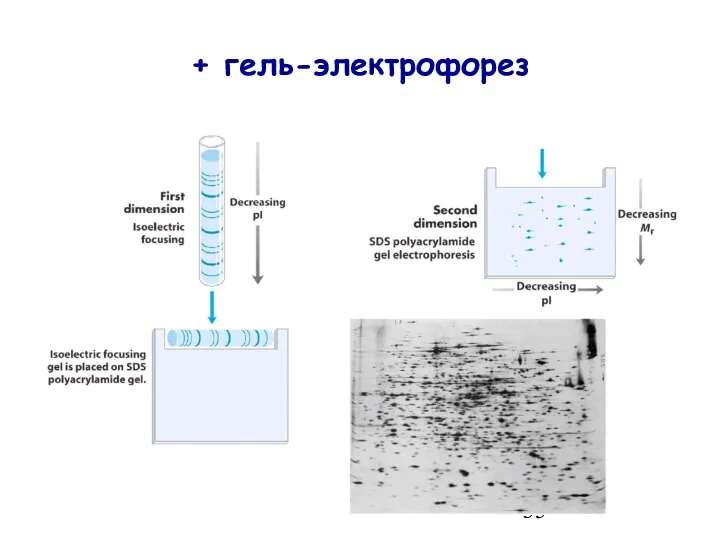
- 35. + гель-электрофорез
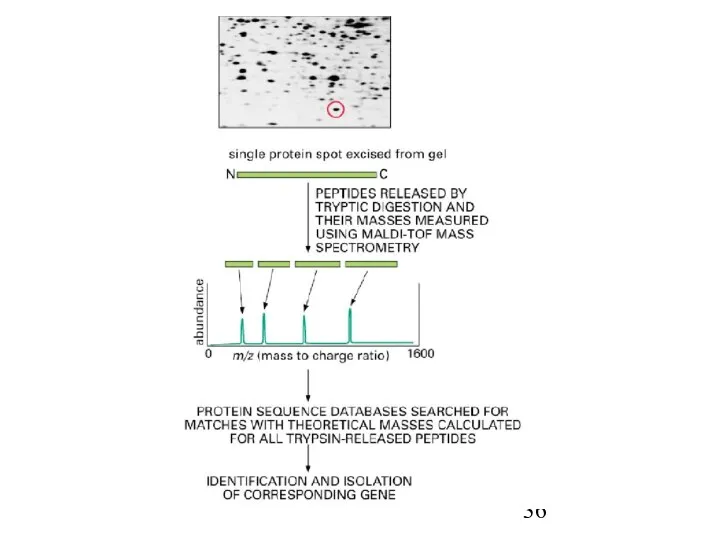
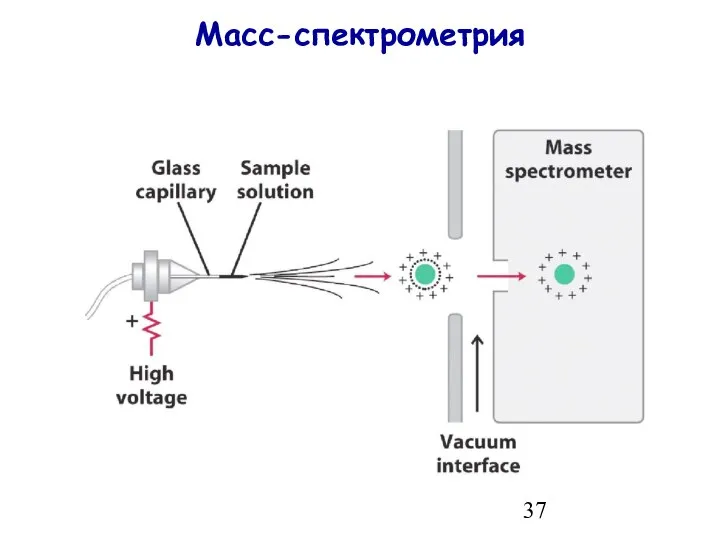
- 37. Масс-спектрометрия
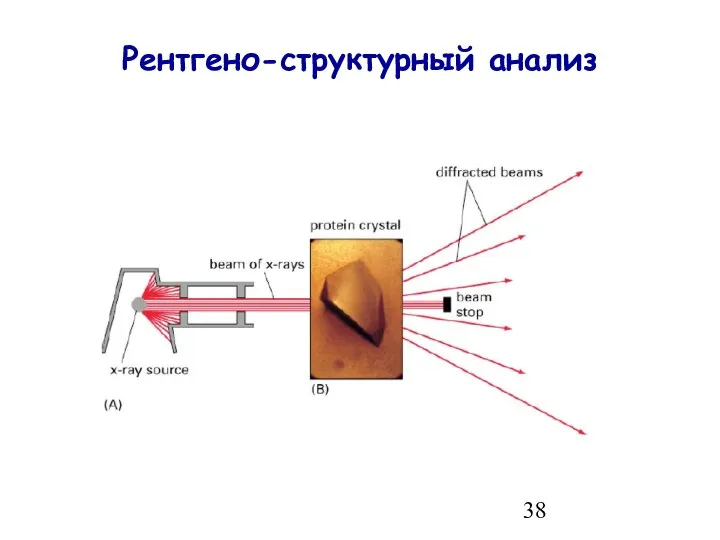
- 38. Рентгено-структурный анализ
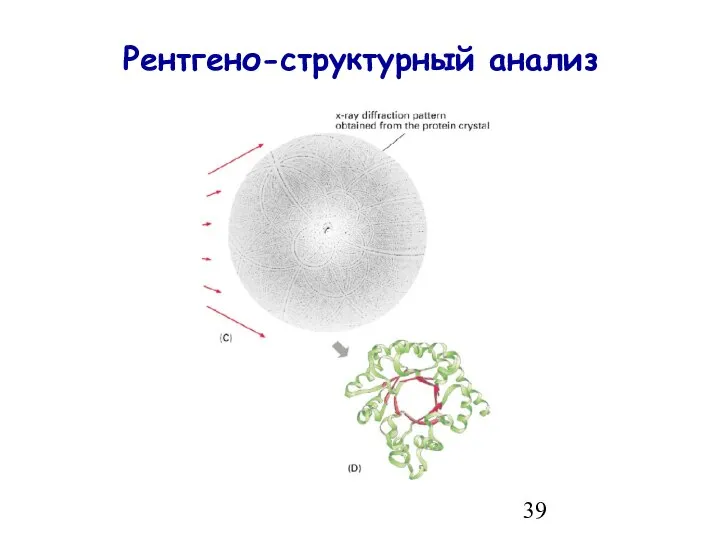
- 39. Рентгено-структурный анализ
- 44. Скачать презентацию









 Мир живых организмов. Уровни организации и свойства живого
Мир живых организмов. Уровни организации и свойства живого  Презентация на тему "Половое размножение животных (6 класс)" - скачать бесплатно презентации по Биологии
Презентация на тему "Половое размножение животных (6 класс)" - скачать бесплатно презентации по Биологии Закрепление знаний по теме «Процессы жизнедеятельности растений» Бухтиярова Антонина Петровна учитель химии и биологии МКОУ Ве
Закрепление знаний по теме «Процессы жизнедеятельности растений» Бухтиярова Антонина Петровна учитель химии и биологии МКОУ Ве Гербарий сказочных растений
Гербарий сказочных растений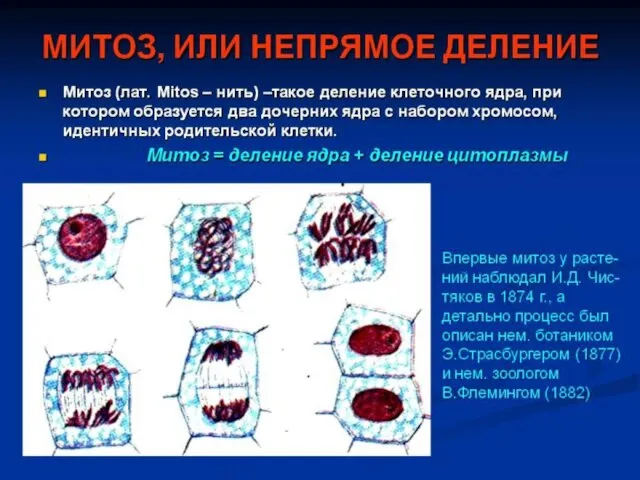 Презентация на тему "митоз" - скачать презентации по Биологии_
Презентация на тему "митоз" - скачать презентации по Биологии_ Сине-зелёные водоросли
Сине-зелёные водоросли Задания 21. Определение структуры объекта
Задания 21. Определение структуры объекта Презентация на тему "Бенгальский тигр" - презентации по Биологии
Презентация на тему "Бенгальский тигр" - презентации по Биологии Грызуны
Грызуны Тупорылая Акула
Тупорылая Акула Презентация на тему Гипотезы возникновения жизни на Земле
Презентация на тему Гипотезы возникновения жизни на Земле Генетика - наука о законах и механизмах наследственности и изменчивости организмов.
Генетика - наука о законах и механизмах наследственности и изменчивости организмов.  Шиншилла
Шиншилла Подцарство: многоклеточные животные. Тип: кишечнополостные
Подцарство: многоклеточные животные. Тип: кишечнополостные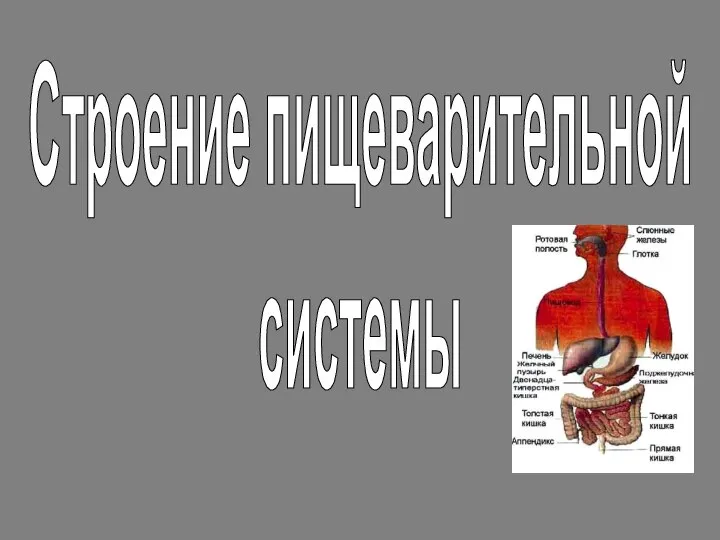 Презентация на тему Строение пищеварительной системы
Презентация на тему Строение пищеварительной системы  Рыбы Подвигина Ольга
Рыбы Подвигина Ольга Буроголовая гаичка – птица 2017 года. Паровозик из Синичкино
Буроголовая гаичка – птица 2017 года. Паровозик из Синичкино Презентация на тему "Самые странные деревья в мире" - скачать бесплатно презентации по Биологии
Презентация на тему "Самые странные деревья в мире" - скачать бесплатно презентации по Биологии Зимующие птицы нашего поселка
Зимующие птицы нашего поселка Презентация на тему "Костные рыбы" - скачать бесплатно презентации по Биологии
Презентация на тему "Костные рыбы" - скачать бесплатно презентации по Биологии Фізіологія мікроорганізмів. Хімічний склад, живлення та дихання. Ферменти мікробів, їх роль. Розмноження бактерій та інші прояви
Фізіологія мікроорганізмів. Хімічний склад, живлення та дихання. Ферменти мікробів, їх роль. Розмноження бактерій та інші прояви Красная книга птиц Ленинградской области
Красная книга птиц Ленинградской области Микробы для человека
Микробы для человека Если друг оказался …
Если друг оказался …  Рождение фундаментального естествознания в Древней Греции. (Лекция 2)
Рождение фундаментального естествознания в Древней Греции. (Лекция 2) генетические факторы, их воздействие на здоровье.
генетические факторы, их воздействие на здоровье. Отдел Голосеменные
Отдел Голосеменные Презентация "Почва"
Презентация "Почва"