Содержание
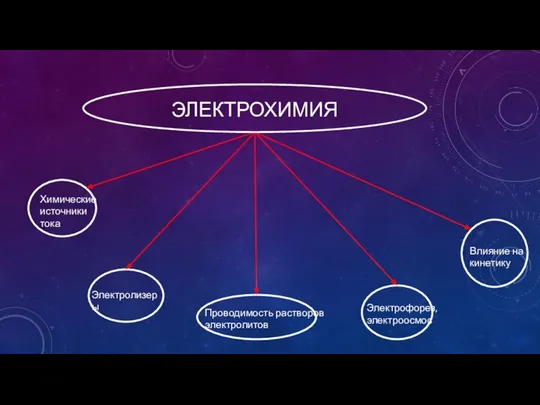
- 2. ЭЛЕКТРОХИМИЯ Химические источники тока Электролизеры Проводимость растворов электролитов Влияние на кинетику Электрофорез, электроосмос
- 3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Выделяется или поглощается энергия в виде тепла
- 4. НАПРИМЕР, ЦИНКОВАЯ ПЛАСТИНКА Это можно юзать!
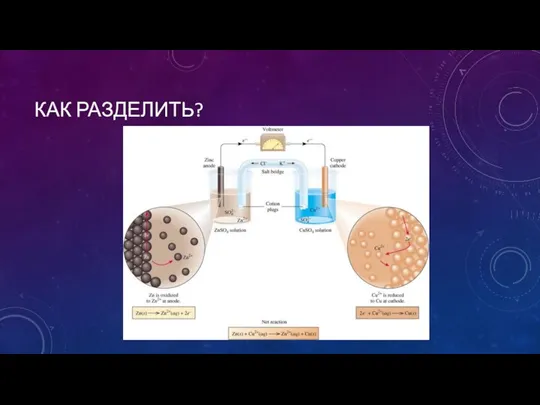
- 5. КАК РАЗДЕЛИТЬ?
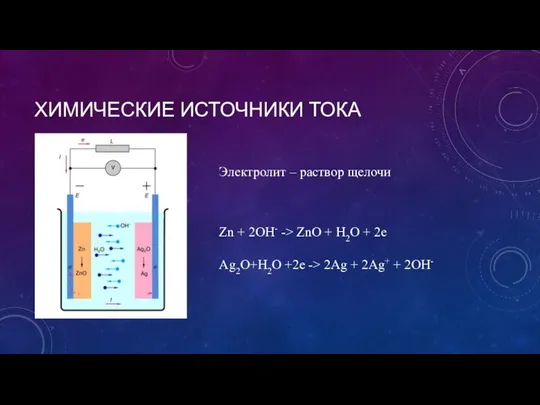
- 6. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА Zn + 2OH- -> ZnO + H2O + 2e Ag2O+H2O +2e -> 2Ag
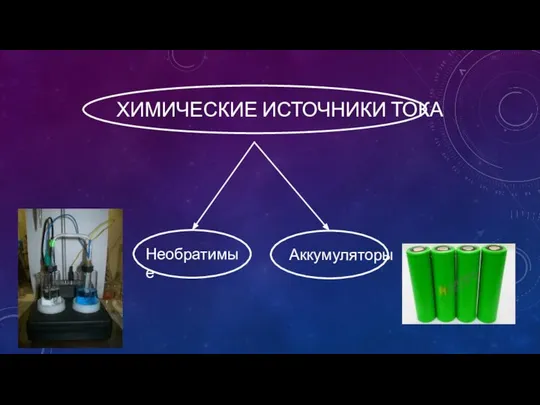
- 7. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА Необратимые Аккумуляторы
- 8. ПРИМЕР АККУМУЛЯТОРА – СВИНЦОВО-КИСЛОТНЫЙ Разряд – в прямом направлении, заряд – в обратном Сложности: 1) Расходование
- 9. ЗАДАНИЕ, ВСЕ КАК ВЫ ЛЮБИТЕ Покажите, что при разряде протекают прямые реакции, а при заряде –
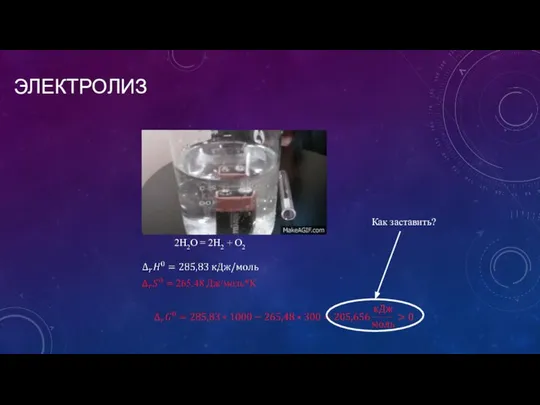
- 10. ЭЛЕКТРОЛИЗ 2H2O = 2H2 + O2 Как заставить?
- 11. ПРИМЕНЕНИЯ 1) Получение металлов и других веществ – хлора, гидроксида натрия, водорода и т. д. 2)
- 12. ЗАКОН ФАРАДЕЯ И КУЛОНОМЕТРИЯ Закон Фарадея: m = (Q/F)(M/z) => можно измерить массу выделившегося на электроде
- 13. ЭЛЕКТРОПРОВОДНОСТЬ УДЕЛЬНАЯ И МОЛЯРНАЯ В растворах электролитов есть заряженные частицы, значит эти растворы могут проводить ток.
- 14. ЗАВИСИМОСТЬ ОТ КОНЦЕНТРАЦИИ Рост – увеличение концентрации ионов. Падение – образование агрегатов, торможение противоположно направленными ионами
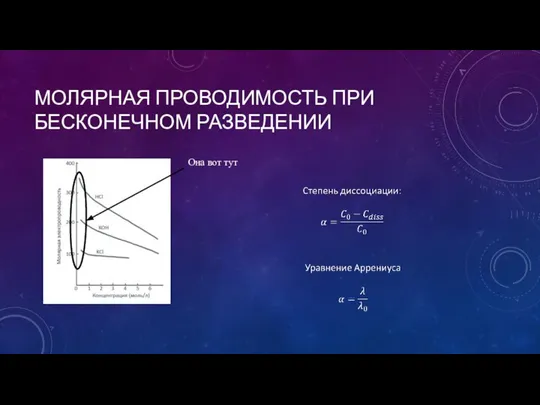
- 15. МОЛЯРНАЯ ПРОВОДИМОСТЬ ПРИ БЕСКОНЕЧНОМ РАЗВЕДЕНИИ Она вот тут
- 16. ПОМНИТЕ? БУМАГА ВСЕ СТЕРПИТ После диссоциации: CAB = CAB,0(1-α), CA+ = CB- = CAB,0 α Можно
- 17. ЕЩЕ ЗАДАНИЕ! КЛАССНО, ПРАВДА? Раствор какой соли проводит ток лучше? (концентрация 0,001 моль/л)
- 18. КОНДУКТОМЕТРИЯ
- 20. Скачать презентацию











 Краткая история развития радиосвязи
Краткая история развития радиосвязи Плоское движение тела
Плоское движение тела Шкала електромагнітних хвиль
Шкала електромагнітних хвиль Подобие физических явлений. Основы теории подобия. Примеры применения теории подобия для выбора условий испытаний моделей
Подобие физических явлений. Основы теории подобия. Примеры применения теории подобия для выбора условий испытаний моделей Откуда в наш дом приходит электричество?
Откуда в наш дом приходит электричество? Өлшеу қателігі. Құрал шкаласының және жүйелік қателерді есепке алу. Қос қателікті бағалау
Өлшеу қателігі. Құрал шкаласының және жүйелік қателерді есепке алу. Қос қателікті бағалау Тепловые двигатели и охрана окружающей среды
Тепловые двигатели и охрана окружающей среды Все о радиации
Все о радиации Аттестационная работа. Методическая разработка по выполнению исследовательской работы «От чего зависит сила Архимеда?»
Аттестационная работа. Методическая разработка по выполнению исследовательской работы «От чего зависит сила Архимеда?» Радиоизмерения и измерительные приборы
Радиоизмерения и измерительные приборы Электричество. Тест 13. Объяснение электризации тел
Электричество. Тест 13. Объяснение электризации тел Физические величины
Физические величины Механическая работа. Связь между работой и скоростью движения тела
Механическая работа. Связь между работой и скоростью движения тела Учиться и, когда придет время, прикладывать усвоенное к делу — разве это не прекрасно! Конфуций
Учиться и, когда придет время, прикладывать усвоенное к делу — разве это не прекрасно! Конфуций Электротехника. Электродвижущая сила источников электрической энергии и напряжение. Электромагнитня индукция
Электротехника. Электродвижущая сила источников электрической энергии и напряжение. Электромагнитня индукция Циклы углов и первый импульс как пророк. Циклы по цене и цели
Циклы углов и первый импульс как пророк. Циклы по цене и цели Основні засади метрологічного забезпечення вимірювань
Основні засади метрологічного забезпечення вимірювань Простейшая задача квантовой механики: частица в потенциальной яме (ящике). Квантовые точки
Простейшая задача квантовой механики: частица в потенциальной яме (ящике). Квантовые точки Момент силы. Правило момента
Момент силы. Правило момента Принцип работы кондиционера
Принцип работы кондиционера Ядерные технологии
Ядерные технологии Основы теории оболочек. Общие сведения о тонких пластинах
Основы теории оболочек. Общие сведения о тонких пластинах Поняття про топологію електричного кола та його граф
Поняття про топологію електричного кола та його граф Строительная физика
Строительная физика Презентация по физике "Нагревание тела" - скачать
Презентация по физике "Нагревание тела" - скачать  Понятие механической работы. Понятие мощности. Единицы измерения мощности
Понятие механической работы. Понятие мощности. Единицы измерения мощности Функції, властивості, класифікація та будова скелетних м’язових волокон. (Лекція 4)
Функції, властивості, класифікація та будова скелетних м’язових волокон. (Лекція 4) Система уравнений Максвелла. Основные уравнения электродинамики
Система уравнений Максвелла. Основные уравнения электродинамики