Содержание
- 2. I. Функция распределения Пусть имеется термодинамическая система из N частиц. ξ — ФВ, характеризующая частицу. Вероятность
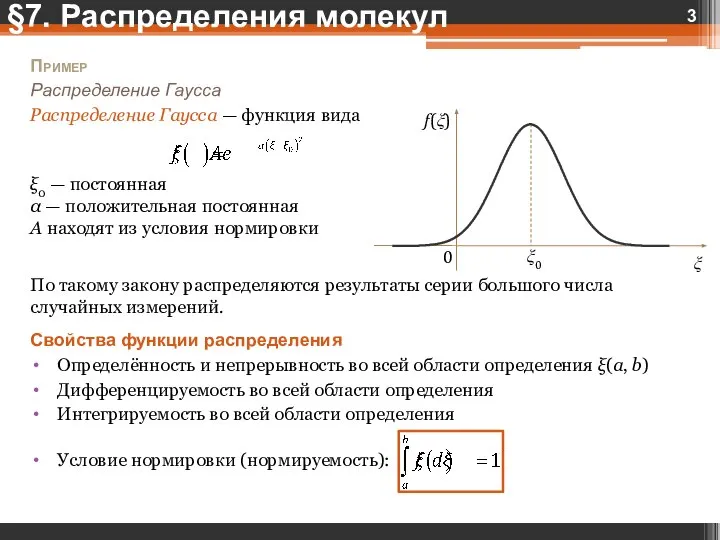
- 3. Пример Распределение Гаусса Распределение Гаусса — функция вида ξ0 — постоянная α — положительная постоянная A
- 4. Зная функцию распределения, можно найти среднее значение любого параметра, зависящего от ξ. Вероятность того, что ξ
- 5. II. Распределение молекул идеального газа по скоростям (распределение Максвелла) Рассмотрим идеальный газ из N частиц. Случайная
- 6. §7. Распределения молекул
- 7. — функция распределения Максвелла §7. Распределения молекул
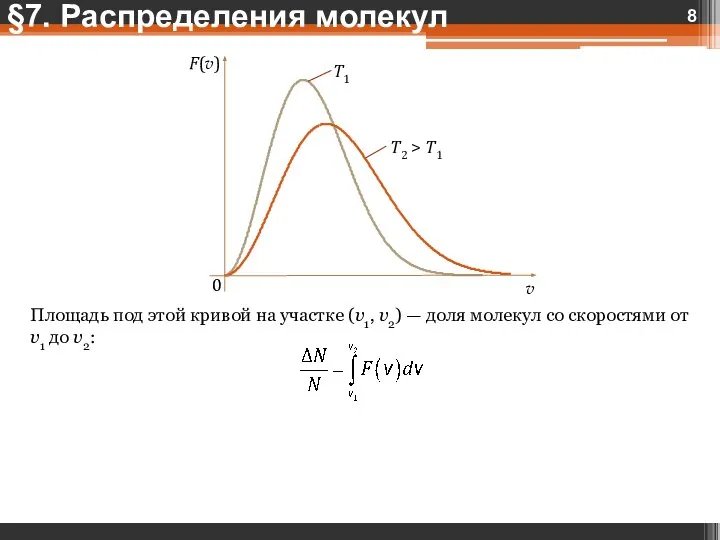
- 8. Площадь под этой кривой на участке (v1, v2) — доля молекул со скоростями от v1 до
- 9. Наивероятнейшая скорость молекулы идеального газа — скорость, соответствующая максимуму функции распределения F(v): Средняя скорость молекулы идеального
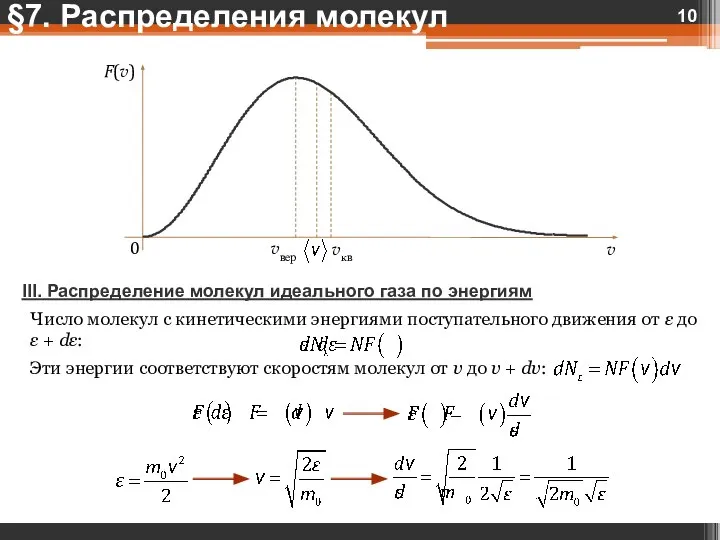
- 10. III. Распределение молекул идеального газа по энергиям Число молекул с кинетическими энергиями поступательного движения от ε
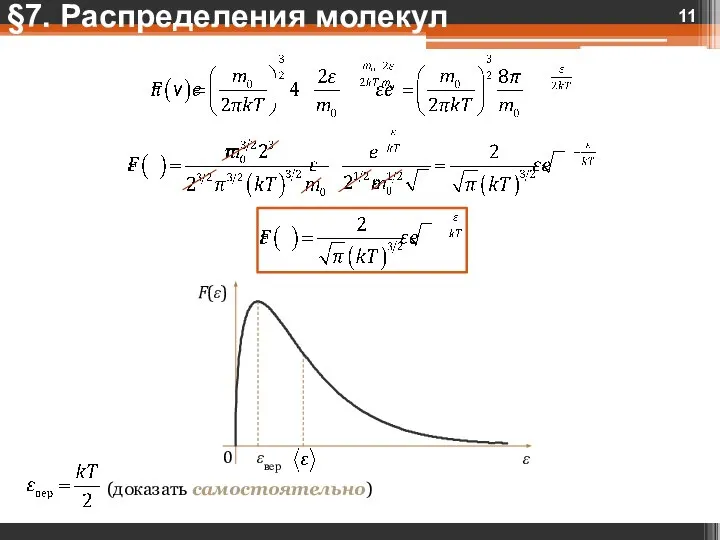
- 11. (доказать самостоятельно) §7. Распределения молекул
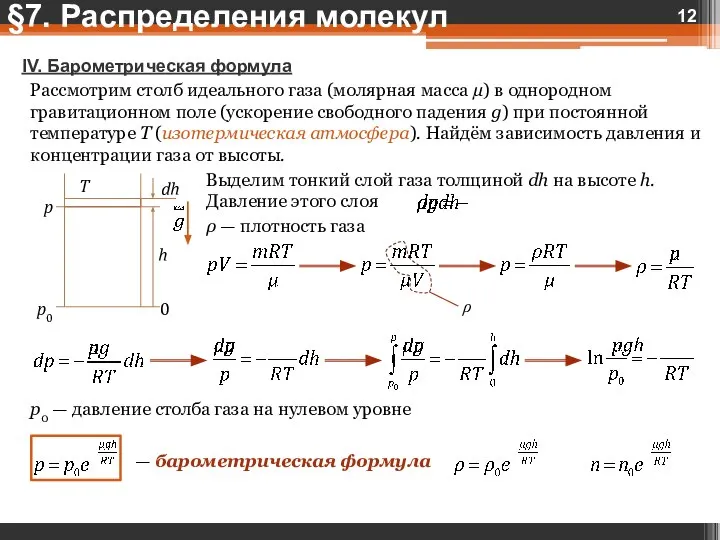
- 12. IV. Барометрическая формула Рассмотрим столб идеального газа (молярная масса µ) в однородном гравитационном поле (ускорение свободного
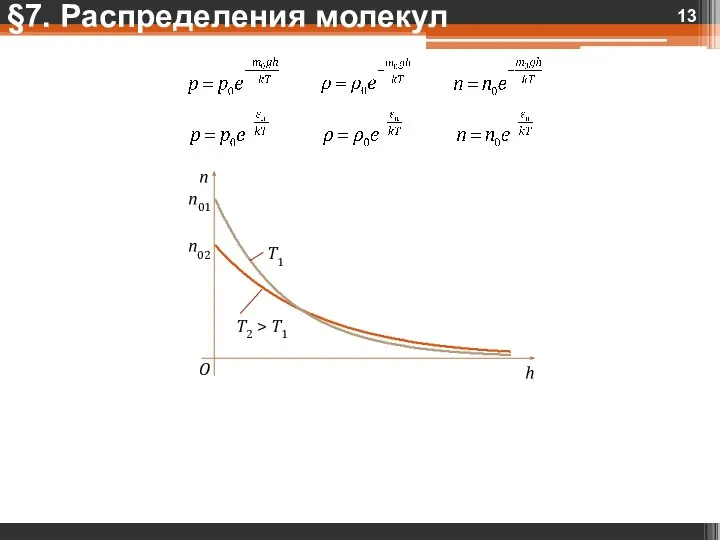
- 13. §7. Распределения молекул
- 15. Скачать презентацию






 Эксперименты по физике
Эксперименты по физике Тепловые явления, тепловые двигатели, охрана окружающей среды
Тепловые явления, тепловые двигатели, охрана окружающей среды Презентация Колебательные движения
Презентация Колебательные движения Микроструктура материалов
Микроструктура материалов Механическое движение
Механическое движение Геологическая эволюция океана. (Лекция 6)
Геологическая эволюция океана. (Лекция 6) Сравнение количеств теплоты при смешивании воды разной температуры. Лабораторная работа №1
Сравнение количеств теплоты при смешивании воды разной температуры. Лабораторная работа №1 Знаем ли мы физику?
Знаем ли мы физику? Способы определения массы тела без весов Работу выполнил: ученик 9 класса Кравченко Юрий Анатольевич
Способы определения массы тела без весов Работу выполнил: ученик 9 класса Кравченко Юрий Анатольевич Презентация по физике "Закон Ома" - скачать бесплатно
Презентация по физике "Закон Ома" - скачать бесплатно Состав ядра. Ядерные силы
Состав ядра. Ядерные силы Виды передач. Червячные передачи
Виды передач. Червячные передачи Электромагниттік өріс
Электромагниттік өріс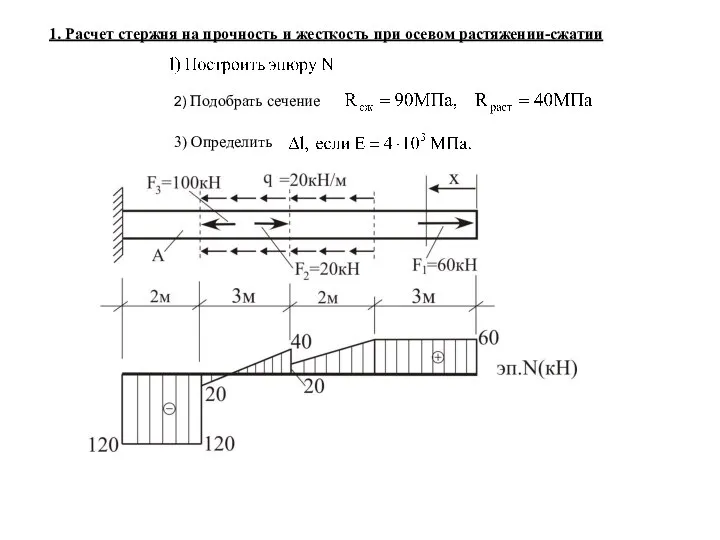 Расчет стержня на прочность и жесткость при осевом растяжении-сжатии
Расчет стержня на прочность и жесткость при осевом растяжении-сжатии Основные положения молекулярно-кинетической теории и их опытные подтверждения
Основные положения молекулярно-кинетической теории и их опытные подтверждения Презентация по физике "М.В.Ломоносов в области физики и астрономии" - скачать
Презентация по физике "М.В.Ломоносов в области физики и астрономии" - скачать  Гравитациялық өріс. Өріс теориясының элементтері
Гравитациялық өріс. Өріс теориясының элементтері Презентация по физике Электрический ток в электролитах
Презентация по физике Электрический ток в электролитах  Датчик числа оборотов G28
Датчик числа оборотов G28 Электричество и магнетизм. Теорема Гаусса в дифференциальной форме. (Лекция 3)
Электричество и магнетизм. Теорема Гаусса в дифференциальной форме. (Лекция 3) Электрический ток через контакт полупроводников p и n типов
Электрический ток через контакт полупроводников p и n типов Обозначения и единицы измерения
Обозначения и единицы измерения Биологические действия радиоактивных излучений на растения…
Биологические действия радиоактивных излучений на растения… Резонанс. Колебание
Резонанс. Колебание Механическая работа. Единицы работы
Механическая работа. Единицы работы Основные свойства диэлектриков. Сегнетоэлектрики
Основные свойства диэлектриков. Сегнетоэлектрики Электрические схемы
Электрические схемы Нанотехнологии. Понятие и основные принципы нанотехнологии
Нанотехнологии. Понятие и основные принципы нанотехнологии