Содержание
- 2. Рассматриваемые вопросы: 1. 1. Основы молекулярно-кинетической теории. 2. 2. Температура. Энергия теплового движения молекул2. Температура. Энергия
- 3. Основы молекулярно-кинетической теории Домашнее задание: п.п 56-59
- 4. Молекулярно-кинетическая теория - учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул
- 5. МКТ объясняет свойства макроскопических тел и тепловых процессов, на основе представлений о том, что все тела
- 6. Основы МКТ Основные положения МКТ Молекулярно-кинетическая теория Масса и размеры молекул Количество вещества Строение газов, жидкостей
- 7. Основные положения МКТ 1. Все вещества состоят из молекул 2. Молекулы находятся в непрерывном беспорядочном движении
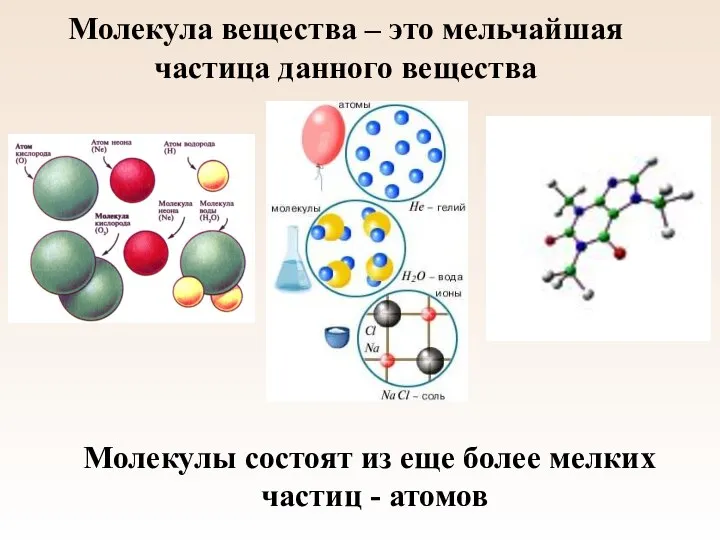
- 8. Молекула вещества – это мельчайшая частица данного вещества Молекулы состоят из еще более мелких частиц -
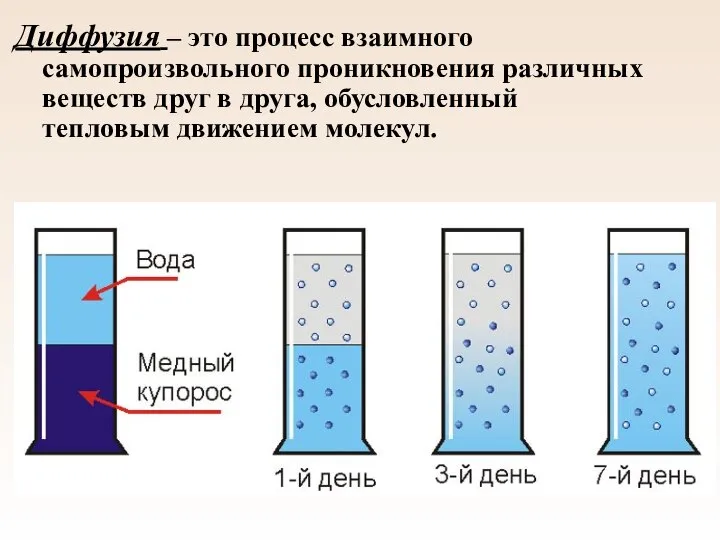
- 9. Диффузия – это процесс взаимного самопроизвольного проникновения различных веществ друг в друга, обусловленный тепловым движением молекул.
- 10. Броуновское движение Причина броуновского движения состоит в том, что удары молекул жидкости о частицу не компенсируют
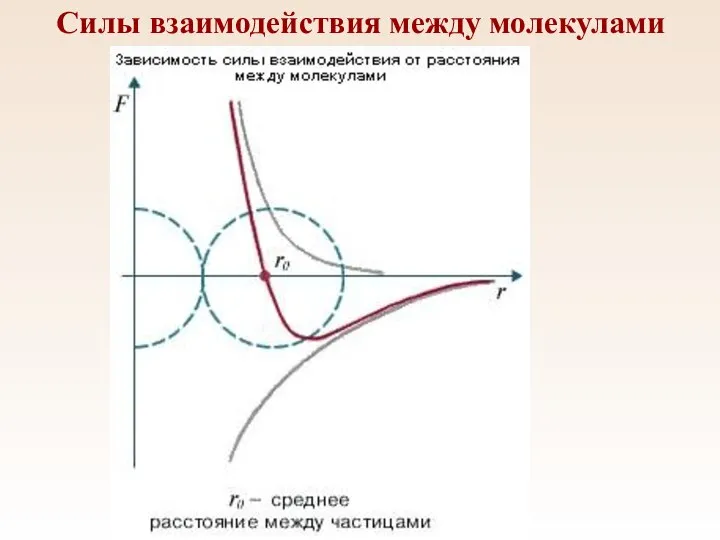
- 11. Силы взаимодействия между молекулами
- 12. кофе этанол Масса и размеры молекул
- 14. Масса молекул В 1 г воды содержится 3,7 * 1022 молекул. Массы молекул в макроскопических масштабах
- 15. Масса молекул. Количество вещества Относительной молекулярной (или атомной) массой вещества (Мr) называют отношение массы молекулы (или
- 16. Количество вещества Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но
- 17. В 1 моле любого вещества содержится одно и то же число атомов или молекул. Количество вещества
- 18. Молярной массой вещества называют массу вещества, взятого в количестве 1 моль. m0 - масса одной молекулы
- 19. m – масса вещества
- 20. Основное уравнение молекулярно-кинетической теории Домашнее задание: п.п 60-63
- 21. Строение газов, жидкостей и твердых тел
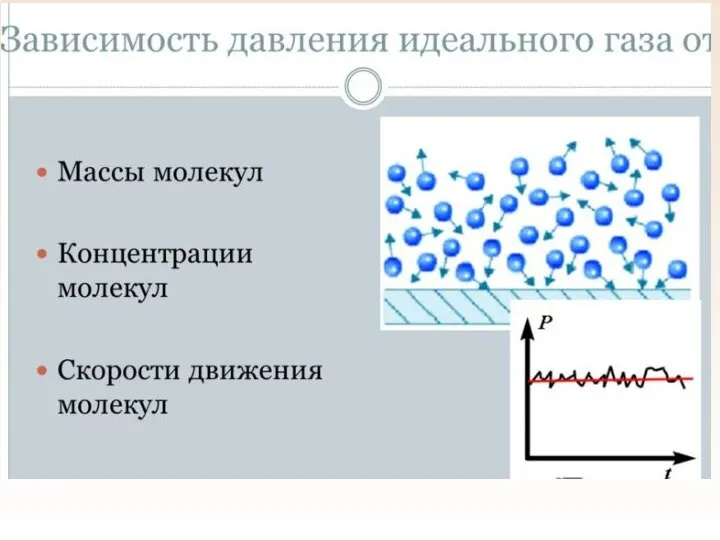
- 23. Идеальный газ Идеальный газ – это газ, в котором Частицы – материальные точки Частицы взаимодействуют только
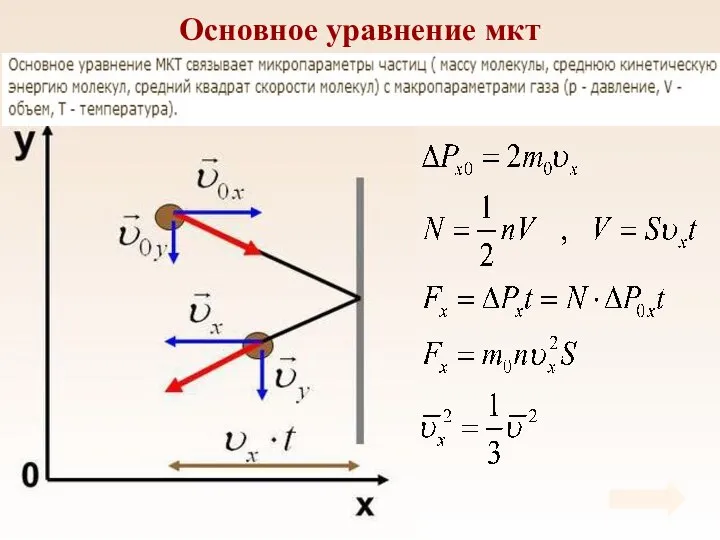
- 24. Основное уравнение мкт Основное уравнение мкт устанавливает зависимость давления газа от средней кинетической энергии его молекул.
- 26. Среднее значение квадрата скорости молекул Скорость – величина векторная, поэтому средняя скорость движения частиц в газе
- 27. Среднее значение квадрата скорости молекул
- 28. Основное уравнение мкт
- 31. Решение задач по теме: «Основы молекулярно-кинетической теории» Домашнее задание: п.п 56-63, упр.11
- 32. Какое количество вещества в молях составляют 5,418х1026 молекул? (900 моль) Какова масса в килограммах 450 молей
- 36. Какое давление на стенки сосуда производит кислород, если средняя квадратичная скорость его молекул 400 м/с и
- 37. Температура и энергия теплового движения молекул Домашнее задание: п.64-67
- 38. Температура и тепловое равновесие Температура – мера средней кинетической энергии молекул Скорости молекул
- 39. Температура и тепловое равновесие Макроскопические параметры (макропараметры) – величины, характеризующие состояние макроскопических тел без учета молекулярного
- 40. Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходит в состояние теплового
- 41. Термометр – прибор для измерения температуры тела. Термометр входит в состояние теплового равновесия с исследуемым телом
- 42. Основная деталь термометра – термометрическое тело, то есть тело, макропараметры которого изменяются при изменении температуры. (Например,
- 43. Изобретателем термометра является Галилео Галилей (ок. 1600 г.) Термометрическим телом в его термометре являлся газ –
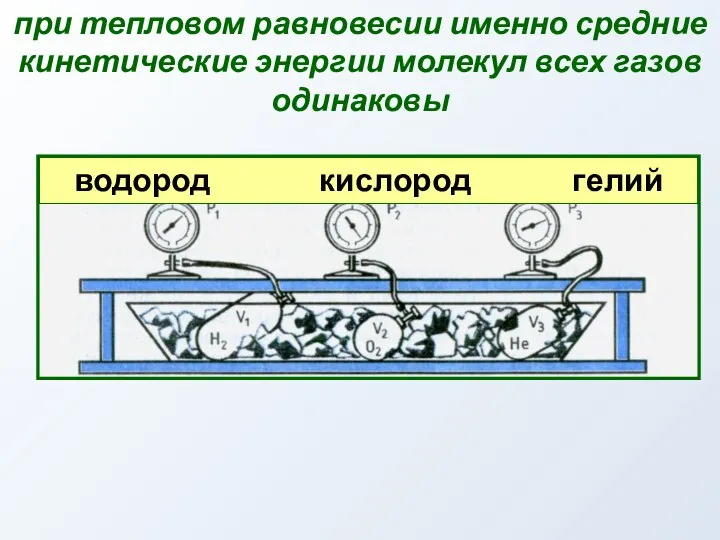
- 44. при тепловом равновесии именно средние кинетические энергии молекул всех газов одинаковы водород кислород гелий
- 46. - температура в энергетических единицах Т- температура в градусах Кельвина (абсолютная температура) k- коэффициент пропорциональности, постоянная
- 47. Постоянная Больцмана связывает температуру в энергетических единицах с температурой в Кельвинах.
- 48. температура – мера средней кинетической энергии молекул.
- 49. Абсолютная температура и абсолютный нуль Из полученного равенства следует, что при Т = 0 должны равняться
- 50. ΔТ = Δ t Т = t + 273
- 51. Зависимость давления газа от температуры и концентрации молекул газа
- 52. Скорости молекул
- 56. Уравнение состояния идеального газа Домашнее задание: п.68-69
- 57. Уравнение Менделеева-Клапейрона Газовые законы Изотермический процесс Изобарный процесс Изохорный процесс
- 58. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона) - универсальная газовая постоянная
- 59. Если в ходе процесса масса газа остается неизменной, то
- 60. Изопроцессы Изотермический процесс Изобарный процесс Изохорный процесс
- 61. Изотермический процесс Процесс, происходящий с газом неизменной массы при постоянной температуре называется изотермическим. Изотермический процесс описывается
- 62. Изобарный процесс Процесс, происходящий с газом неизменной массы при постоянном давлении называется изобарным. Изобарный процесс описывается
- 63. Изохорный процесс Процесс, происходящий с газом неизменной массы при постоянном объеме называется изохорным. Изохорный процесс описывается
- 64. Графики изопроцессов
- 65. Решение задач на газовые законы Домашнее задание: п.68-69
- 66. 1. Определите среднюю кинетическую энергию молекулы одноатомного газа и концентрацию молекул при температуре 290К и давлении
- 69. Взаимные превращения жидкостей и газов Домашнее задание: П.п.70-72,
- 70. Насыщенный пар Испарение и кипение Влажность воздуха Измерение влажности
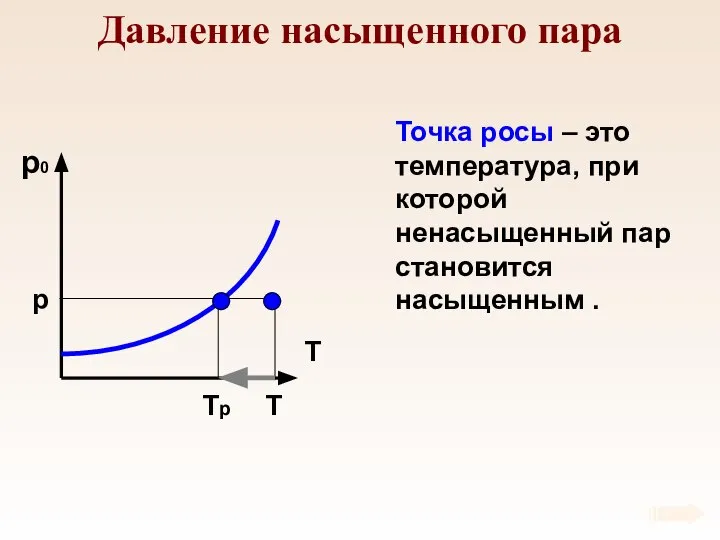
- 72. Давление насыщенного пара p1, V1 Давление насыщенного пара не зависит от занимаемого объема.
- 73. Давление насыщенного пара Давление насыщенного пара зависит только от температуры.
- 74. Давление насыщенного пара p T Tр Точка росы – это температура, при которой ненасыщенный пар становится
- 76. Испарение и кипение Процесс парообразования с поверхности жидкости. Процесс парообразования по всему объему жидкости. Происходит при
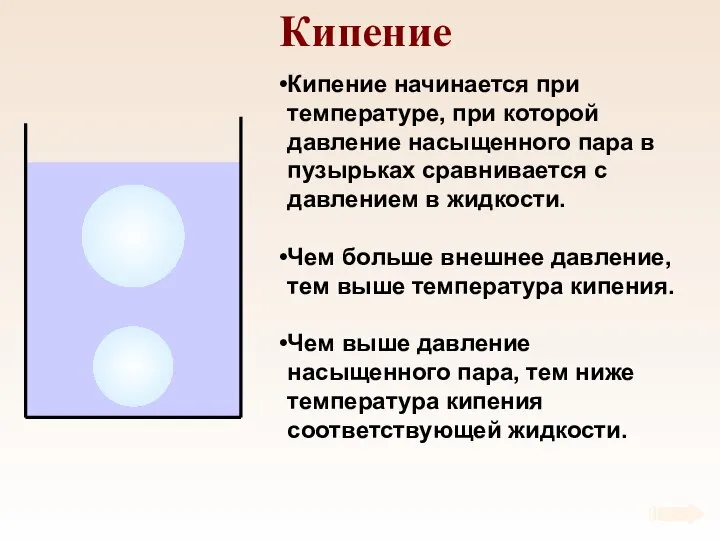
- 77. Кипение Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в
- 79. Измерение влажности Приборы для измерения влажности: Психрометр Гигрометр
- 80. Решение задач на определение влажности воздуха Домашнее задание: П.п.70-72, упр. 14
- 81. Измерьте влажность воздуха в кабинете при помощи психрометра. Вычислите массу насыщенного водяного пара в 1 куб.м
- 82. Твердые тела Домашнее задание: п.п.73-74
- 83. Закон Гука Кристаллические тела Аморфные тела
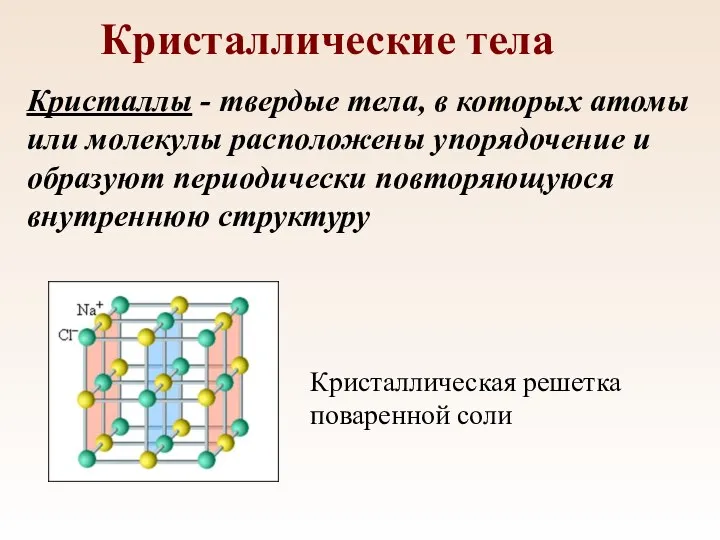
- 84. Кристаллические тела Кристаллы - твердые тела, в которых атомы или молекулы расположены упорядочение и образуют периодически
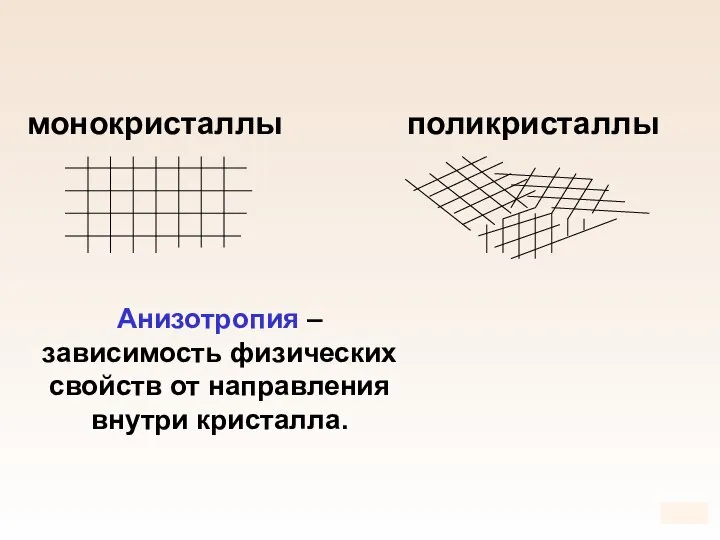
- 85. монокристаллы поликристаллы Анизотропия – зависимость физических свойств от направления внутри кристалла.
- 86. Аморфные тела Нет строгого порядка в расположении атомов. Все аморфные тела изотропны, т.е их физические свойства
- 87. Основы термодинамики Внутренняя энергия Работа в термодинамике Количество теплоты Первый закон термодинамики и его применение к
- 88. Внутренняя энергия Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов)
- 89. В идеальном газе частицы не взаимодействуют между собой, следовательно их потенциальные энергии равны нулю.
- 90. Одноатомный газ (неон, аргон, гелий) – i = 3. Двухатомный газ (водород, азот) – i =
- 91. Способы изменения внутренней энергии: Передача теплоты Совершение работы
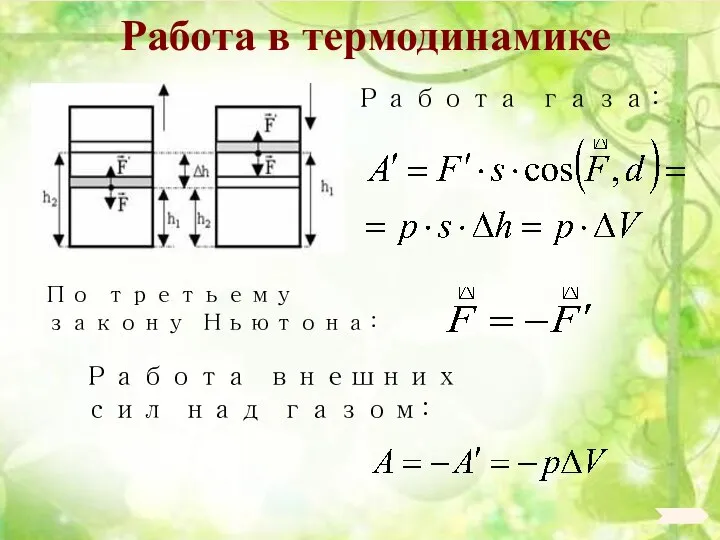
- 92. Работа в термодинамике Работа газа: По третьему закону Ньютона: Работа внешних сил над газом:
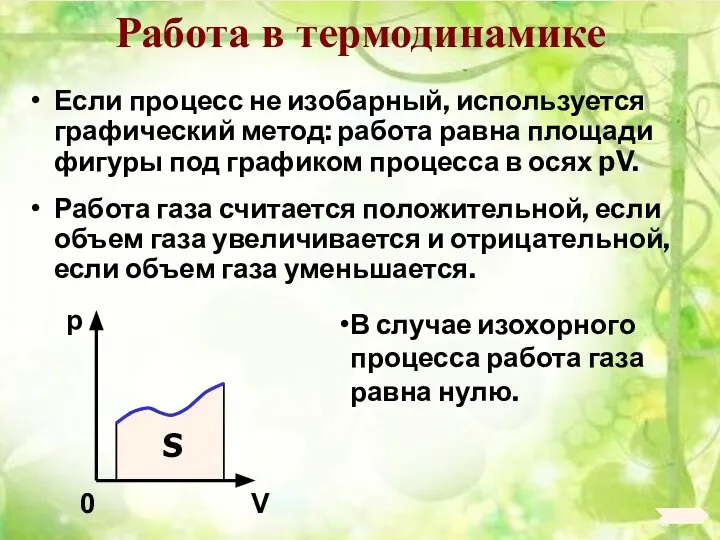
- 93. Работа в термодинамике Если процесс не изобарный, используется графический метод: работа равна площади фигуры под графиком
- 94. Количество теплоты Количество теплоты – это энергия полученная или отданная телом в процессе теплопередачи. Виды теплопередачи:
- 95. Количество теплоты Q = cm(t02-t01) – нагревание (охлаждение) Q=±λm - плавление (отвердевание) Q = ±Lm -
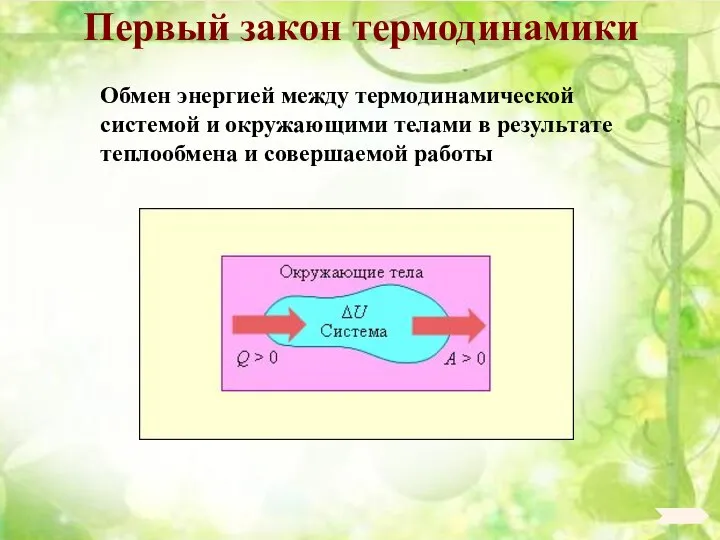
- 96. Первый закон термодинамики Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой
- 97. Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних
- 98. Применение первого закона термодинамики к различным процессам Изотермический процесс Изобарный процесс Изохорный процесс Адиабатный процесс
- 99. Изотермический процесс (Т=const)
- 101. Изобарный процесс (p=const)
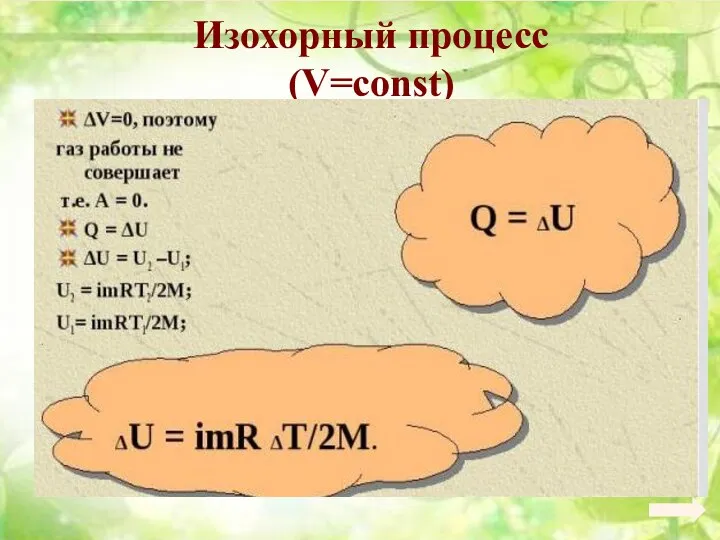
- 103. Изохорный процесс (V=const)
- 105. Адиабатный процесс
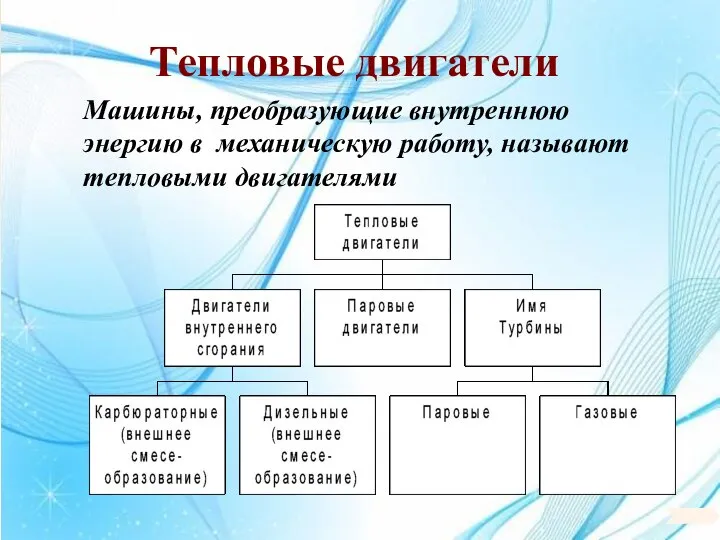
- 107. Тепловые двигатели Машины, преобразующие внутреннюю энергию в механическую работу, называют тепловыми двигателями
- 108. Тепловые двигатели Энергетическая схема тепловой машины: 1 – нагреватель; 2 – холодильник; 3 – рабочее тело,
- 109. Идеальная тепловая машина - машина Карно (Сади Карно, Франция, 1815) Машина работает на идеальном газе. 1
- 111. Скачать презентацию



























































































 Приёмники оптического излучения
Приёмники оптического излучения Знатоки физики
Знатоки физики Презентация по физике на тему: СИЛА ТРЕНИЯ Подготовили:Бутырский Иван, Похилько Николай. Предподаватель: Юрова Елена Анатольевн
Презентация по физике на тему: СИЛА ТРЕНИЯ Подготовили:Бутырский Иван, Похилько Николай. Предподаватель: Юрова Елена Анатольевн Презентация по физике "Оптические приборы, вооружающие глаз" - скачать
Презентация по физике "Оптические приборы, вооружающие глаз" - скачать  Жарық дисперсиясы және поляризациясы
Жарық дисперсиясы және поляризациясы Проводники в электрическом поле Проводники в электрическом поле
Проводники в электрическом поле Проводники в электрическом поле Динамика. Законы динамики
Динамика. Законы динамики 1 закон Ньютона (1)
1 закон Ньютона (1) Аттестационная работа. Физика в мини-проектах
Аттестационная работа. Физика в мини-проектах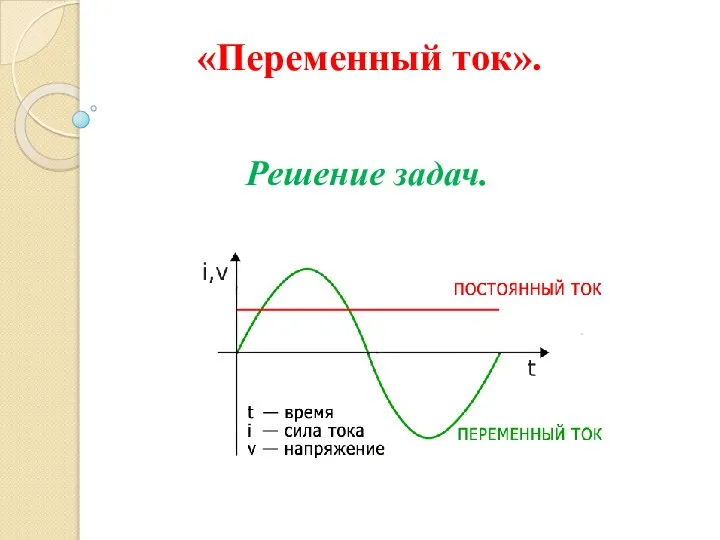 Переменный ток. Решение задач
Переменный ток. Решение задач Вес тела
Вес тела Электродинамика. Электростатика
Электродинамика. Электростатика Электромагнитная совместимость в электротехнических комплексах. Удар молнии
Электромагнитная совместимость в электротехнических комплексах. Удар молнии Пространственно-временные модуляторы света
Пространственно-временные модуляторы света Вещества в магнитном поле
Вещества в магнитном поле Мощность, единицы мощности
Мощность, единицы мощности Механическое равновесие, механические колебания и волны
Механическое равновесие, механические колебания и волны Демо-версия ЕГЭ по физике 2008 и 2013 год
Демо-версия ЕГЭ по физике 2008 и 2013 год Термоэлекричество. Термоэлектрические явления
Термоэлекричество. Термоэлектрические явления Презентация по физике "Сила Лорэнса" - скачать
Презентация по физике "Сила Лорэнса" - скачать  Электродвижущая сила. Закон Ома для полной цепи Физика, 10 класс
Электродвижущая сила. Закон Ома для полной цепи Физика, 10 класс Урок 1. Тема: Что такое нано? Элективный курс «Первые шаги в наномир»
Урок 1. Тема: Что такое нано? Элективный курс «Первые шаги в наномир»  Магнітне поле постійного струму
Магнітне поле постійного струму Исследование в области физики плазмы и термоядерного синтеза
Исследование в области физики плазмы и термоядерного синтеза Проект “Дизельный двигатель”
Проект “Дизельный двигатель” Відносність і одночасність подій. Закон взаємозв’язку маси і енергії
Відносність і одночасність подій. Закон взаємозв’язку маси і енергії Определение удельного вращения и концентрации сахара в растворе
Определение удельного вращения и концентрации сахара в растворе Становление и развитие тепловых двигателей. (Тема 3)
Становление и развитие тепловых двигателей. (Тема 3)