Содержание
- 2. Сабақ мақсаты: қалыпты және стандартты жағдайдағы газдардың молярлық көлемін есептеулерде қолдану; газдың салыстырмалы тығыздығын есептеу.
- 3. Бағалау критерийлері: Есеп шартын жаза біледі; Реакция теңдеулерін дұрыс жазып, коэффициенттерін қоя алады. Молярлық көлем -
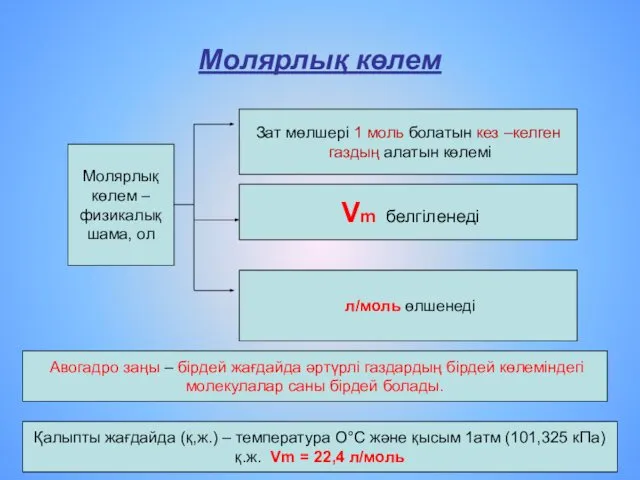
- 5. Молярлық көлем Молярлық көлем – физикалық шама, ол Зат мөлшері 1 моль болатын кез –келген газдың
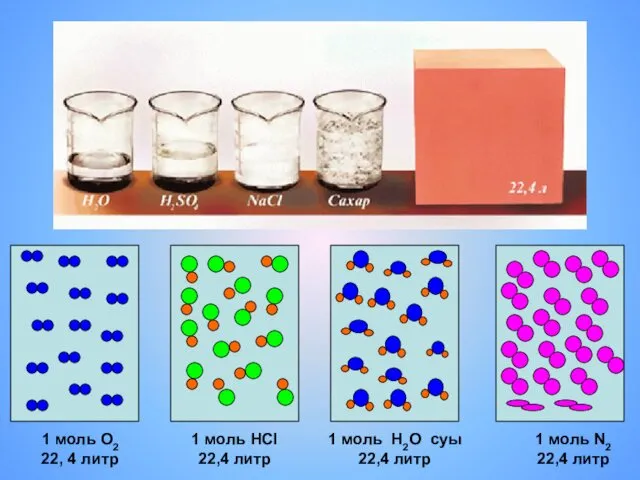
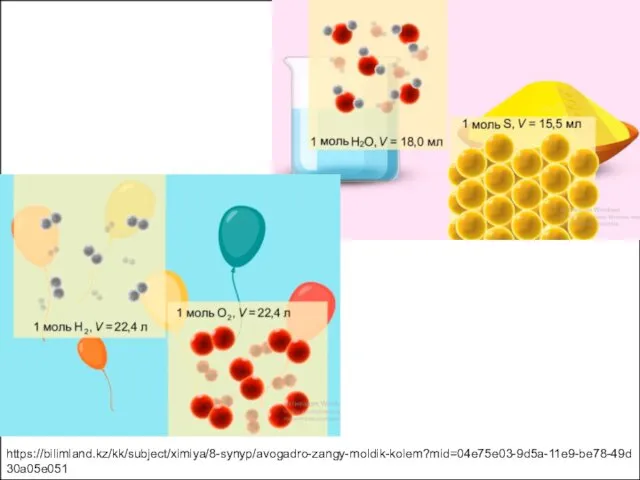
- 6. 1 моль О2 22, 4 литр 1 моль HCl 22,4 литр 1 моль Н2О суы 22,4
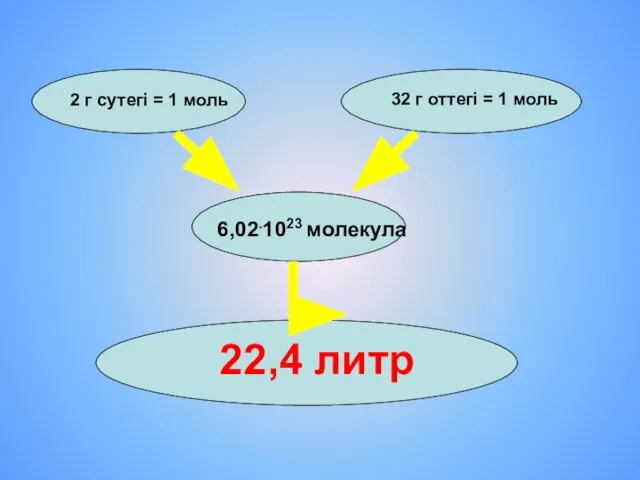
- 7. 2 г сутегі = 1 моль 32 г оттегі = 1 моль 6,02.1023 молекула 22,4 литр
- 8. https://bilimland.kz/kk/subject/ximiya/8-synyp/avogadro-zangy-moldik-kolem?mid=04e75e03-9d5a-11e9-be78-49d30a05e051
- 9. Авогадро заңы 1811 жылы итальян ғалымы Амадео Авогадро әртүрлі газдарды зерттеп, кейіннен расталған гипотезаны құрастырып, оны
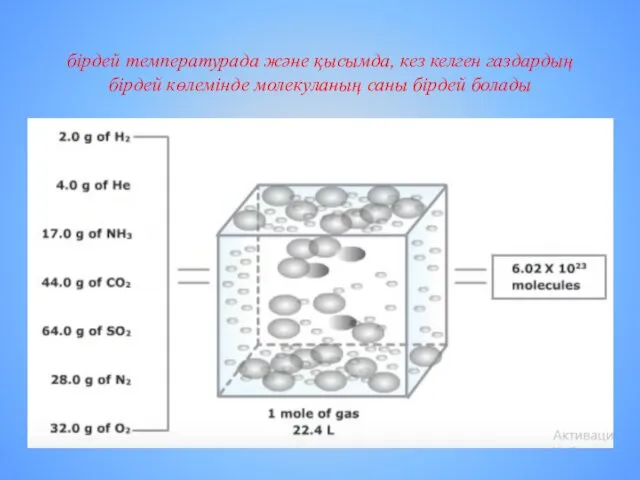
- 10. бірдей температурада және қысымда, кез келген газдардың бірдей көлемінде молекуланың саны бірдей болады
- 11. Есептер шығарғанда реакцияның жүру жағдайларына ерекше көңіл бөлу керек Қалыпты жағдайда (қ.ж.), яғни 00С температурада, 1
- 12. Құрамында бөлшектер саны бірдей ме?: Қалыпты жағдайда 3 л азот және 3 л оттегіде? Қалыпты жағдайда
- 13. Құрамында бөлшектер саны бірдей ме немесе әртүрлі ме?: 36 г су және 4 г сутегіде? 16
- 14. Есеп Көлемі 4,5 л әуе шарын сутегімен (қ.ж.) толтырған. Сутегінің қандай мөлшері ауаға ұшты? Оның массасы
- 15. Егер газдың тығыздығы белгілі болса, онда газдың молярлық массасын оңай табуға болады : Берілгені: ρ (газ)
- 16. Есеп Белгісіз газдың молярлық массасын табыңыз, егер оның тығыздығы 1,964 г/ моль болса.
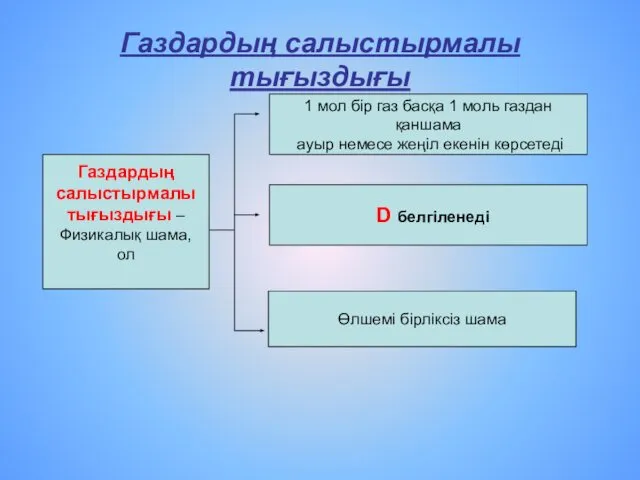
- 17. Газдың салыстырмалы тығыздығы – бұл бір газдың екіншісінен қаншаға ауыр немесе жеңіл екенін көрсететін шама D(газ1)(газ2)
- 18. Газдардың салыстырмалы тығыздығы Газдардың салыстырмалы тығыздығы – Физикалық шама, ол 1 мол бір газ басқа 1
- 19. Есеп Азоттың сутегі бойынша салыстырмалы тығыздығын анықтаңыз
- 20. Есеп СН4 метанның ауа бойынша салыстырмалы тығыздығын анықтаңыз.
- 21. Есеп Газ тәрізді этанның массасын анықтаңыз, егер оның сутегімен салыстырмалы тығыздығы 15 болса.
- 22. ? ? ?
- 23. Сұрақтар: «Зат мөлшері» қалай белгіленеді? Қандай бірлікте өлшенеді? Авогадро санының сандық мәні қандай? «Молярлық масса» қалай
- 24. Мен білдім.................. Мен үйрендім.............. Маған ұнады................ Мен қиналдым............ Менің көніл – күйім....... Сабақта:
- 26. Скачать презентацию
















 Робот-исследователь, способный измерять некоторые физические факторы среды
Робот-исследователь, способный измерять некоторые физические факторы среды Расчеты на изгиб
Расчеты на изгиб Лазер. Устройство лазера
Лазер. Устройство лазера Закон Кулона
Закон Кулона Сұйық орталарды араластыру
Сұйық орталарды араластыру Элемент электрической цепи, параметры которого не зависят от тока в нем, называют линейным, в противном случае – нелинейным
Элемент электрической цепи, параметры которого не зависят от тока в нем, называют линейным, в противном случае – нелинейным Работа силы тяжести
Работа силы тяжести Електричні двигуни
Електричні двигуни Презентация по физике "Тепловой двигатель и термодинамика" - скачать
Презентация по физике "Тепловой двигатель и термодинамика" - скачать  Радио. Принцип работы
Радио. Принцип работы Магнитное поле Земли. Выполнили: учащиеся 10 «А» класса Курышев Андрей Чернов Андрей Научные руководители: Шевцов В.Н., кандидат
Магнитное поле Земли. Выполнили: учащиеся 10 «А» класса Курышев Андрей Чернов Андрей Научные руководители: Шевцов В.Н., кандидат  Шаровая молния (8 класс)
Шаровая молния (8 класс) «Теория безэлектродного пробоя Зинера»
«Теория безэлектродного пробоя Зинера»  Синтез нанопроволок, наностержней и нанотрубок неорганических соединений. (Лекция 8)
Синтез нанопроволок, наностержней и нанотрубок неорганических соединений. (Лекция 8) Фотометрия. Спектрофотометрический метод. Фотометрический метод. Метод визуальной колориметрии
Фотометрия. Спектрофотометрический метод. Фотометрический метод. Метод визуальной колориметрии Методы определения динамических характеристик объектов по переходным функциям. Тема 4
Методы определения динамических характеристик объектов по переходным функциям. Тема 4 Процессы изменения состояния термодинамических систем
Процессы изменения состояния термодинамических систем Мощность. Единицы мощности
Мощность. Единицы мощности Вплив магнітного поля на живі організми
Вплив магнітного поля на живі організми Сила тока. Закон Ома для участка цепи. Сопротивление. Последовательное и параллельное соединение проводников
Сила тока. Закон Ома для участка цепи. Сопротивление. Последовательное и параллельное соединение проводников Гидростатика. Основное уравнение гидростатики
Гидростатика. Основное уравнение гидростатики Трансформатор
Трансформатор Допускаемые напряжения
Допускаемые напряжения Сила упругости
Сила упругости Оптические свойства квантоворазмерных гетероструктур
Оптические свойства квантоворазмерных гетероструктур Техническая термодинамика. Термодинамичекие потенциалы. Эффект Джоуля-Томсона. (Лекция 5)
Техническая термодинамика. Термодинамичекие потенциалы. Эффект Джоуля-Томсона. (Лекция 5) Презентация по физике "«Фотоэффект»" - скачать
Презентация по физике "«Фотоэффект»" - скачать  Повреждения и ненормальные режимы работы генераторов. Требования к защитам генераторов
Повреждения и ненормальные режимы работы генераторов. Требования к защитам генераторов