Содержание
- 2. Строение вещества "Молекулярно-кинетическая теория: все тела состоят из атомов и молекул - маленьких частиц, которые находятся
- 3. Краткая история Молекула - мельчайшая частица сложного вещест-ва, атом - мельчайшая частица простого вещества - химического
- 4. Краткая история Окись урана золотистого цвета находили в рудниках две тысячи лет назад. Ее использовали как
- 5. Флуоресценция соединений урана Урансодержащий минерал отенит (водный уранил-ванадат кальция). Слева - при дневном свете, Справа -
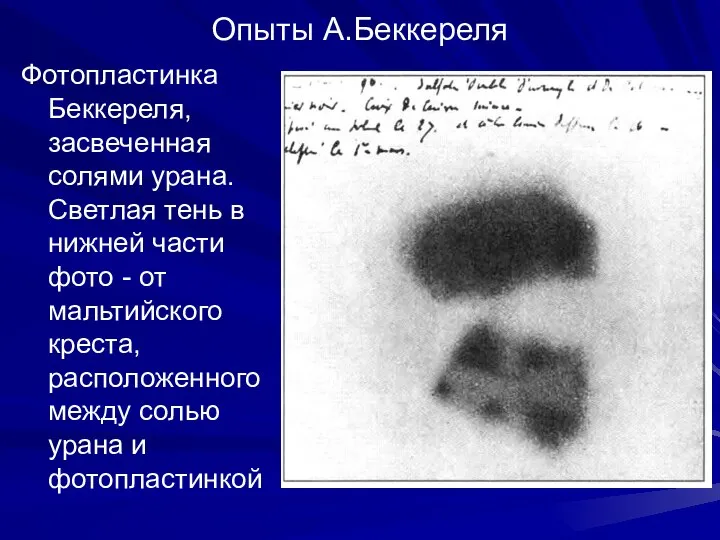
- 6. Опыты А.Беккереля Фотопластинка Беккереля, засвеченная солями урана. Светлая тень в нижней части фото - от мальтийского
- 8. Опыты Э.Резерфорда Э.Резерфорд (Rutherford E.) в результате большого количества экспериментов (1906 - 1920 гг, нобелевская премия
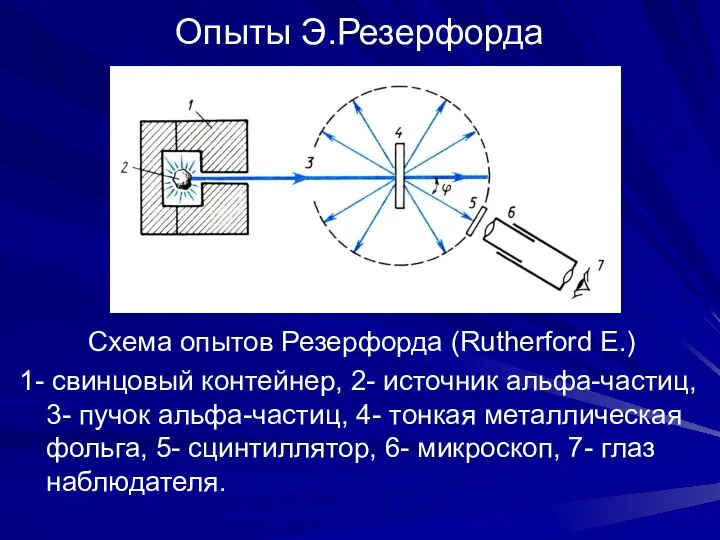
- 9. Опыты Э.Резерфорда Схема опытов Резерфорда (Rutherford E.) 1- свинцовый контейнер, 2- источник альфа-частиц, 3- пучок альфа-частиц,
- 10. Вид установки Резерфорда
- 11. Рассеяние частиц атомными ядрами. О - центр рассеяния (ядро атома). Детектор с площа-дью рабочей поверхности dS
- 12. Количество частиц dN, летящих внутри телесного уг-ла dΩ, и зарегистрированных детектором за еди-ницу времени, равно: dN
- 13. Из формулы (2.1) находим эффективное сечение: (2.2) Разделив обе части формулы (2.2) на dΩ, находим характеристику,
- 14. Иногда удобно обозначить через I поток расходя-щихся от мишени частиц, отнесенный к одному атому мишени: Тогда
- 15. Параметры n1, v1, n2, V могут быть заданы экспери-ментатором, а эффективное сечение dσ, диффе-ренциальное эффективное сечение
- 16. Вернемся к опытам Резерфорда, и изобразим траек-торию какой-либо из альфа-частиц, пролетающей мимо ядра атома мишени, находящегося
- 17. Для этого процесса (упругого рассеяния альфа-час-тиц на ядрах атомов) Э.Резерфорд получил фор-мулу, носящую его имя (формула
- 18. Главный результат опытов Резерфорда. Внутри атома имеется положительно заряженное яд-ро с зарядом +Ze, в котором сосредоточена
- 19. Отсюда следует, что модель атома Томсона (левый рисунок) в которой положительный заряд, подобно мякоти пудинга, распределен
- 20. Другой важнейший результат опытов по рассеянию альфа-частиц был получен позднее, в 1920 году одним из сотрудников
- 22. Скачать презентацию

















 Прикладные методы решения задач строительной механики
Прикладные методы решения задач строительной механики Организация технического обслуживания и ремонта автомобиля Nissan Almera N16
Организация технического обслуживания и ремонта автомобиля Nissan Almera N16 МАНОМЕТРЫ 7 КЛАСС Автор: учитель физики МОУ «СОШ № 1» г. Ивантеевки Гагарина Марианна Сергеевна
МАНОМЕТРЫ 7 КЛАСС Автор: учитель физики МОУ «СОШ № 1» г. Ивантеевки Гагарина Марианна Сергеевна  Магнитная восприимчивость и биомагнетизм
Магнитная восприимчивость и биомагнетизм Електричний заряд. Електричне поле. Закон Кулона
Електричний заряд. Електричне поле. Закон Кулона Ременная передача
Ременная передача Презентация Давление в жидкостях и газах
Презентация Давление в жидкостях и газах Виды теплообмена
Виды теплообмена Закон Всемирного тяготения
Закон Всемирного тяготения Моделирование обтекания вертолёта при взлёте и посадке
Моделирование обтекания вертолёта при взлёте и посадке Изучение микроструктуры процессов релаксации в плазме
Изучение микроструктуры процессов релаксации в плазме Магнитные свойства вещества. Диамагнетики
Магнитные свойства вещества. Диамагнетики Презентация Прямолинейное равноускоренное движение
Презентация Прямолинейное равноускоренное движение Модель флюгерного оконного генератора по вырабатыванию электрического тока
Модель флюгерного оконного генератора по вырабатыванию электрического тока Лабораторная работа №5 «Определение плотности твердого тела» Физика 7 класс Лактионова Надежда Сергеевна
Лабораторная работа №5 «Определение плотности твердого тела» Физика 7 класс Лактионова Надежда Сергеевна Аттестационная работа. Физика в нашей жизни
Аттестационная работа. Физика в нашей жизни Явления тяготения. Сила тяжести
Явления тяготения. Сила тяжести Локальная радиорелейная станция "Стрела-0,45М"
Локальная радиорелейная станция "Стрела-0,45М" Солнечные батареи в космосе
Солнечные батареи в космосе "Всё для фронта, всё для победы!" Вклад отечественной физики в Великую Победу _
"Всё для фронта, всё для победы!" Вклад отечественной физики в Великую Победу _ Спектроскопические методы анализа
Спектроскопические методы анализа Импульс тела. Закон сохранения импульса. Реактивное движение в природе и технике
Импульс тела. Закон сохранения импульса. Реактивное движение в природе и технике Сила тока. Единицы силы тока и её измерение
Сила тока. Единицы силы тока и её измерение Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей
Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей Явления переноса. Понятие о физической кинетике
Явления переноса. Понятие о физической кинетике Презентация по физике "Влияние звуковых и электромагнитных волн на скорость прорастания пшеницы" - скачать
Презентация по физике "Влияние звуковых и электромагнитных волн на скорость прорастания пшеницы" - скачать  Подшипники. Конструкция подшипника скольжения
Подшипники. Конструкция подшипника скольжения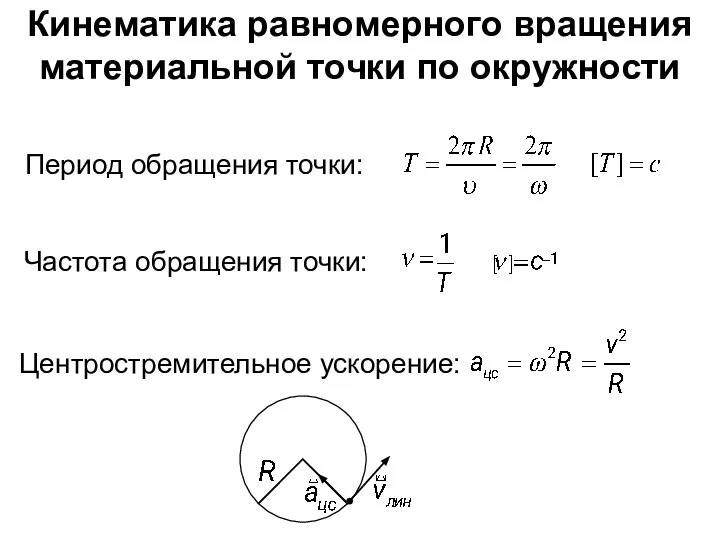 Кинематика равномерного вращения материальной точки по окружности. (Лекция 2)
Кинематика равномерного вращения материальной точки по окружности. (Лекция 2)