В основі молекулярно-кінетичної теорії лежать три основні положення:
Всі речовини - рідкі,
тверді і газоподібні - утворені з найдрібніших частинок - молекул, які самі складаються з атомів. Молекули хімічної речовини можуть бути простими і складними, тобто складатися з одного або декількох атомів. Молекули й атоми являють собою електрично нейтральні частинки. За певних умов молекули й атоми можуть набувати додатковий електричний заряд і перетворюватися на позитивні або негативні іони.
2.Атоми і молекули перебувають у безперервному хаотичному русі.
3.Частинки взаємодіють один з одним силами, що мають електричну природу. Гравітаційна взаємодія між частинками дуже мала.
Основні положення МКТ
(молекулярно-кінетичної теорії)













 Физическая, математическая, аналоговая, биологическая модели процессов. Моделирование. (Лекция 1)
Физическая, математическая, аналоговая, биологическая модели процессов. Моделирование. (Лекция 1) Падение тел. Свободное падение. Ускорение свободного падения и его измерение
Падение тел. Свободное падение. Ускорение свободного падения и его измерение Сила. Явление тяготения. Сила тяжести
Сила. Явление тяготения. Сила тяжести Первый закон термодинамики. Тепловые двигатели и КПД тепловых двигателей
Первый закон термодинамики. Тепловые двигатели и КПД тепловых двигателей Презентация "Теория электролитической диссоциации"
Презентация "Теория электролитической диссоциации" Вплив магнітного поля на живі організми
Вплив магнітного поля на живі організми Стационарное электрическое поле
Стационарное электрическое поле Определение плотности куска хозяйственного мыла
Определение плотности куска хозяйственного мыла Robust non-algebraic Reissner-Mindlin plate finite elements
Robust non-algebraic Reissner-Mindlin plate finite elements Квантовая теория. Свойства операторов и принцип неопределенности Гейзенберга
Квантовая теория. Свойства операторов и принцип неопределенности Гейзенберга Презентация Изопроцессы в газах 10 класс
Презентация Изопроцессы в газах 10 класс  Лекция 6. Моделирование технологических процессов. Окисление, диффузия, сегрегация, силидизация
Лекция 6. Моделирование технологических процессов. Окисление, диффузия, сегрегация, силидизация Закон всемирного тяготения Движение планет
Закон всемирного тяготения Движение планет  Электрический ток в различных средах
Электрический ток в различных средах Исследование термоЭДС, магнетотермоЭДС и электросопротивления в манганите Pr0,65(Ca0,8Sr0,2)0,35MnO3
Исследование термоЭДС, магнетотермоЭДС и электросопротивления в манганите Pr0,65(Ca0,8Sr0,2)0,35MnO3 Вес тела
Вес тела Презентация по теме: «Применение радиоактивных изотопов в медицине»
Презентация по теме: «Применение радиоактивных изотопов в медицине»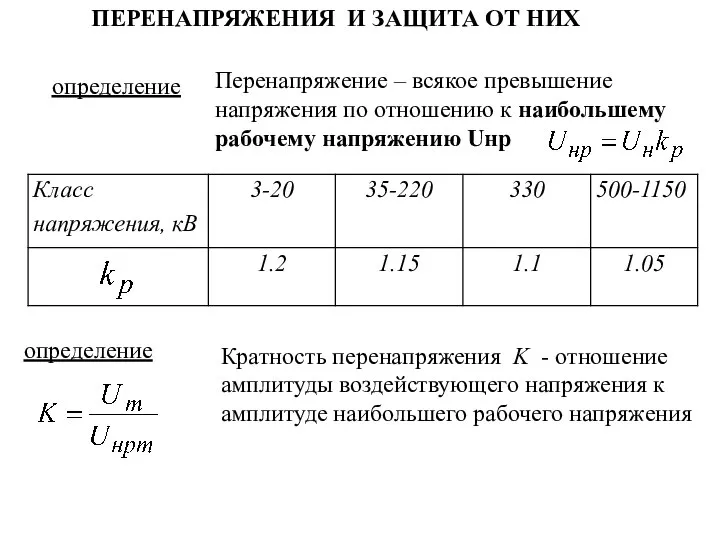 Перенапряжения и защита от них. (Лекция 2.1)
Перенапряжения и защита от них. (Лекция 2.1) Структура и взаимодействие адронов
Структура и взаимодействие адронов Система Jetronic
Система Jetronic Термодинамиканың бірінші заңы. Қайтымды және қайтымсыз процестер. Энтальпия
Термодинамиканың бірінші заңы. Қайтымды және қайтымсыз процестер. Энтальпия Акустический шум и его воздействие на человека МОУ- Средняя общеобразовательная школа № 11 Выполнила ученица 9 «Г»класса Каштано
Акустический шум и его воздействие на человека МОУ- Средняя общеобразовательная школа № 11 Выполнила ученица 9 «Г»класса Каштано Моделирование гидродинамических, тепловых, массобменных процессов в химической технологии
Моделирование гидродинамических, тепловых, массобменных процессов в химической технологии Плазма и её свойства
Плазма и её свойства Кипение. Влажность воздуха. Способы определения влажности воздуха
Кипение. Влажность воздуха. Способы определения влажности воздуха Конструкция дополнительных топливных баков
Конструкция дополнительных топливных баков Газовая хроматография
Газовая хроматография ТЕПЛОМАССОПЕРЕНОС В ЯДЕРНО-ЭНЕРГЕТИЧЕСКИХ УСТАНОВКАХ
ТЕПЛОМАССОПЕРЕНОС В ЯДЕРНО-ЭНЕРГЕТИЧЕСКИХ УСТАНОВКАХ