Содержание
- 3. Микропараметры вещества характеризуют каждую частицу вещества в отдельности, в отличие от макропараметров, характеризующих вещество в целом.
- 4. • Все тела состоят из малых частиц (зернистая структура), между которыми есть промежутки. • Частицы тел
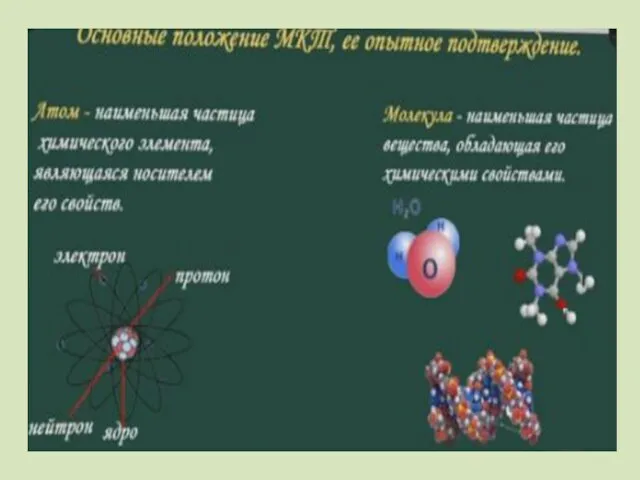
- 7. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, атомов, ионов.
- 8. Доказательства МКТ
- 10. I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
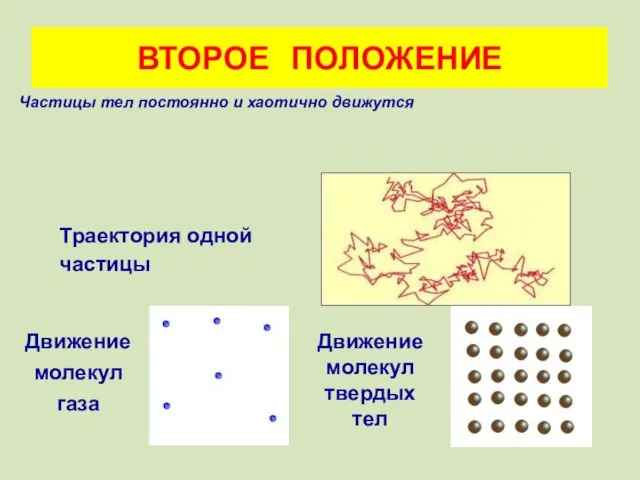
- 11. ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение молекул газа Движение молекул твердых тел Частицы тел постоянно и
- 12. II положение 1. Диффузия – перемешивание молекул разных веществ 2.Броуновское движение – движение взвешенных в жидкости
- 13. Доказательства МКТ
- 16. Диффузия Доказательства МКТ
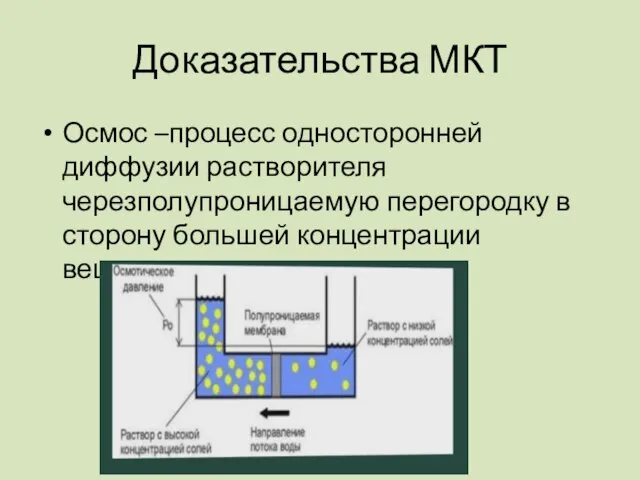
- 17. Осмос –процесс односторонней диффузии растворителя черезполупроницаемую перегородку в сторону большей концентрации вещества Доказательства МКТ
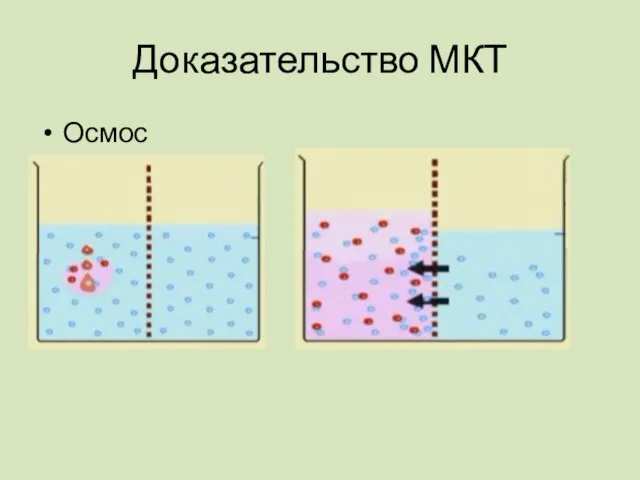
- 18. Доказательство МКТ Осмос
- 19. Доказательство МКТ
- 20. Установите соответствие: 1. Молекулы движутся с огромными скоростями. 2. Тела сохраняют форму и объем. 3. Атомы
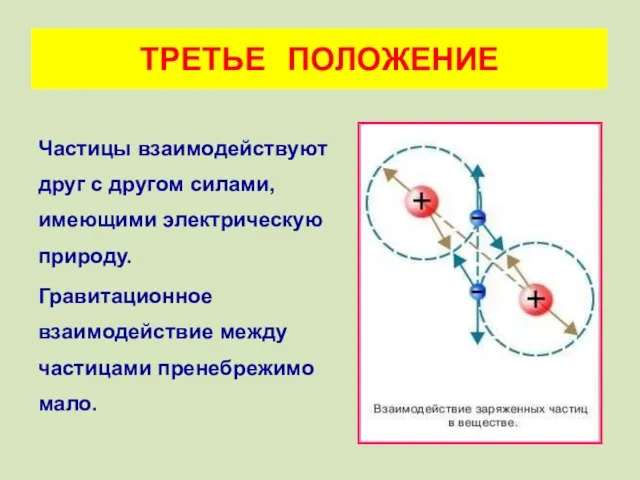
- 21. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало. ТРЕТЬЕ
- 22. III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
- 23. Сцепление свинцовых цилиндров Доказательство МКТ Причина- электромагнитное взаимодействие электронов и ядер соседних молекул.
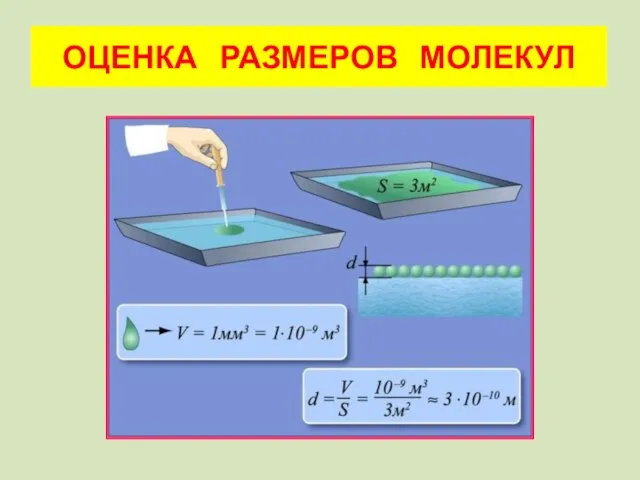
- 24. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
- 25. а) Какими свойствами должна обладать выбранная жидкость? б) Какая геометрическая формула может быть использована? в) Как
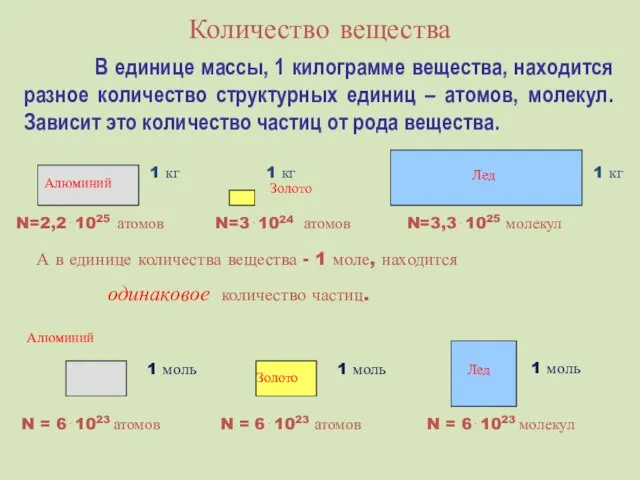
- 26. Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул.
- 27. В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
- 28. Установлено 12 г изотопа углерода-12 содержит 6,02·1023 атомов
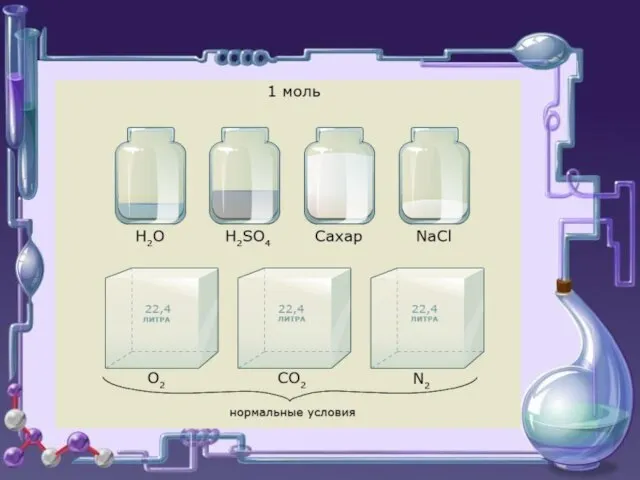
- 29. 1 моль – порция вещества, содержащая число частиц, равное числу Авогадро: NA = 6·1023 моль–1 Все
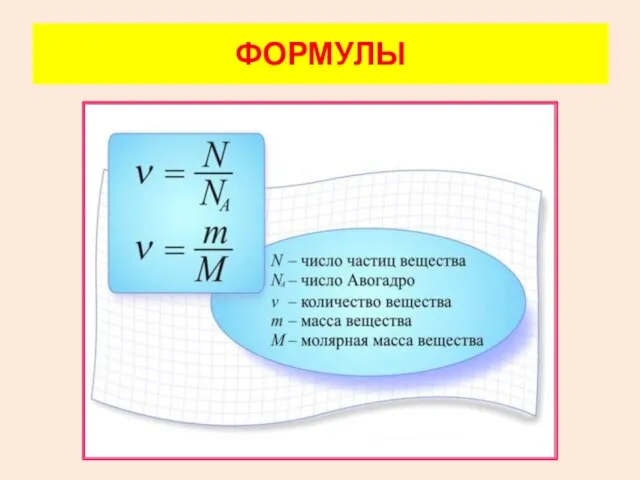
- 30. ФОРМУЛЫ
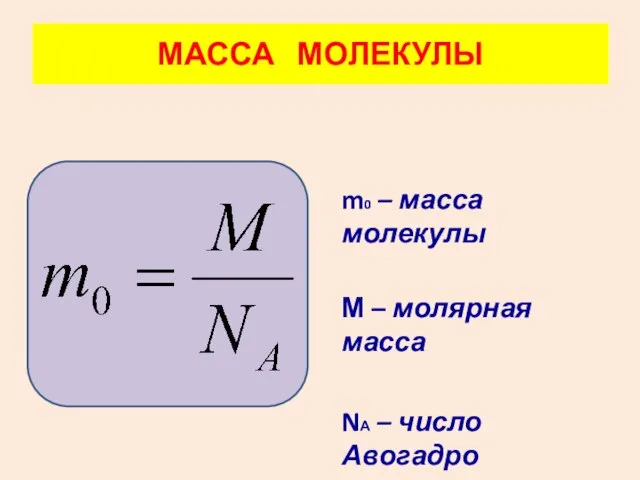
- 32. m0 – масса молекулы М – молярная масса NА – число Авогадро МАССА МОЛЕКУЛЫ
- 33. о о А. Авогадро 1811 Итальянским физик А.Авогадро
- 34. о о Закон Авогадро (для газов) В равных объемах различных газов при одинаковых температуре и давлении
- 35. Следствия (для газов) Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые
- 37. Vm =22,4л/моль Мвозд.=29г/моль NA =6,02*1023 1/моль Константы: М вещества численно равна относительной молекулярной массе.
- 38. 1. Рассчитать массу молекулы Н2SО4. М(Н2SО4) = 2·1 + 32 + 16·4 = 98 г/моль ЗАДАЧИ
- 39. 2. Сколько молекул содержится в 50г Аℓ? М (Аℓ) = 27 г/моль N = νNA ν
- 40. ИДЕАЛЬНЫЙ ГАЗ Известно, что частицы в газах, в отличие от жидкостей и твердых тел, располагаются друг
- 41. Идеальный газ (модель) 1. Совокупность большого числа молекул массой m0, размерами молекул пренебрегают (принимают молекулы за
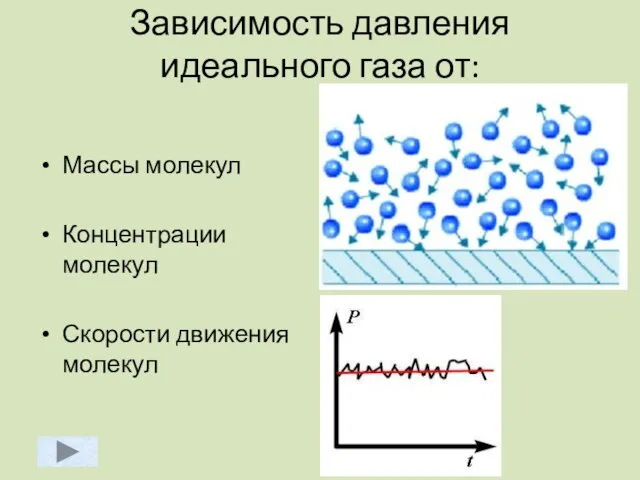
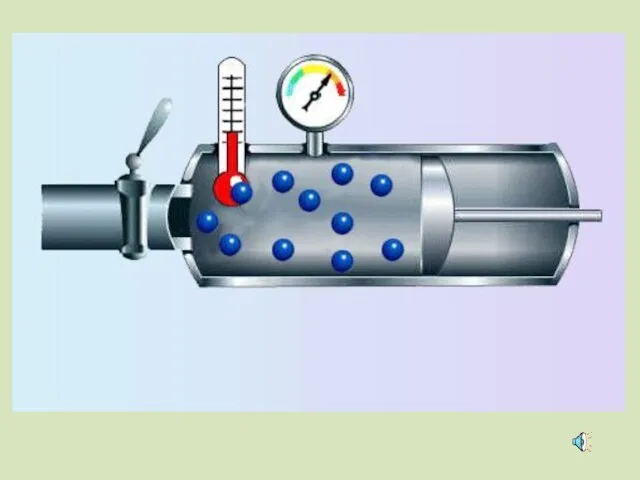
- 43. Зависимость давления идеального газа от: Массы молекул Концентрации молекул Скорости движения молекул
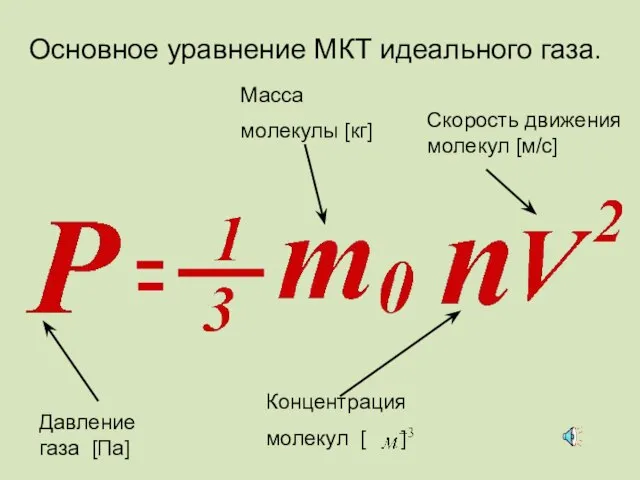
- 48. Основное уравнение МКТ идеального газа.
- 49. Как изменится давление газа на стенки сосуда, если: масса молекулы увеличится в 3 раза концентрация молекул
- 50. Связь давления со средней кинетической энергией
- 52. Средняя кинетическая энергия поступательного движения молекулы
- 53. Связь давления с плотностью газа.
- 54. Задача. №468 Каково давление азота, если средняя квадратичная скорость его молекул 500 м/с, а его плотность
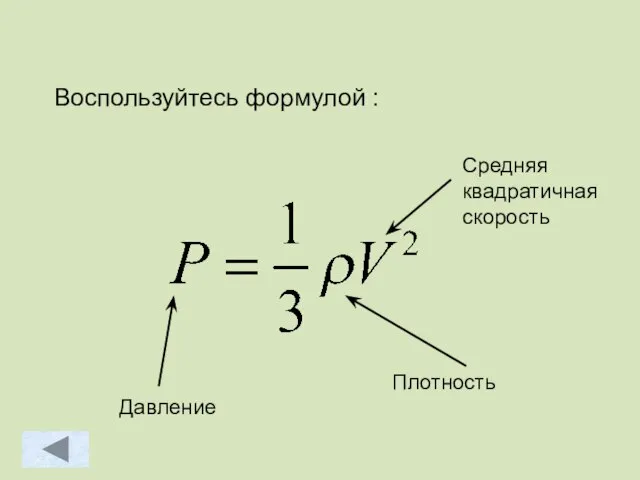
- 55. Воспользуйтесь формулой : Плотность
- 56. Решение: Ответ: 112,5кПа
- 57. Сначала найдите плотность газа по формуле: А потом выразите скорость движения молекул из формулы:
- 58. Решение: Ответ: 707 м/с
- 59. Выучить основные положения МКТ Знать обозначения величин Уметь описать опыт по определению размеров частиц ДОМАШНЕЕ ЗАДАНИЕ
- 61. Скачать презентацию
































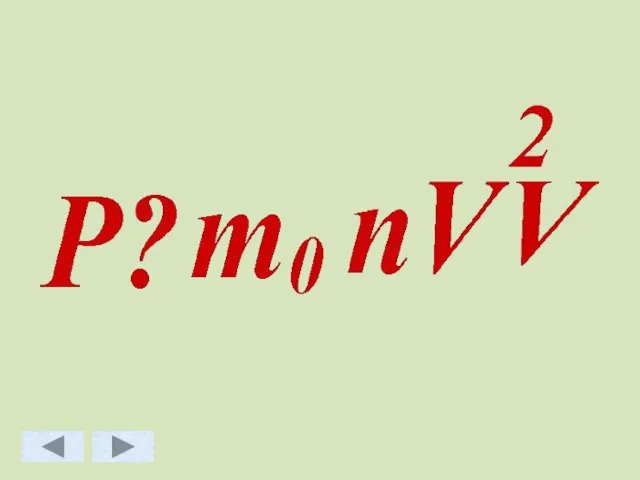



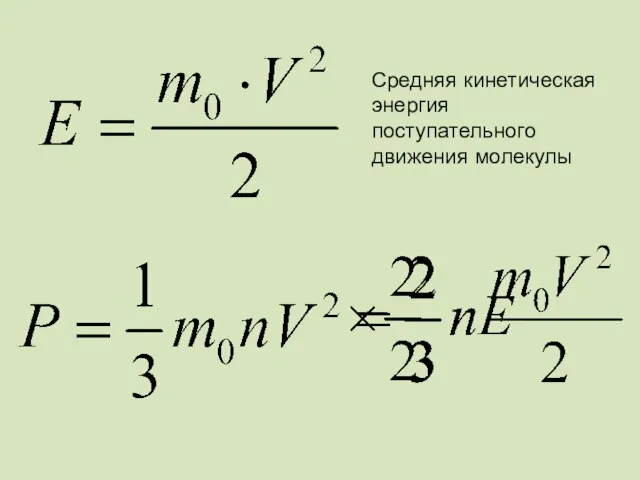






 Пассивные элементы в цепях переменного тока
Пассивные элементы в цепях переменного тока Неразъемные соединения
Неразъемные соединения Притяжение Земли
Притяжение Земли Творческий проект «Вечный двигатель»
Творческий проект «Вечный двигатель» Интерференция света
Интерференция света Көмірдің физикалық қасиеттерін зерттеу әдістері
Көмірдің физикалық қасиеттерін зерттеу әдістері Первый закон термодинамики
Первый закон термодинамики Кинематические точки
Кинематические точки Погрешности измерений
Погрешности измерений Сушка в кипящем слое
Сушка в кипящем слое Инфракрасная спектросокопия
Инфракрасная спектросокопия Специальная теория относительности
Специальная теория относительности Теплообменные процессы и аппараты
Теплообменные процессы и аппараты Гравитациялық өріс. Өріс теориясының элементтері
Гравитациялық өріс. Өріс теориясының элементтері Механизм управления функции блока управления коробкой передач
Механизм управления функции блока управления коробкой передач Презентация по физике Динамика
Презентация по физике Динамика  Первое начало термодинамики
Первое начало термодинамики Задняя подвеска Skoda Octavia A5
Задняя подвеска Skoda Octavia A5 Дифракция света
Дифракция света Ядерные и радиационные технологии на службе здоровья человека. Перспективы развития в УрФО
Ядерные и радиационные технологии на службе здоровья человека. Перспективы развития в УрФО Взаимные превращения жидкостей и газов
Взаимные превращения жидкостей и газов I закон термодинамики
I закон термодинамики Презентация по физике "Альфа- и бета - распад. Правило смещения" - скачать
Презентация по физике "Альфа- и бета - распад. Правило смещения" - скачать  Спектры периодических и непериодических сигналов
Спектры периодических и непериодических сигналов The Hydrostatic Pressure. Pascal's principle. Communicating vessels. Hydraulic рress
The Hydrostatic Pressure. Pascal's principle. Communicating vessels. Hydraulic рress Судоремонтные предприятия
Судоремонтные предприятия Презентация по физике "Закономерности зрительного восприятия формы и пространства" - скачать
Презентация по физике "Закономерности зрительного восприятия формы и пространства" - скачать  Понятие оптики
Понятие оптики