Содержание
- 2. План лекции Работа, теплота, внутренняя энергия. Первое начало термодинамики. Теплоёмкость в различных процессах. Адиабата. Политропа. Процесс
- 3. Первое начало термодинамики – закон сохранения энергии Количество теплоты Q, сообщённое системе, идёт на изменение внутренней
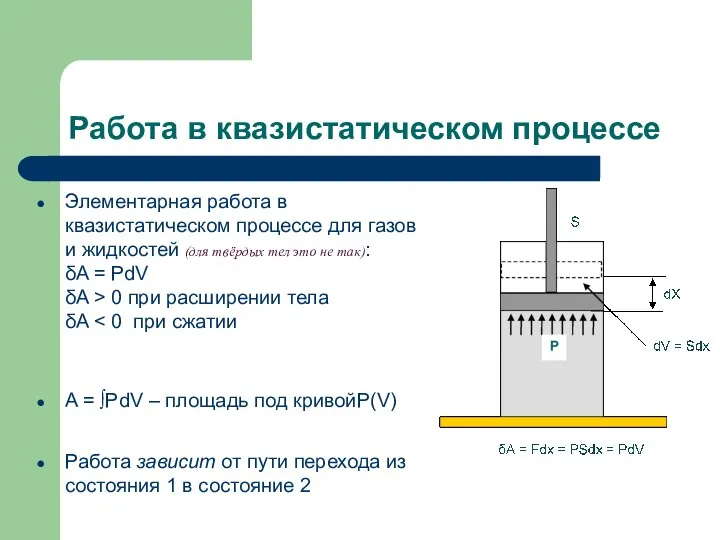
- 4. Работа в квазистатическом процессе Элементарная работа в квазистатическом процессе для газов и жидкостей (для твёрдых тел
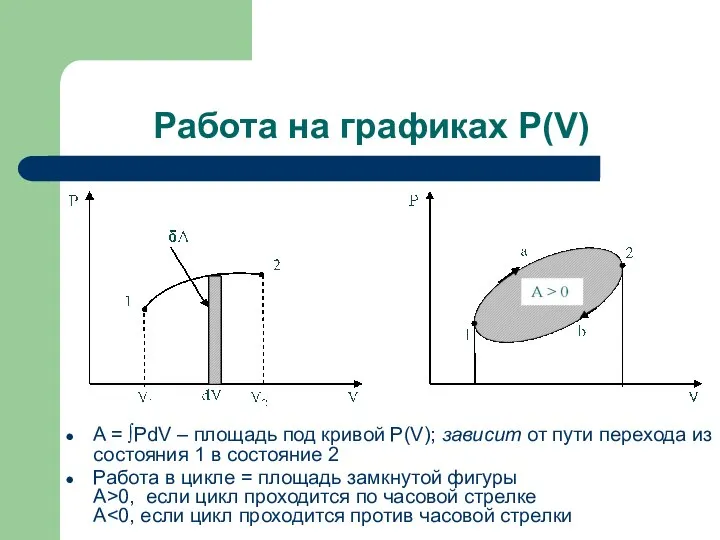
- 5. Работа на графиках P(V) A = ∫PdV – площадь под кривой P(V); зависит от пути перехода
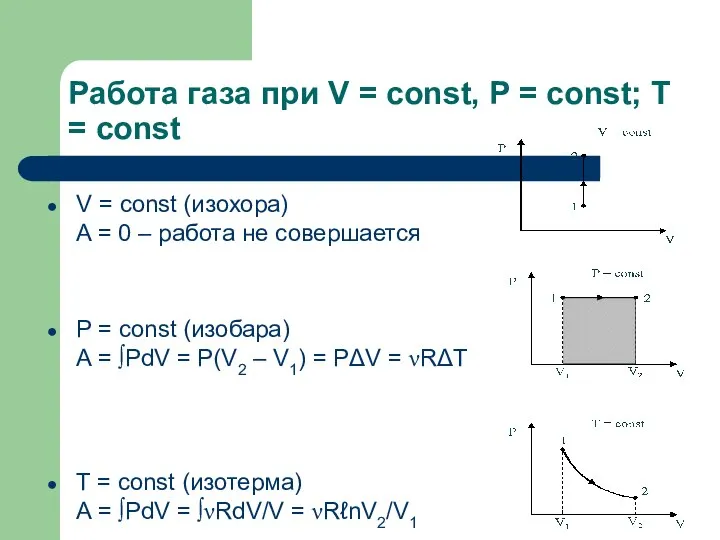
- 6. Работа газа при V = const, P = const; T = const V = const (изохора)
- 7. Теплота и внутренняя энергия Внутренняя энергия U включает: Кинетическую энергию теплового движения атомов и молекул Потенциальную
- 8. Теплоёмкость, общие соотношения Молярная теплоёмкость С – количество теплоты, которое необходимо подвести к одному молю (ν
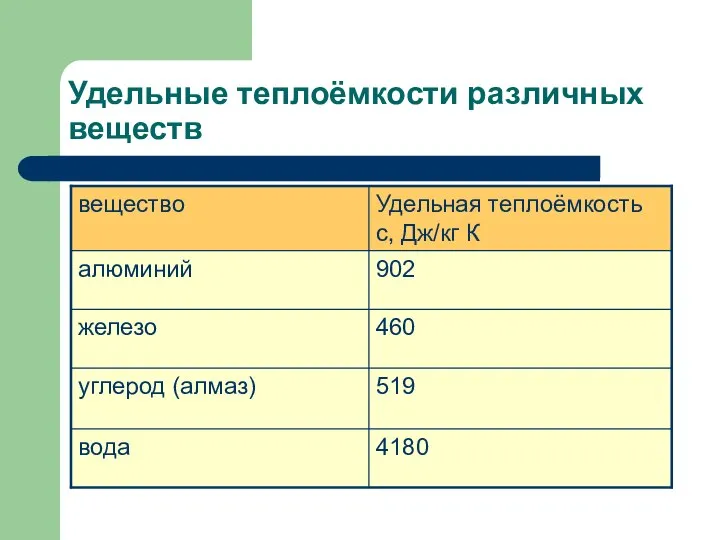
- 9. Удельные теплоёмкости различных веществ
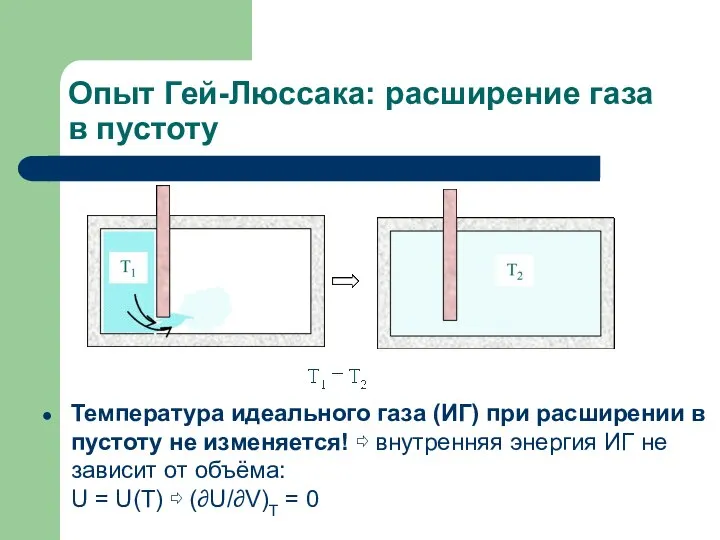
- 10. Опыт Гей-Люссака: расширение газа в пустоту Температура идеального газа (ИГ) при расширении в пустоту не изменяется!
- 11. Теплоёмкость идеального газа Для ИГ (∂U/∂V)T = 0 ⇨ C = (∂U/∂T)V + P(∂V/∂T)process = СV
- 12. Теплоёмкость многоатомного газа. Теорема о равнораспределении энергии по степеням свободы Теорема: на каждую степень свободы молекулы
- 13. Теорема о равнораспределении энергии по степеням свободы. Энергия идеального газа На колебательную степень свободы приходится энергия:
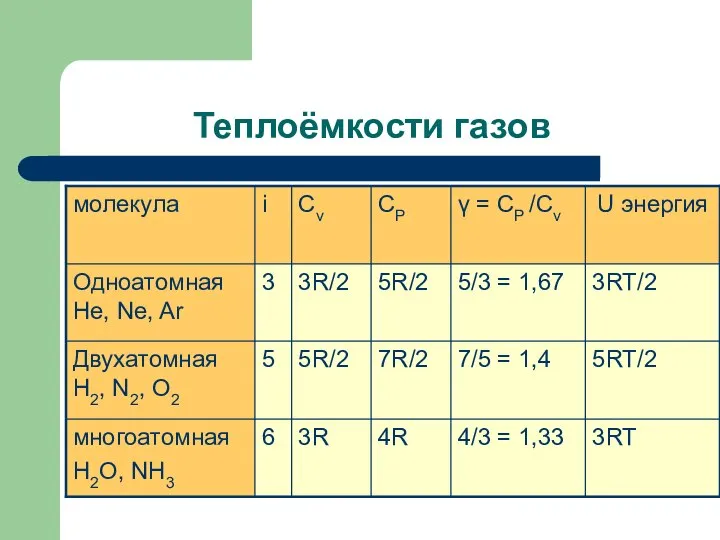
- 14. Теплоёмкости газов
- 15. Адиабатический процесс. Уравнение адиабаты Адиабатическим называется квазистатический процесс, происходящий в теплоизолированной системе (δQ = 0): dU
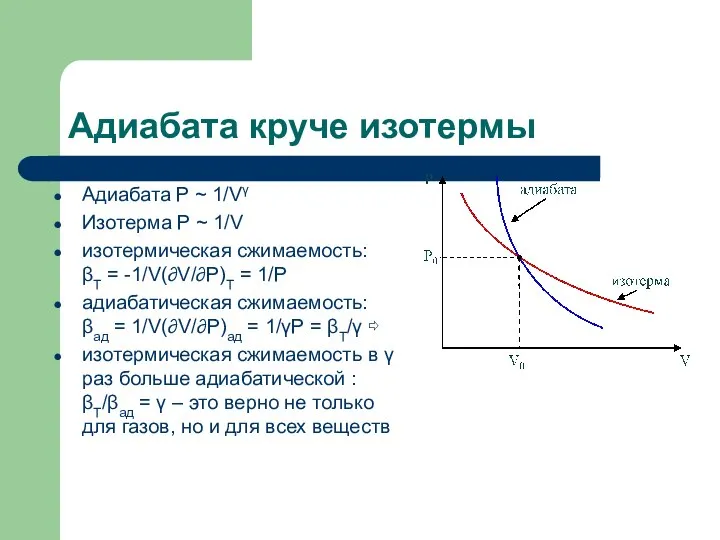
- 16. Адиабата круче изотермы Адиабата P ~ 1/Vγ Изотерма P ~ 1/V изотермическая сжимаемость: βT = -1/V(∂V/∂P)T
- 17. Задача про квазистатическое и неквазистатическое сжатие газа Идеальный газ в мягкой адиабатической оболочке резко сжимают, скачкообразно
- 18. Политропа: С = const CdT = CVdT + PdV = CVdT + RTdV/V ⇨ (C –
- 19. Пример: теплоёмкость в процессе PV2 = const dQ = CdT = dU + PdV = CVdT
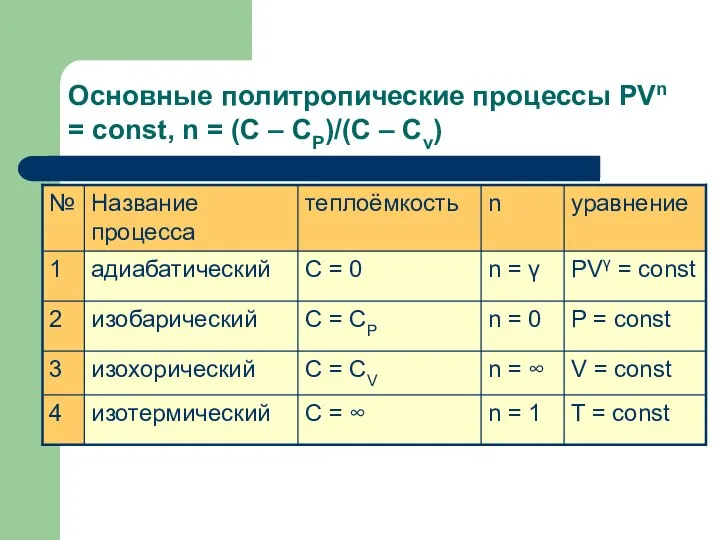
- 20. Основные политропические процессы PVn = const, n = (C – CP)/(C – Cv)
- 21. Дросселирование. Процесс Джоуля-Томсона. Процесс Джоуля-Томсона – это медленное стационарное адиабатическое течение газа через пористую перегородку (пробку)
- 22. Скорость звука в газах Звуковая волна в газе или жидкости – это продольная волна разрежения-уплотнения. Скорость
- 24. Скачать презентацию













 Специальная теория относительности
Специальная теория относительности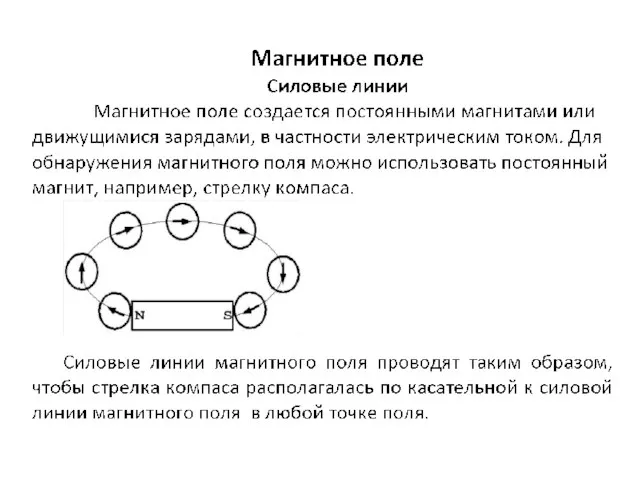 Магнитное поле. Силовые линии
Магнитное поле. Силовые линии Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Напряжение. Единицы напряжения
Напряжение. Единицы напряжения Презентация по физике "Ускорение" - скачать
Презентация по физике "Ускорение" - скачать  Теория Большого Взрыва
Теория Большого Взрыва Гидродинамика. Полная диаграмма циркуляции воды в трубе
Гидродинамика. Полная диаграмма циркуляции воды в трубе Экспериментальные исследования эффективности призыва халявы
Экспериментальные исследования эффективности призыва халявы Поляризация света
Поляризация света Электризация тел при соприкосновении Взаимодействие заряженных тел Два рода зарядов Автор-составитель: Морозова Марина Валенти
Электризация тел при соприкосновении Взаимодействие заряженных тел Два рода зарядов Автор-составитель: Морозова Марина Валенти Измерительные преобразователи систем (датчики)
Измерительные преобразователи систем (датчики) Двигатель инженерной машины разграждения ИМР-2М. Система смазки двигателя В-46
Двигатель инженерной машины разграждения ИМР-2М. Система смазки двигателя В-46 Постоянные магниты
Постоянные магниты Последовательное и параллельное соединения
Последовательное и параллельное соединения Силы в природе
Силы в природе Феноменологическая термодинамика Энтропия и ее статистический смысл. Критическая изотерма. Эффект Джоуля-Томсона. (Лекция 12)
Феноменологическая термодинамика Энтропия и ее статистический смысл. Критическая изотерма. Эффект Джоуля-Томсона. (Лекция 12) Равновесное состояние кристаллической решетки. Фононы. (Лекция 5)
Равновесное состояние кристаллической решетки. Фононы. (Лекция 5) Презентация по физике "Рождение электрон-позитронных пар и поглощение гамма-квантов" - скачать
Презентация по физике "Рождение электрон-позитронных пар и поглощение гамма-квантов" - скачать  Закон Ома для полной цепи
Закон Ома для полной цепи Защита от перенапряжений в электоустановках. (Лекция 16)
Защита от перенапряжений в электоустановках. (Лекция 16) Кристаллические и аморфные тела
Кристаллические и аморфные тела Институт физики Казанского федерального университета
Институт физики Казанского федерального университета Джеймс Клерк Максвелл (1831-1879)
Джеймс Клерк Максвелл (1831-1879) Инерция. Билет 2
Инерция. Билет 2 Жылу және электр энергиясын жинап сақтау
Жылу және электр энергиясын жинап сақтау Максвелл Джеймс Клерк
Максвелл Джеймс Клерк Процессы изменения состояния термодинамических систем
Процессы изменения состояния термодинамических систем Сила трения и ее значение в природе и технике
Сила трения и ее значение в природе и технике