Содержание
- 2. Раскрыть физическое содержание первого закона термодинамики при рассмотрении конкретных изпроцессов , продолжить формирование умений описывать тепловые
- 3. Дать формулировку первого закона термодинамики. Что выражает данный закон? Какие величины связывает данный закон? Как найти
- 4. p V V1 V2 p1 p2 Q>0 T1= T2 Изотермическое расширение V ↑ ⇒ p ↑
- 5. ΔU = 0 При изотермическом расширении все переданное системе количество теплоты идёт только на совершение этой
- 6. p V V2 V1 p2 p1 Q T1= T2 Изотермическое сжатие V ↓ ⇒ p ↑
- 7. ΔU = 0 Внутренняя энергия системы, изотермически сжимающейся под действием внешних сил, не изменяется за счёт
- 8. p V V1 V2 p1=p2 Q>0 T1> T2 Изобарное нагревание (расширение) T ↑ ⇒ V ↑
- 9. При изобарном нагревании (расширении) переданное системе количество теплоты идёт на совершение этой системой механической работы и
- 10. p V V2 V1 p1=p2 Q T2> T1 Изобарное охлаждение (сжатие) T ↓ ⇒ V ↓
- 11. Внутренняя энергия системы, изобарно сжимающейся под действием внешних сил, уменьшается за счёт выделения этой системой теплоты
- 12. Изохорное нагревание p V V1= V2 Q>0 T2> T1 T↑⇒ p↑ T2 >T1 ⇒ ΔT>0 V2
- 13. При изохорном нагревании всё переданное системе количество теплоты идёт только на увеличение внутренней энергии системы. ΔU
- 14. Изохорное охлаждение p V V1= V2 Q T2 T2 V2 =V1 ⇒ ΔV =0 ΔU A′=
- 15. Первый закон термодинамики для изопроцессов Внутренняя энергия системы, изохорно охлаждающейся системы уменьшается только за счёт выделения
- 16. На явлении разогрева газа при его адиабатическом сжатии основано явление пневматического огнива, которое находит применение в
- 17. Адиабатическое же охлаждение газов лежит в основе процесса их сжижения. Адиабатный процесс
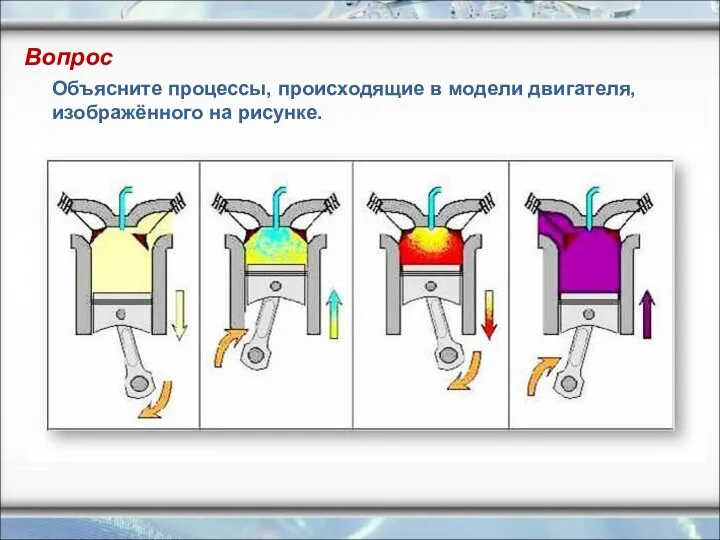
- 18. В дизельных двигателях отсутствует система зажигания. В цилиндр засасывается атмосферный воздух, а к концу такта сжатия
- 19. Вопрос Объясните процессы, происходящие в модели двигателя, изображённого на рисунке.
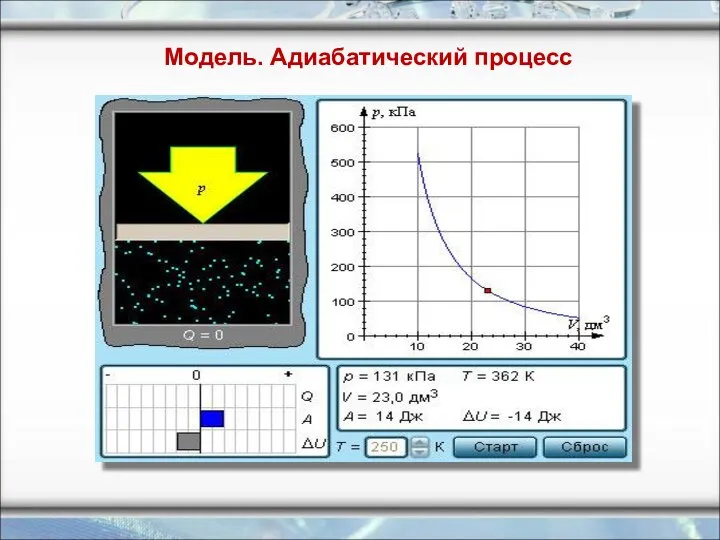
- 20. Модель. Адиабатический процесс
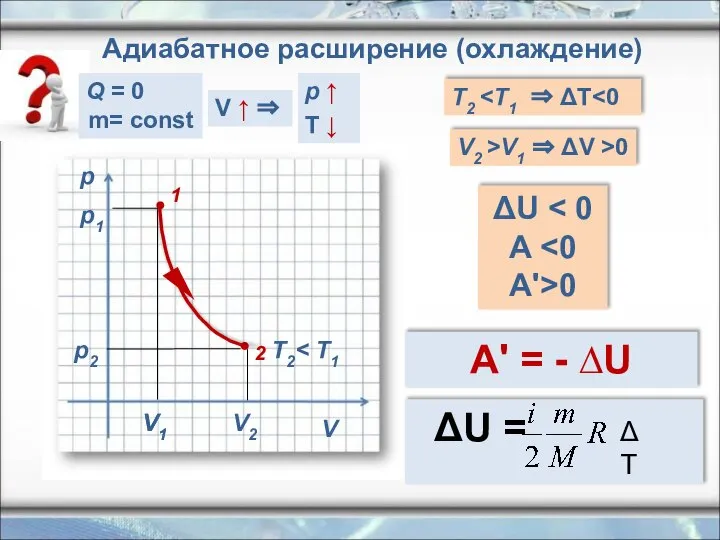
- 21. p V V1 T2 T2 V2 >V1 ⇒ ΔV >0 ΔU A 0 A' = -
- 22. Первый закон термодинамики для изопроцессов При адибатном расширении система совершает механическую работу только за счёт уменьшения
- 23. p V T2 T2 >T1 ⇒ ΔT>0 V2 ΔU > 0 A >0 A' ∆U =
- 24. Первый закон термодинамики для изопроцессов Внутренняя энергия адиабатно сжимающейся системы увеличивается только за счёт работы внешних
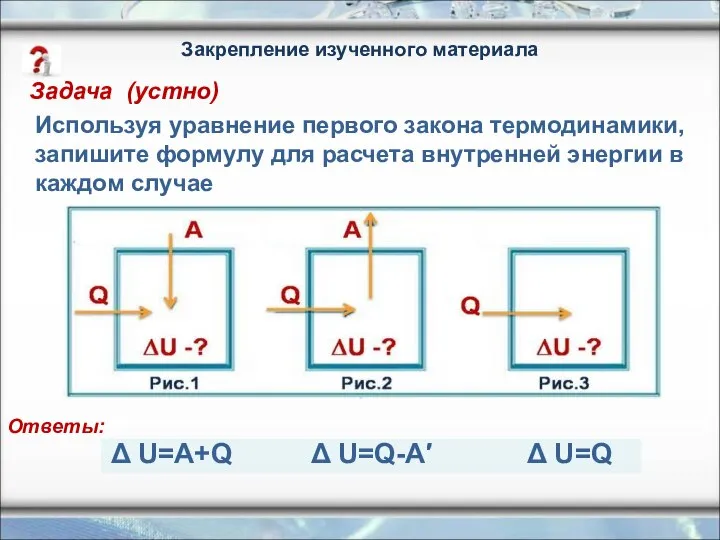
- 25. Используя уравнение первого закона термодинамики, запишите формулу для расчета внутренней энергии в каждом случае Δ U=A+Q
- 26. Задачи (у доски) 2. При изобарном нагревании объём гелия увеличился в 3 раза. Какую работу совершил
- 27. Оцените сегодняшний урок: 0 – нет, 1 – да. Количество баллов________ Рефлесия (карточка с таблицей у
- 29. Скачать презентацию






















 Электропроводность биологических тканей на постоянном токе
Электропроводность биологических тканей на постоянном токе РІВНЯННЯ СТАНУ ІДЕАЛЬНОҐО ГАЗУ. ГАЗОВІ ЗАКОНИ
РІВНЯННЯ СТАНУ ІДЕАЛЬНОҐО ГАЗУ. ГАЗОВІ ЗАКОНИ  Естественные и искусственные изотопы. Способы получения изотопов для медицинских целей
Естественные и искусственные изотопы. Способы получения изотопов для медицинских целей Разработка методического пособия по подготовке учащихся 9 класса к сдаче экзамена по физике в формате ОГЭ
Разработка методического пособия по подготовке учащихся 9 класса к сдаче экзамена по физике в формате ОГЭ Радіоактивність. Прилад для вимірювання радіоактивності-дозиметр
Радіоактивність. Прилад для вимірювання радіоактивності-дозиметр Плотность вещества
Плотность вещества Построение и эксплуатация станционных, перегонных, микропроцессорных и диагностических систем железнодорожной автоматики
Построение и эксплуатация станционных, перегонных, микропроцессорных и диагностических систем железнодорожной автоматики История открытия атмосферного давления
История открытия атмосферного давления Устройство и техническое обслуживание системы охлаждения, смазочной системы дизельного двигателя
Устройство и техническое обслуживание системы охлаждения, смазочной системы дизельного двигателя Определение твердости
Определение твердости Законы Ньютона
Законы Ньютона Физические основы радиоактивности
Физические основы радиоактивности Аттестационная работа. Программа элективного курса Физика вокруг нас
Аттестационная работа. Программа элективного курса Физика вокруг нас Энергетический обмен
Энергетический обмен Тормозной путь
Тормозной путь Приготовление растворов с определённой массовой долей растворённого вещества
Приготовление растворов с определённой массовой долей растворённого вещества Основы трибологии
Основы трибологии 1курс лекций по молекулярной физике и термодинамике. Тема 1. Молекулярно- кинетическая теория 1.1
1курс лекций по молекулярной физике и термодинамике. Тема 1. Молекулярно- кинетическая теория 1.1 Фізичні основи функціонування систем радіолокації та радіонавігації
Фізичні основи функціонування систем радіолокації та радіонавігації Спостереження фізичних явищ довкілля
Спостереження фізичних явищ довкілля Адсорбционные явления в гетерогенных каталитических процессах. (Тема 5.4.1)
Адсорбционные явления в гетерогенных каталитических процессах. (Тема 5.4.1) Control of nonlinear dynamics of electromechanical systems
Control of nonlinear dynamics of electromechanical systems Магнитное поле и его графическое изображение
Магнитное поле и его графическое изображение Трансформатор
Трансформатор The adequacy of analysis of linear periodically-time-variable circuits by the frequency symbolic method in the time domain
The adequacy of analysis of linear periodically-time-variable circuits by the frequency symbolic method in the time domain Внутренняя энергия. Термодинамика
Внутренняя энергия. Термодинамика Презентация Механика Ньютона
Презентация Механика Ньютона Природа и эволюция звезд
Природа и эволюция звезд