Содержание
- 2. При изучении термодинамических процессов определяются: 1) закономерность изменения параметров состояния рабочего тела, то есть выводится уравнение
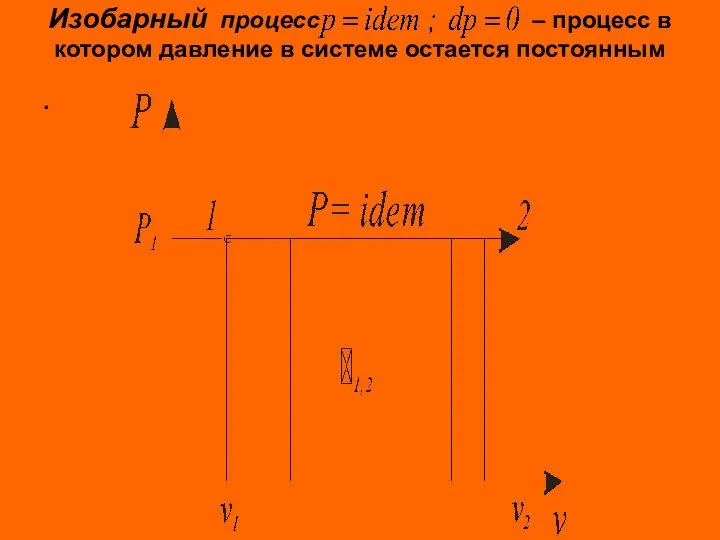
- 3. Изобарный процесс – процесс в котором давление в системе остается постоянным .
- 4. Изобарные процессы подвода или отвода теплоты происходят в поршневых двигателях внутреннего сгорания, газотурбинных, паросиловых, холодильных установках
- 5. Для идеального газа Количество теплоты, подведенной к рабочему телу или отведенной от него в изобарном процессе,
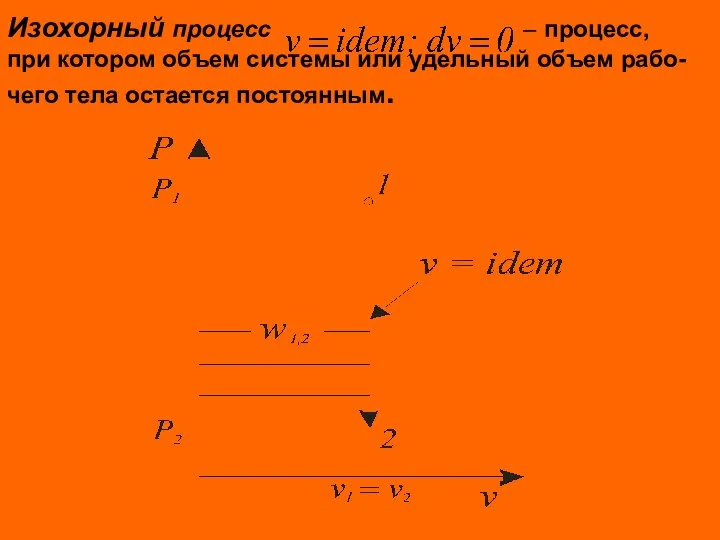
- 6. Изохорный процесс – процесс, при котором объем системы или удельный объем рабо- чего тела остается постоянным.
- 7. В изохорных процессах происходит увеличение или уменьшение давления, что связано с соответствен – ным изменением температуры
- 8. Удельная термодинамическая и потенциальная работы в изохорном процессе определяются из соотно- шений Для идеального газа Количество
- 9. Для идеального газа Изопотенциальный процесс – термодинамический процесс изменения состояния системы, при котором значение потенциальной функции
- 10. Для идеального газа, согласно уравнению Клапейрона изопотенциальный процесс является и изотермическим . Удельная термодинамическая и потенциальная
- 11. Нетрудно заметить, что постоянство приводит к условию Поэтому, в изопотенциальном процессе численные значения термодинамической и потенциальной
- 12. Для идеального газа pv=RT=idem (изотермический) Количество теплоты, подведенной к рабочему телу или отведенной от него в
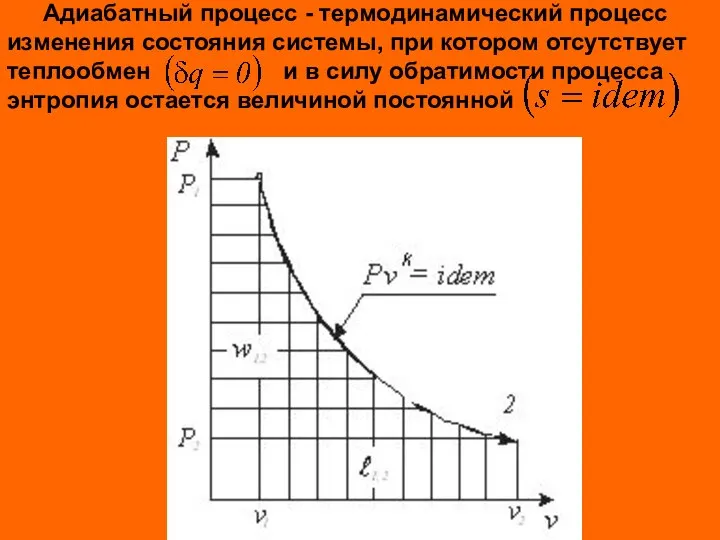
- 13. Адиабатный процесс - термодинамический процесс изменения состояния системы, при котором отсутствует теплообмен и в силу обратимости
- 14. Из выражения первого начала термодинамики для простого тела при условии имеем Отсюда следует выражение для показателя
- 15. После интегрирования при условия постоянства показателя процесса имеем Для идеального газа показатель адиабаты равен k= cp/cv
- 16. Из уравнения адиабатного процесса получим выражение для связи параметров состояния потенцируя имеем
- 17. Выражения конечных (интегральных) величин термодинамической и потенциальных работа в адиабат- ном процесс можно получить при сопоставлении
- 18. Интегрируя последнее выражение с учетом того, что k=idem, получим интегрального уравнения термодинамической работы Введем понятие характеристики
- 19. Окончательно имеем уравнения для определения термодинамической и потенциальной работы Различные уравнения для определения характе- ристики расширения
- 20. Применительно для идеального газа имеем:
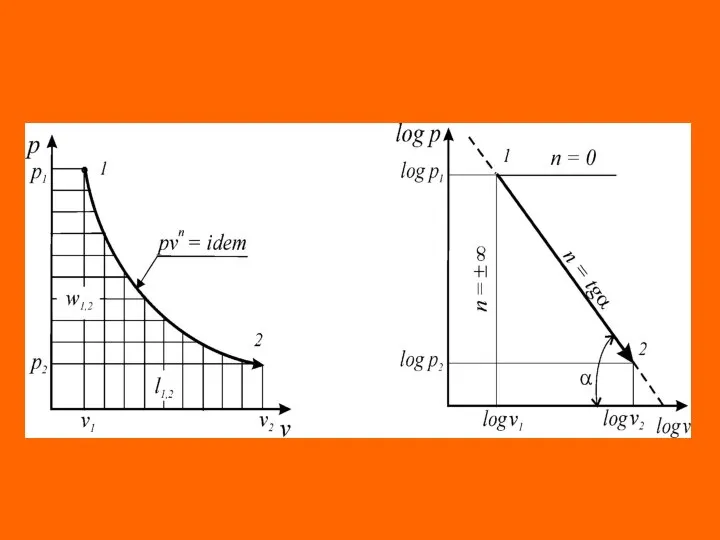
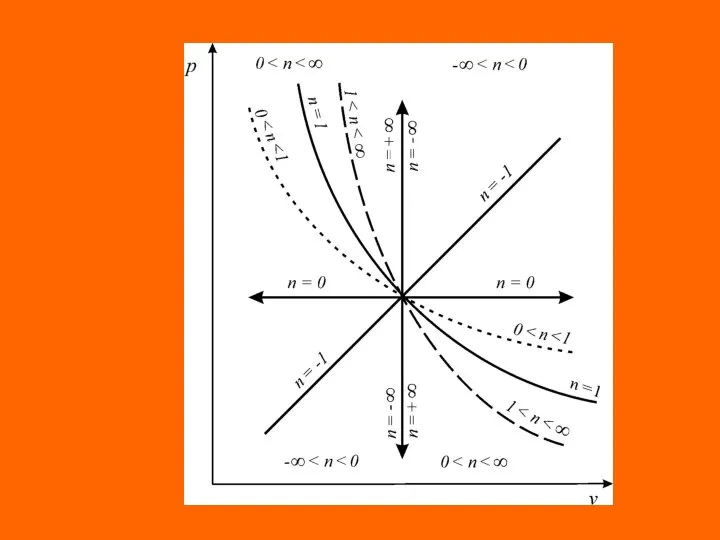
- 21. Уравнения перечисленных простейших и любых других термодинамических процессов могут быть представлены одним уравнением. Это уравнение назы-
- 22. где п – показатель политропы, являющий в рассматриваемом процессе постоянной величиной, которая может иметь любые частные
- 24. Это значит, что постоянный показатель политропы определяется соотношением потенциальной и термодинамической работ в элементарном или конечном
- 25. Из соотношения показателя политропи следует, что для изобарного процесса , для изохорного процесса nv = ±
- 26. Работа в политропных процессах Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политро- пных процессах
- 27. Теплообмен в политропном процессе для простых тел выводится также на основе рассмотрения выражения первого начала термодинамики
- 28. Введем следующие обозначения: При этом выражение примет вид: Подставив полученное уравнение в выражение первого начала термодинамики
- 29. Для определения величин ( и ) рассмотрим два термодинамических процесса: Изоэнергетический процесс (u = idem, du
- 30. С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения
- 33. Скачать презентацию

























 Влияние колебаний напряжения на работу силовых элементов и автоматических устройств, технологических установок
Влияние колебаний напряжения на работу силовых элементов и автоматических устройств, технологических установок Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Механика и мы
Механика и мы Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока
Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока Манометры
Манометры Относительность движения
Относительность движения Сравнение выхода 99Mo активационным методом на спектрах промышленных реакторов
Сравнение выхода 99Mo активационным методом на спектрах промышленных реакторов Электростатика. Электродинамика
Электростатика. Электродинамика Оптика полупроводников
Оптика полупроводников Презентация по физике "М-спектры" - скачать бесплатно
Презентация по физике "М-спектры" - скачать бесплатно Клистрон ЭМ-31 Аксенов О.
Клистрон ЭМ-31 Аксенов О. Презентация по физике "Технология формирования слоистых структур феррит-сегнетоэлектрик" - скачать
Презентация по физике "Технология формирования слоистых структур феррит-сегнетоэлектрик" - скачать  Червячные передачи
Червячные передачи Закон Джоуля - Ленца
Закон Джоуля - Ленца Изобретения радио А. С. Поповым
Изобретения радио А. С. Поповым Спектры землетрясений. Расчёт сооружений на сейсмостойкость
Спектры землетрясений. Расчёт сооружений на сейсмостойкость Вес воздуха. Атмосферное давление
Вес воздуха. Атмосферное давление Ядерные реакции и их воздействия
Ядерные реакции и их воздействия Аттестационная работа. Эссэ Исследовательская работа учащихся на уроках физики
Аттестационная работа. Эссэ Исследовательская работа учащихся на уроках физики Движение в неинерциальной системе отсчета
Движение в неинерциальной системе отсчета Технология рентгеновских трубок. (Лекция 6)
Технология рентгеновских трубок. (Лекция 6) Презентация по физике "Никола Тесла" - скачать бесплатно
Презентация по физике "Никола Тесла" - скачать бесплатно Корреляционный лаг
Корреляционный лаг Ядерний реактор Будова та принцип дії
Ядерний реактор Будова та принцип дії  Термоэлектрические явления и их применение
Термоэлектрические явления и их применение Car body
Car body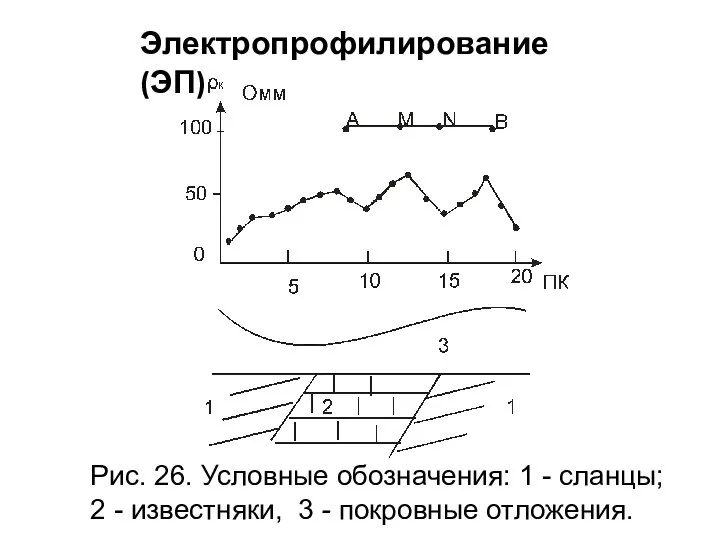 Презентация по физике "ЭЛЕКТРОРАЗВЕДКА" - скачать
Презентация по физике "ЭЛЕКТРОРАЗВЕДКА" - скачать  Изобретение радио А.С. Поповым
Изобретение радио А.С. Поповым