Содержание
- 2. I. Модель реального газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса Модель реального газа (в отличие от идеального газа): Молекулы
- 3. n — концентрация молекул Уравнение Ван-дер-Ваальса (уравнение состояния реального газа): a и b — постоянные Ван-дер-Ваальса
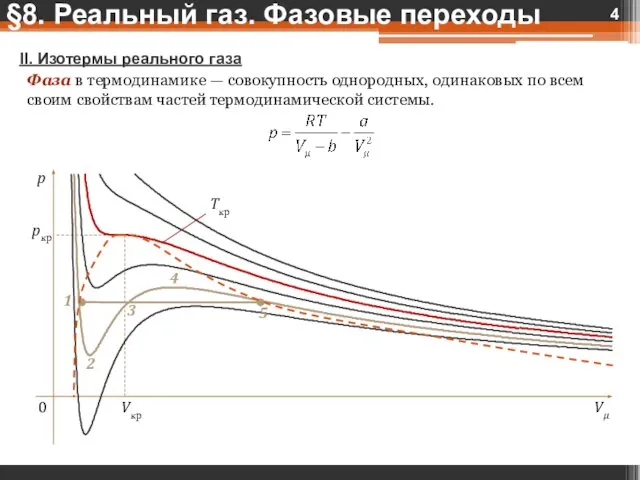
- 4. II. Изотермы реального газа Фаза в термодинамике — совокупность однородных, одинаковых по всем своим свойствам частей
- 5. Критическая изотерма имеет горизонтальный перегиб. 1-5 — насыщенный пар — газ, находящийся в термодинамическом равновесии со
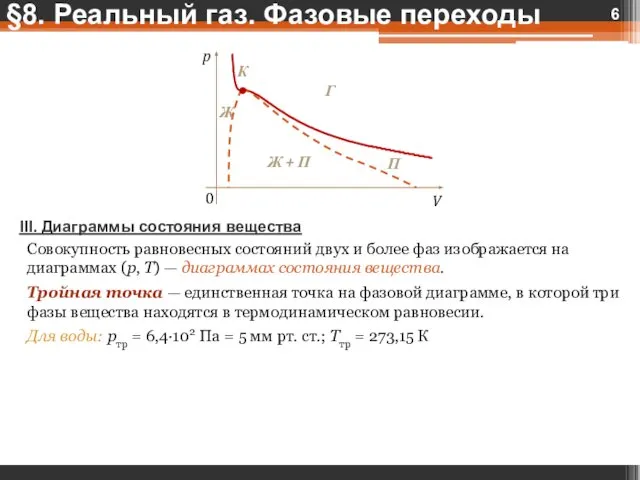
- 6. III. Диаграммы состояния вещества Совокупность равновесных состояний двух и более фаз изображается на диаграммах (p, T)
- 7. §8. Реальный газ. Фазовые переходы
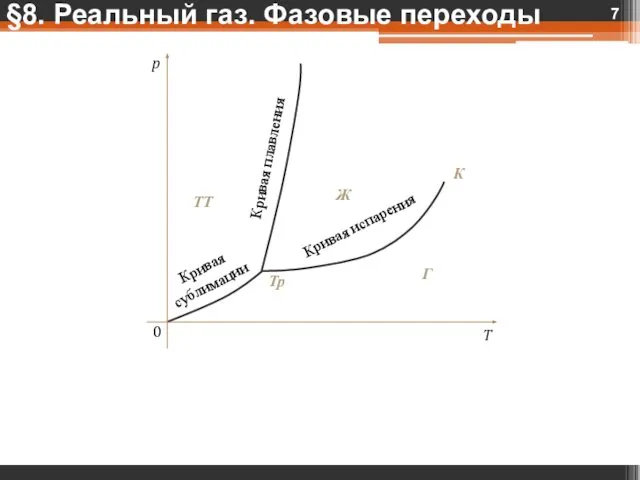
- 8. IV. Фазовые переходы Фазовой переход — ФЯ — переход вещества от одной фазы к другой. §8.
- 10. Скачать презентацию




 Тепловые явления
Тепловые явления Шкала электромагнитных излучений
Шкала электромагнитных излучений Азбука великих имен
Азбука великих имен Второе начало термодинамики. Энтропия
Второе начало термодинамики. Энтропия Элементы машиноведения. Составные части машин
Элементы машиноведения. Составные части машин Польза и вред атомной энергетики
Польза и вред атомной энергетики  Феномен динамического хаоса
Феномен динамического хаоса Презентация по физике "ТОК В ПОЛУПРОВОДНИКАХ" - скачать
Презентация по физике "ТОК В ПОЛУПРОВОДНИКАХ" - скачать  Радиолокация
Радиолокация Законы преломления и отражения света
Законы преломления и отражения света Закон всемирного тяготения
Закон всемирного тяготения Свободные и вынужденные колебания системы с одной степенью свободы
Свободные и вынужденные колебания системы с одной степенью свободы Ядерное оружие
Ядерное оружие Динамика вращательного движения
Динамика вращательного движения Основы термодинамики
Основы термодинамики Конкурс презентаций. Pedsovet.su Кашаева Ольга Викторовна учитель физики 7-11 классов в МОУ СОШ с.Неверкино,
Конкурс презентаций. Pedsovet.su Кашаева Ольга Викторовна учитель физики 7-11 классов в МОУ СОШ с.Неверкино,  Теплопередача. Тепловые процессы
Теплопередача. Тепловые процессы Презентация по физике "Электрический ток в жидкостях" - скачать бесплатно
Презентация по физике "Электрический ток в жидкостях" - скачать бесплатно Техническая термодинамика
Техническая термодинамика Температура. Тепловое равновесие
Температура. Тепловое равновесие Фазированные антенные решетки и их назначение. Задача адаптации в общем виде
Фазированные антенные решетки и их назначение. Задача адаптации в общем виде Изобретение радио. Принципы радиосвязи. Телевидение
Изобретение радио. Принципы радиосвязи. Телевидение Физическая, математическая, аналоговая, биологическая модели процессов. Моделирование. (Лекция 1)
Физическая, математическая, аналоговая, биологическая модели процессов. Моделирование. (Лекция 1) Явища природи. Фізичні явища, їх різноманітність. (Урок 11)
Явища природи. Фізичні явища, їх різноманітність. (Урок 11) Короткое замыкание. Плавкие предохранители. Выполнила: Мирабова Ирина.
Короткое замыкание. Плавкие предохранители. Выполнила: Мирабова Ирина. Электроны. История открытия.
Электроны. История открытия. Внутренняя энергия. Первый закон термодинамики
Внутренняя энергия. Первый закон термодинамики Лекция 8. Общая физика. Элементы квантовой механики
Лекция 8. Общая физика. Элементы квантовой механики