Содержание
- 2. Содержание Строение атома азота. Образование молекулы аммиака. Строение молекулы аммиака. Физические свойства. Способы получения аммиака. Химические
- 3. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 7N II период V группа
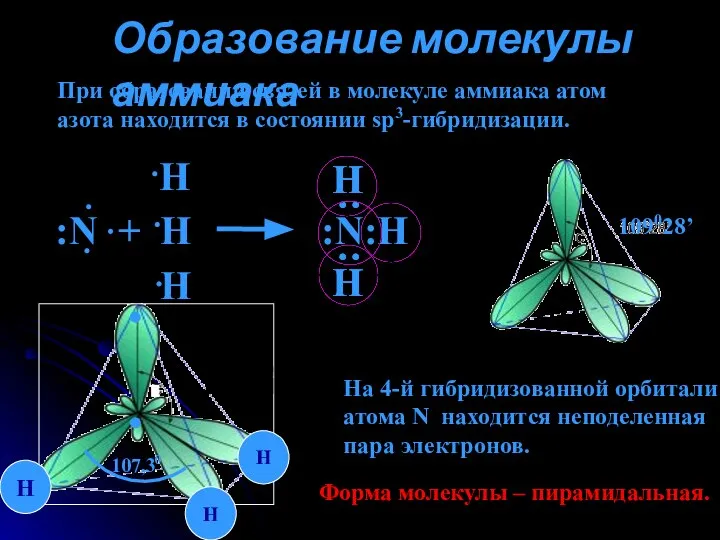
- 4. Образование молекулы аммиака При образовании связей в молекуле аммиака атом азота находится в состоянии sp3-гибридизации. 109028’
- 5. Строение молекул аммиака Между молекулами аммиака образуются водородные связи: Связи N-H полярные, молекула имеет пирамидальную форму,
- 6. Физические свойства аммиака Бесцветный газ с резким запахом. Почти в два раза легче воздуха: При охлаждении
- 7. Способы получения аммиака В промышленности: N2 + 3H2 2NH3 Реакция проводится при нагревании, под давлением, в
- 8. Химические свойства аммиака NH3 – низшая степень окисления азота. -3 1. Аммиак - восстановитель Реакция горения
- 9. II. Основные свойства аммиака: При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует: NH3 +
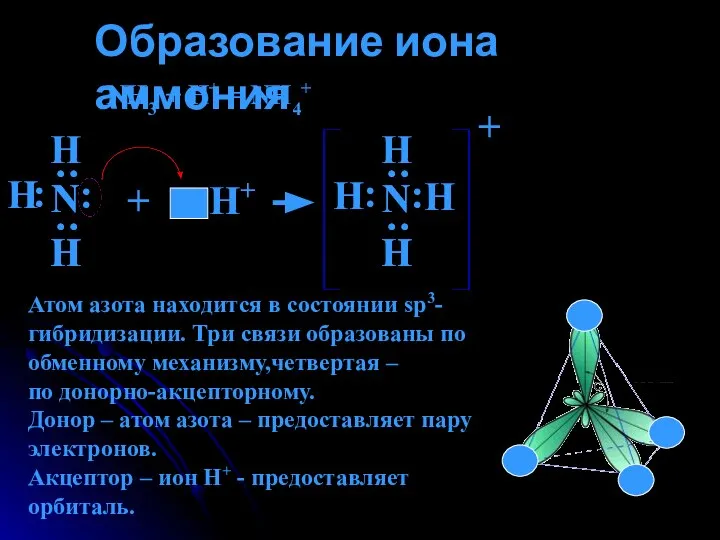
- 10. Образование иона аммония NH3 + H+ = NH4+ Н : : Н Н : : Н
- 11. Соли аммония Ион аммония по размерам и заряду близок к ионам щелочных металлов, поэтому соли аммония
- 12. Разложение солей аммония при нагревании Соли летучих кислот: NH4ClCl = Cl = NH3 + HCl (NH4)2CO3
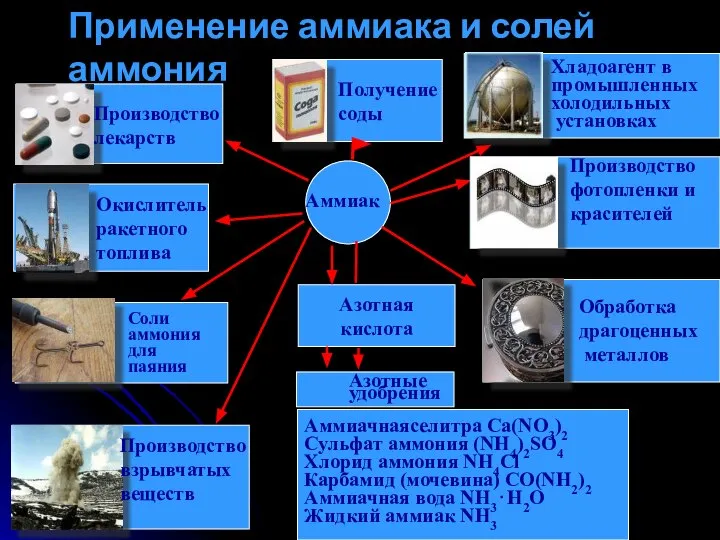
- 13. Азотная кислота Аммиачнаяселитра Ca(NO3)2 Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиачная вода NH3⋅H2O
- 15. Скачать презентацию









 Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Конкурс проектных работ «Химический элемент … – и это все о нем»
Конкурс проектных работ «Химический элемент … – и это все о нем» Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу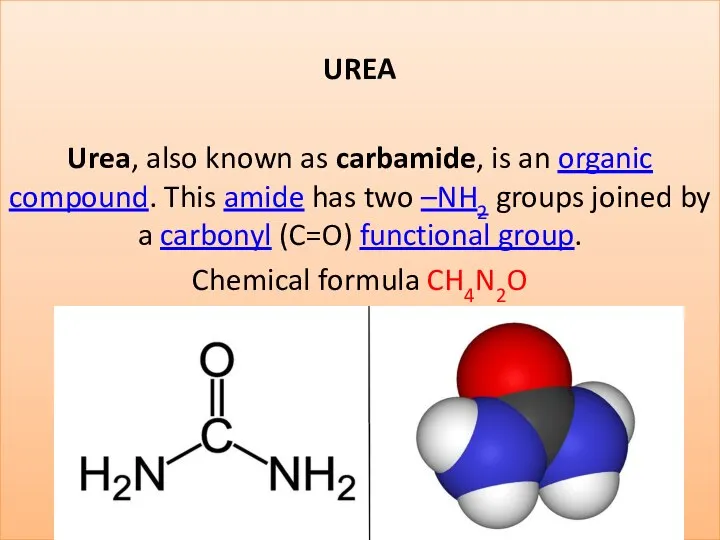 Urea (carbamide)
Urea (carbamide) Процессы минералообразования
Процессы минералообразования Предельные одноатомные спирты
Предельные одноатомные спирты  Занимательные опыты по химии
Занимательные опыты по химии Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама
Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2)
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2) Дифференциация магмы
Дифференциация магмы Элементы кристаллохимии
Элементы кристаллохимии Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1
Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1 “B” (бор) как химический элемент
“B” (бор) как химический элемент Металлы в природе
Металлы в природе Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Термохимия. Расчетные задачи. (Лекция 4.2)
Термохимия. Расчетные задачи. (Лекция 4.2)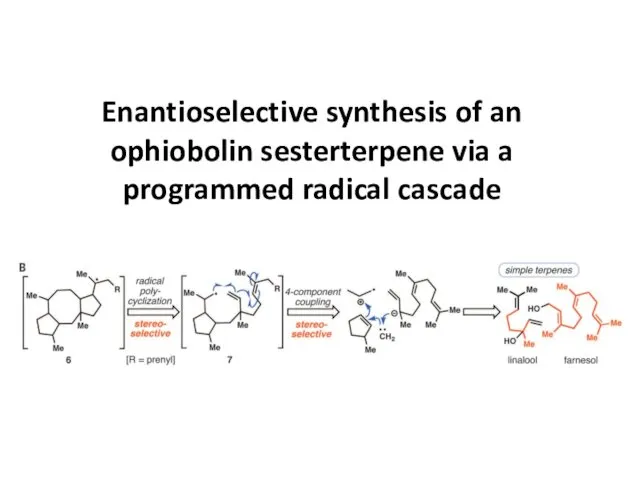 Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade
Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade Металлы и их соединения
Металлы и их соединения Введение в термические процессы вторичной переработки нефти
Введение в термические процессы вторичной переработки нефти Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль
Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль Жидкостная хроматография
Жидкостная хроматография Презентация по Химии "Тайна Е-621" - скачать смотреть
Презентация по Химии "Тайна Е-621" - скачать смотреть  Методические рекомендации по изучению курса «Коррозия и защита металлов»
Методические рекомендации по изучению курса «Коррозия и защита металлов» Применение этанола
Применение этанола Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Етери. Ізомерія та номенклатура
Етери. Ізомерія та номенклатура Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы
Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы Презентация по Химии "Галогены" - скачать смотреть
Презентация по Химии "Галогены" - скачать смотреть