Содержание
- 2. Опишите положение элементов халькогенов в Периодической системе химических элементов Д.И. Менделеева
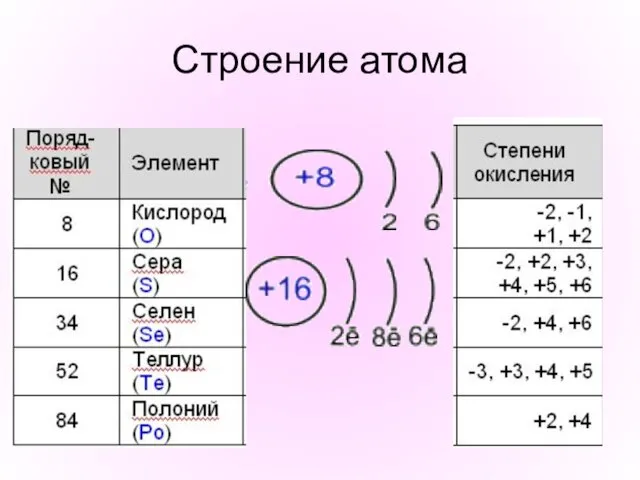
- 3. «Халькогены» К элементам 6 -А группы относят: кислород (8 О), серу (16 S), селен (34 Se),
- 5. Строение атома
- 9. КИСЛОРОД Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле;
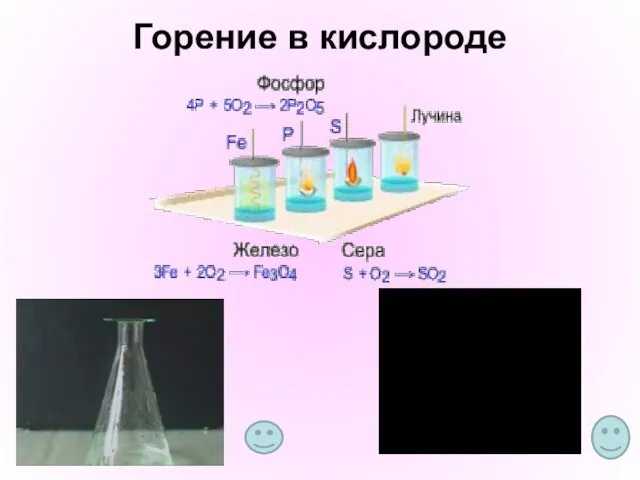
- 10. Химические свойства О2 Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au,
- 12. Горение в кислороде
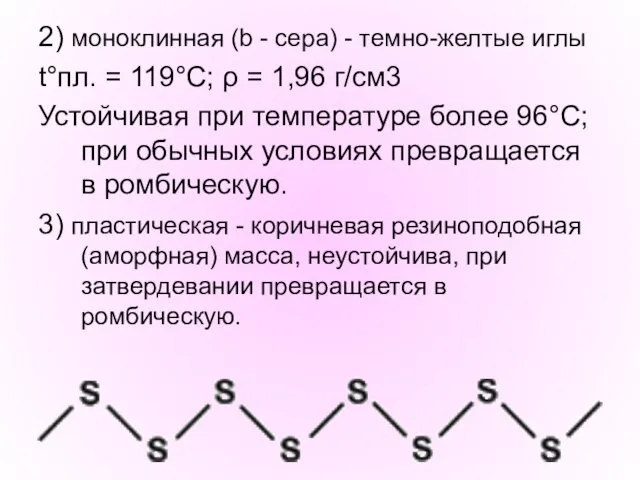
- 13. СЕРА S Физические свойства - Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается
- 14. 2) моноклинная (b - сера) - темно-желтые иглы t°пл. = 119°C; ρ = 1,96 г/см3 Устойчивая
- 15. Химические свойства
- 17. Соединения серы Сероводород и сульфиды H2S Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты и гидросульфиты
- 18. Серная кислота и ее соли H2SO4
- 20. Техника безопасности при работе с серной кислотой Правила ТБ при работе с кислотами Правила разбавления серной
- 21. Свойства разбавленной серной кислоты Серная кислота – сильный электролит, поэтому хорошо диссоциирует в воде на ионы
- 22. Свойства разбавленной серной кислоты С Металлами до Н С основными оксидами С растворимыми основаниями С нерастворимыми
- 24. Скачать презентацию


















 Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья
Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья Кислородсодержащие органические соединения (К.О.С.)
Кислородсодержащие органические соединения (К.О.С.) Аттестационная работа. Методическая разработка по выполнению исследовательской работы «Тайны поваренной соли»
Аттестационная работа. Методическая разработка по выполнению исследовательской работы «Тайны поваренной соли» Циклоалканы
Циклоалканы Технология производства и свойства искусственных волокон
Технология производства и свойства искусственных волокон Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды
Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды Строение атома
Строение атома Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка
Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка  Коррозия металлов
Коррозия металлов Вода в природе. Свойства воды.
Вода в природе. Свойства воды. Медь. Химические свойства. Получение меди. Применение
Медь. Химические свойства. Получение меди. Применение Материя. Уровни организации материи
Материя. Уровни организации материи Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Масс-спектрометрия (МС)
Масс-спектрометрия (МС) Продукты - рекордсмены по содержанию различных минеральных компонентов
Продукты - рекордсмены по содержанию различных минеральных компонентов Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома
Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома Кислотность органических соединений. Типы химических реакций
Кислотность органических соединений. Типы химических реакций Галогены
Галогены Теоретические аспекты
Теоретические аспекты Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Получение и свойства кислорода. Практическая работа № 4
Получение и свойства кислорода. Практическая работа № 4 Типы химических реакции
Типы химических реакции В гостях у Хозяйки Медной горы. Покровская сельская библиотека
В гостях у Хозяйки Медной горы. Покровская сельская библиотека Оксиды. Классификация. Названия
Оксиды. Классификация. Названия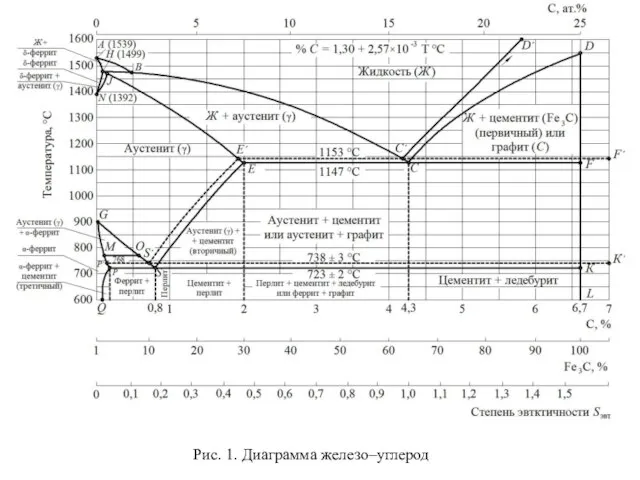 Чугуны и стали
Чугуны и стали Природный и попутный газ
Природный и попутный газ Оксиды (1 курс)
Оксиды (1 курс) Жиры и мыло
Жиры и мыло