Содержание
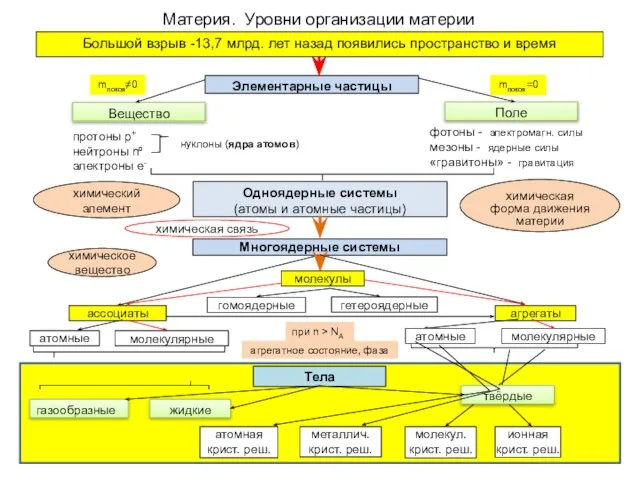
- 2. Большой взрыв -13,7 млрд. лет назад появились пространство и время Материя. Уровни организации материи агрегатное состояние,
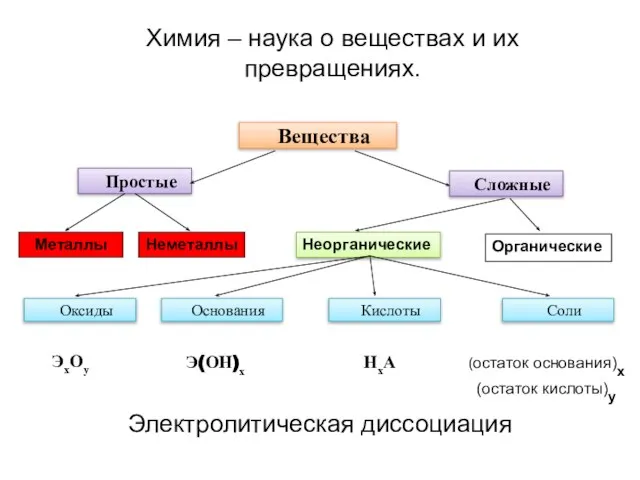
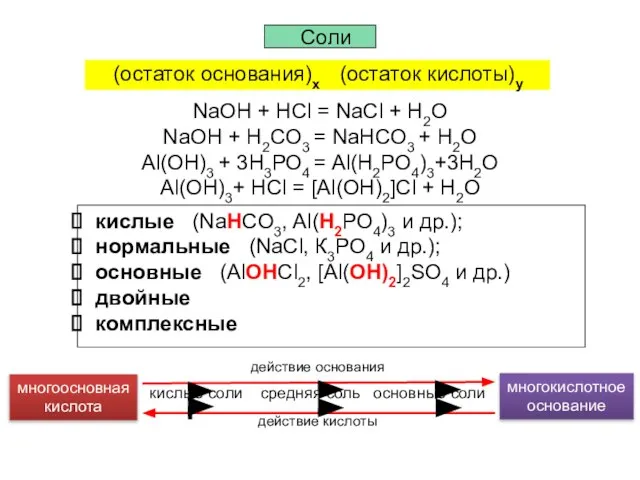
- 4. Простые Сложные Металлы Неметаллы Неорганические Органические Оксиды Основания Кислоты Соли ЭхОу Э(ОН)х НхА (остаток основания)х (остаток
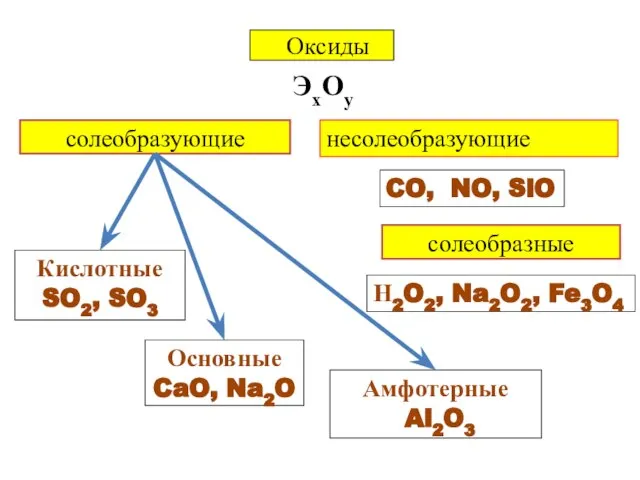
- 5. Оксиды ЭхОу солеобразующие Кислотные SO2, SO3 Основные CaO, Na2O Амфотерные Al2O3 несолеобразующие CO, NO, SiO солеобразные
- 6. Основания Э(ОН)х ОН‾ + [Э(ОН)х-1]+ сильные растворимые – щелочи; слабые; амфотерные Кислоты НхА Н+ + [Нх-1А]
- 7. NaOH + HCl = NaCl + H2O NaOH + H2CO3 = NaHCO3 + H2O Al(OH)3 +
- 8. Строение атомов Квантовая теория Уравнение Шредингера Квантовые числа
- 9. ⮟ 1900г. М.Планк, квантовая теория света. Квант энергии Е = hν. Постоянная Планка h = 6,625·10-34Дж·с.
- 10. Ĥψ = Еψ (энергия – это у электрона всё). Волновая функция Ψ характеризует амплитуду электронной волны,
- 11. Волновая функция ψ – это функция четырёх квантовых чисел (n, ℓ, mℓ, ms). ψ(n, ℓ, mℓ,
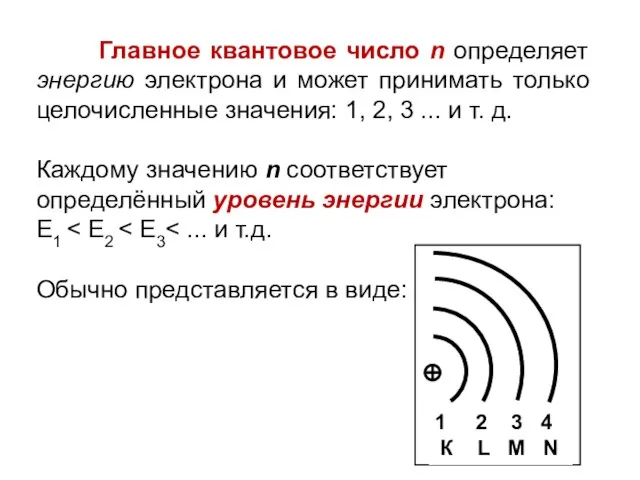
- 12. Главное квантовое число n определяет энергию электрона и может принимать только целочисленные значения: 1, 2, 3
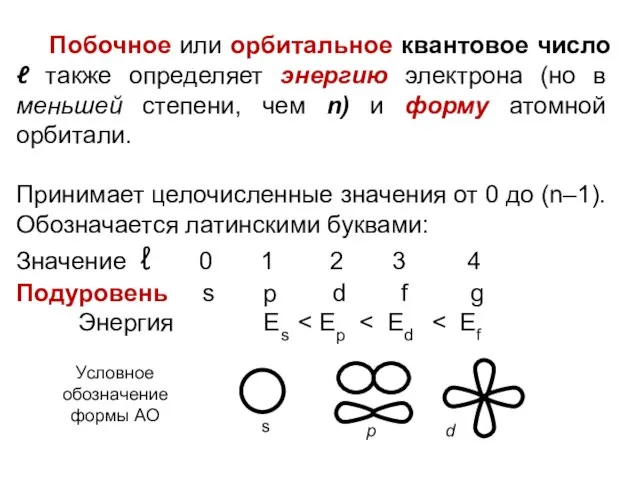
- 13. Условное обозначение формы АО Побочное или орбитальное квантовое число ℓ также определяет энергию электрона (но в
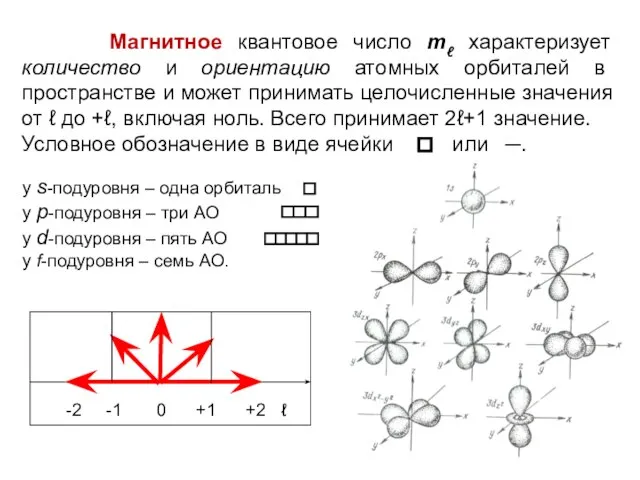
- 14. Магнитное квантовое число mℓ характеризует количество и ориентацию атомных орбиталей в пространстве и может принимать целочисленные
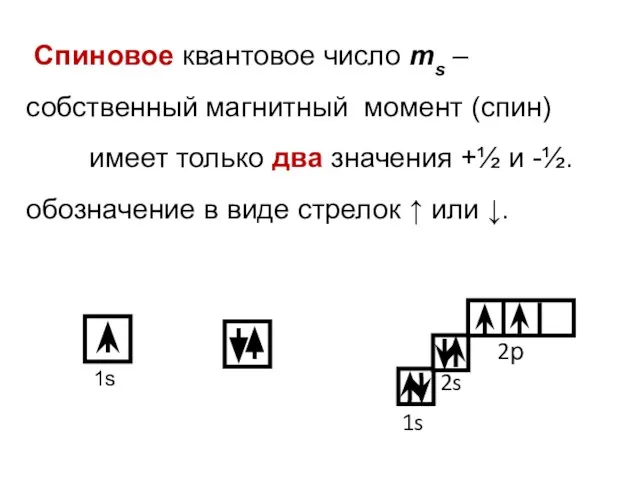
- 15. Спиновое квантовое число ms – собственный магнитный момент (спин) имеет только два значения +½ и -½.
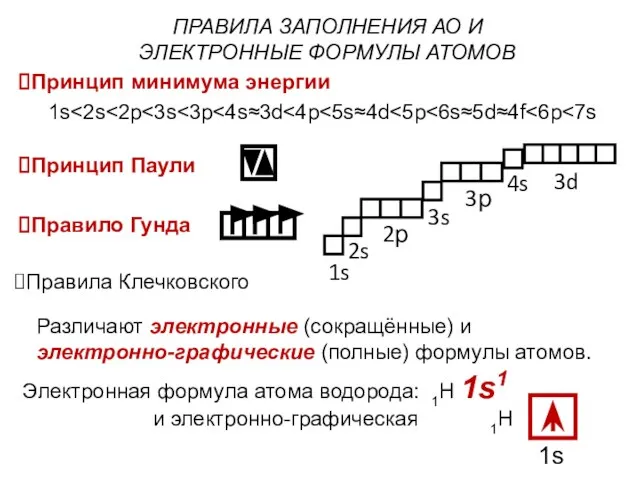
- 16. ПРАВИЛА ЗАПОЛНЕНИЯ АО И ЭЛЕКТРОННЫЕ ФОРМУЛЫ АТОМОВ Принцип минимума энергии 1s Принцип Паули Правило Гунда Правила
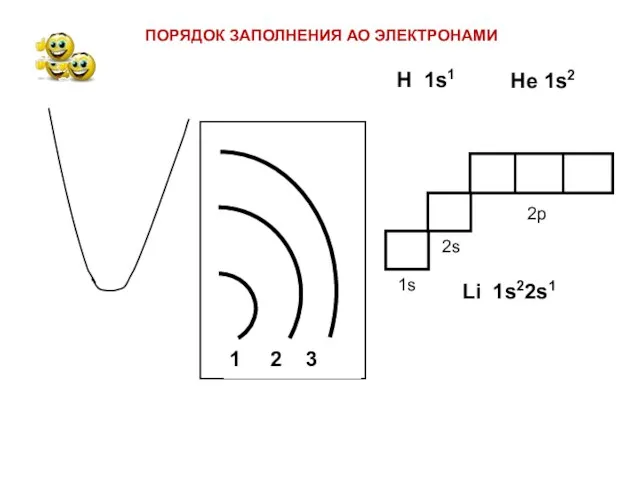
- 17. ПОРЯДОК ЗАПОЛНЕНИЯ АО ЭЛЕКТРОНАМИ Н 1s1 Не 1s2 Li 1s22s1
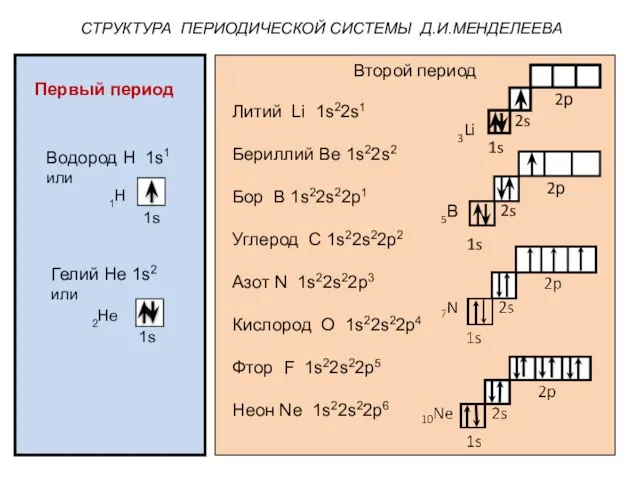
- 18. Второй период Литий Li 1s22s1 Бериллий Ве 1s22s2 Бор В 1s22s22р1 Углерод С 1s22s22р2 Азот N
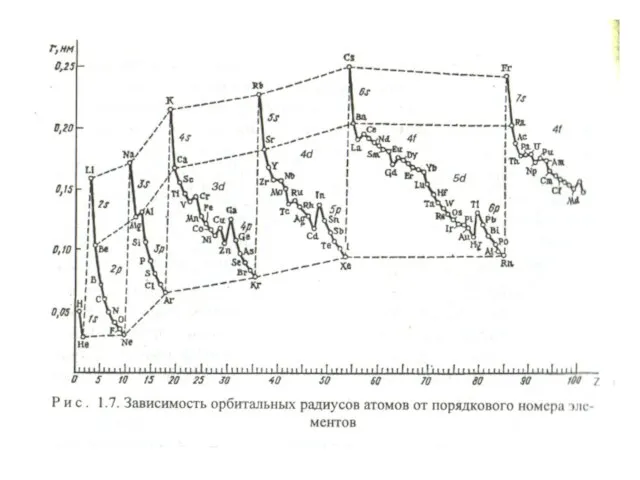
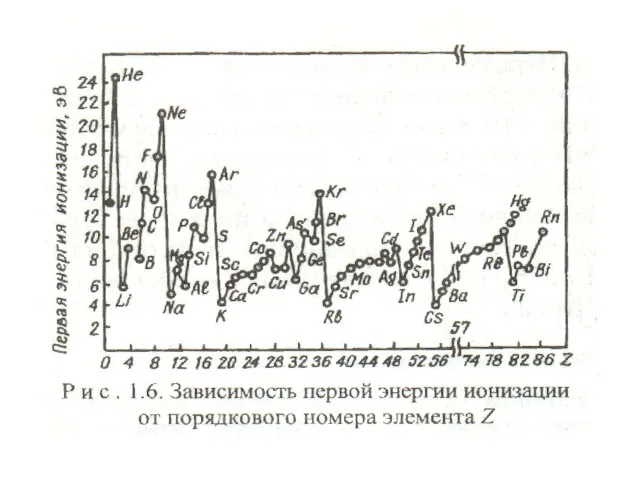
- 19. Важнейшие периодические свойства атома: атомный и ионный радиусы (r); энергия ионизации, (Еи); сродство к электрону, (Eе);
- 23. Скачать презентацию
![Основания Э(ОН)х ОН‾ + [Э(ОН)х-1]+ сильные растворимые – щелочи; слабые; амфотерные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/541249/slide-5.jpg)





 The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Бинарные соединения 8 класс
Бинарные соединения 8 класс Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47
ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47 Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Неорганические вещества
Неорганические вещества Непредельные углеводороды алкены
Непредельные углеводороды алкены Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза ОКСИДЫ АЗОТА.
ОКСИДЫ АЗОТА.  Силикатная промышленность
Силикатная промышленность Органическая химия. История развития
Органическая химия. История развития Галогены. История открытия галогенов
Галогены. История открытия галогенов Серная кислота H2SO4
Серная кислота H2SO4 Применимость геохимических правил к распространенности лантанидов в земной коре
Применимость геохимических правил к распространенности лантанидов в земной коре Растворы электролитов
Растворы электролитов Прогнозування хімічної обстановки під час застосування хімічної зброї
Прогнозування хімічної обстановки під час застосування хімічної зброї Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.
Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.  Металлы первой и второй групп
Металлы первой и второй групп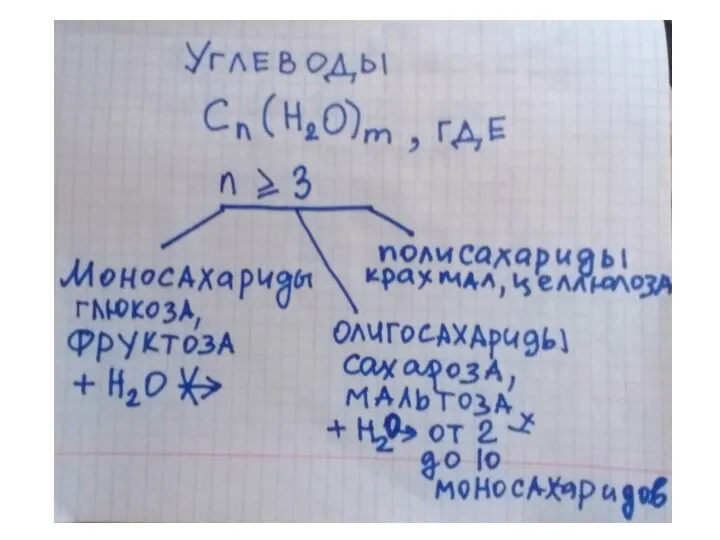 Крахмал и целлюлоза
Крахмал и целлюлоза Modelul atomic al actiniului
Modelul atomic al actiniului Липиды. Классификация липидов
Липиды. Классификация липидов Углеводы (10 класс) - Презентация по Химии_
Углеводы (10 класс) - Презентация по Химии_ Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2) Презентация по химии Классы неорганических веществ
Презентация по химии Классы неорганических веществ Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно
Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно Строение твердого вещества
Строение твердого вещества