Содержание
- 2. Альдегиды – это органические вещества, в молекулах которых содержится альдегидная группа: Определение:
- 4. СnH2nO Общая молекулярная формула гомологического ряда альдегидов:
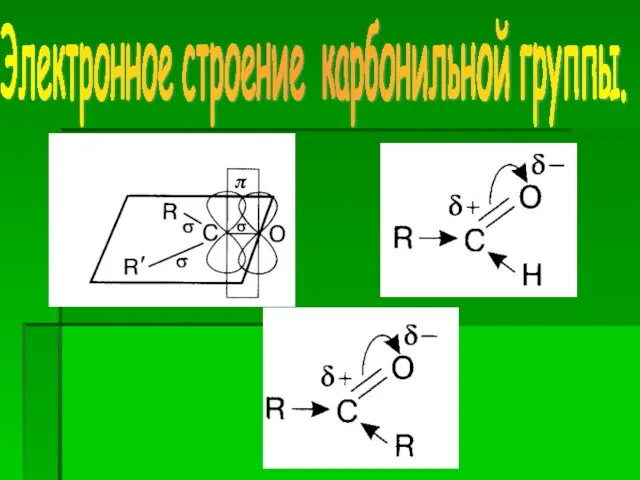
- 5. Электронное строение карбонильной группы.
- 6. 1. Структурная изомерия а) изомерия углеродного скелета 2. Межклассовая изомерия с кетонами Изомерия альдегидов:
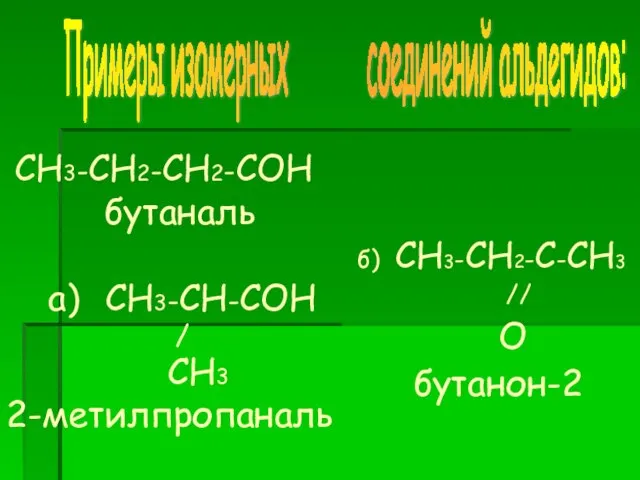
- 7. СН3-СН2-СН2-СОН бутаналь а) СН3-СН-СОН / СН3 2-метилпропаналь б) СН3-СН2-С-СН3 // О бутанон-2 Примеры изомерных соединений альдегидов:
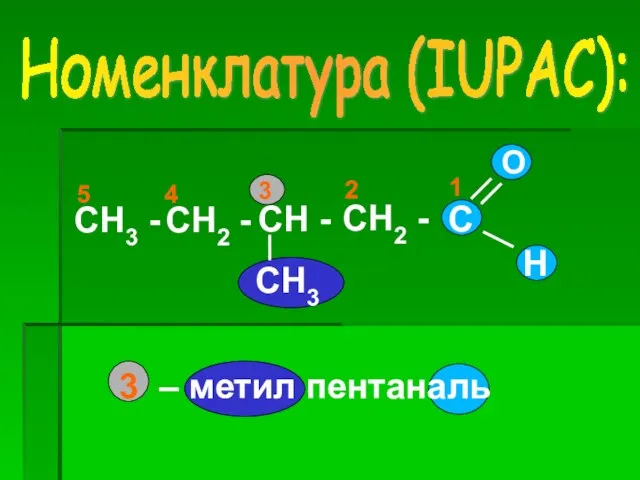
- 8. Номенклатура (IUPAC): CH3 - CH2 - CH - CH2 - CH3 1 2 3 4 5
- 9. Метаналь – газ с характерным запахом, хорошо растворим в воде. Низшие альдегиды – жидкие вещества, имеющие
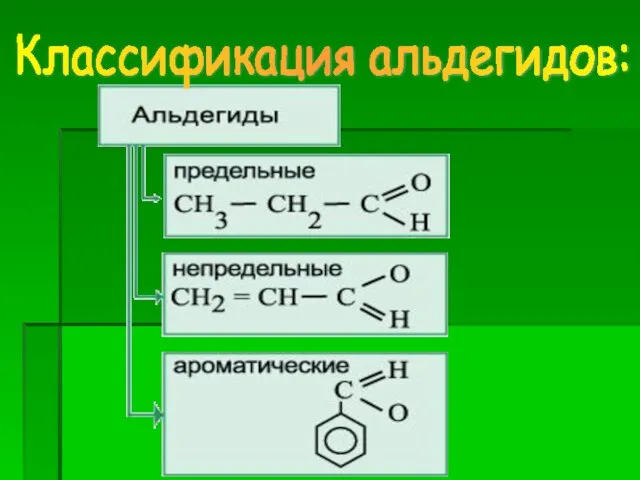
- 10. Классификация альдегидов:
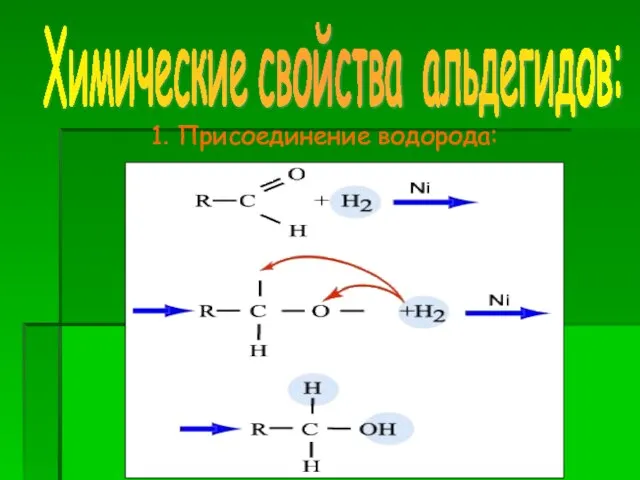
- 11. 1. Присоединение водорода: Химические свойства альдегидов:
- 12. Реакция «серебряного зеркала»
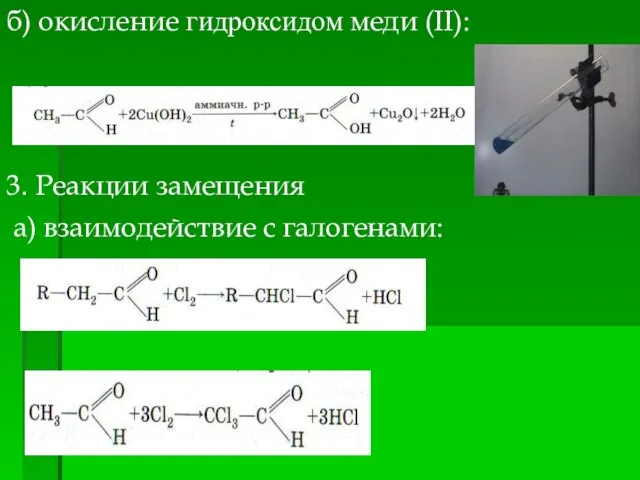
- 13. б) окисление гидроксидом меди (II): 3. Реакции замещения а) взаимодействие с галогенами:
- 14. Получение карбонильных соединений 1. Окисление спиртов: Первичные спирты окисляются до альдегидов, вторичные – до кетонов. 2.
- 15. 3. Гидратация алкинов: Из ацетилена можно получить уксусный альдегид (реакция Кучерова), из гомологов ацетилена – только
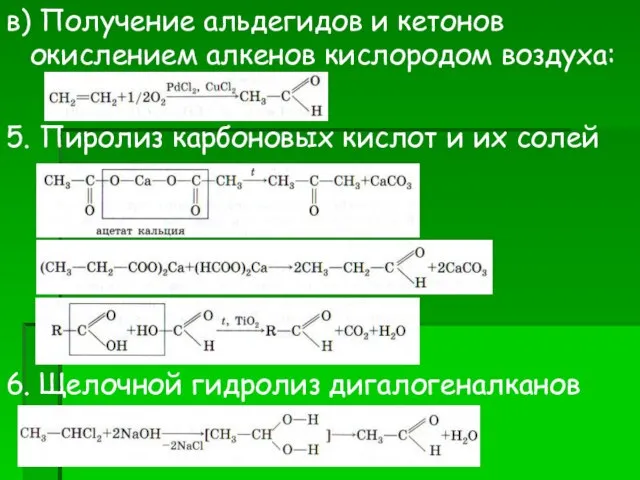
- 16. в) Получение альдегидов и кетонов окислением алкенов кислородом воздуха: 5. Пиролиз карбоновых кислот и их солей
- 17. Применение альдегидов и кетонов Природные альдегиды и кетоны, а также их синтетические аналоги используют в пищевой
- 18. Применение альдегидов В промышленности: Уксусный альдегид применяется в производстве уксусной кислоты, полимерных материалов. Ацетон служит основой
- 20. Скачать презентацию










 Нуклеофилы и электрофилы. Лекция 2
Нуклеофилы и электрофилы. Лекция 2 «Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т
«Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т Необычные минералы
Необычные минералы Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз
Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз Строение, свойства и многообразие функций белков
Строение, свойства и многообразие функций белков Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Засоби побутової хімії – небезпечні джерела шкідливих для здоров’я людини речовин.
Засоби побутової хімії – небезпечні джерела шкідливих для здоров’я людини речовин.  Воздух, его состав и значение
Воздух, его состав и значение Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации
Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации Титан и его сплавы
Титан и его сплавы Полимеризация циклов. Сополимеризация
Полимеризация циклов. Сополимеризация Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды
Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды Строение вещества
Строение вещества Składniki odżywcze
Składniki odżywcze Аллотропные модификации. Углерод
Аллотропные модификации. Углерод Презентация по Химии "Растворимость веществ в воде" - скачать смотреть
Презентация по Химии "Растворимость веществ в воде" - скачать смотреть  Растворы ВМС
Растворы ВМС Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева
Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ Классификация методов аналитической химии
Классификация методов аналитической химии Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Кремний. Химические свойства
Кремний. Химические свойства Важнейшие классы бинарных соединений. Оксиды, гидриды и летучие водородные соединения
Важнейшие классы бинарных соединений. Оксиды, гидриды и летучие водородные соединения КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс
КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс  Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Важнейшие химические понятия и законы
Важнейшие химические понятия и законы