Содержание
- 2. План: - Алкадиены, основные представители, номенклатура; - Строение алкадиенов; - Изомерия алкадиенов; - Физические свойства алкадиенов;
- 3. Алкадиены, основные представители, номенклатура. Алкадиены – это ненасыщенные, непредельные, ациклические углеводороды, имеющие две двойные связи и
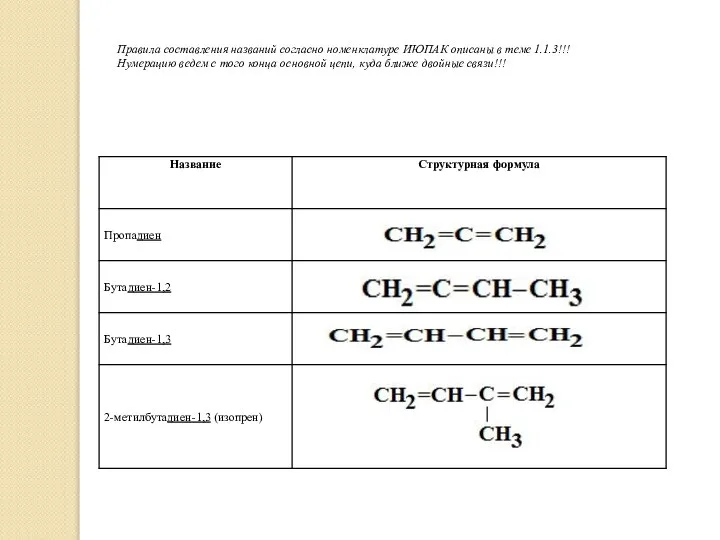
- 4. Правила составления названий согласно номенклатуре ИЮПАК описаны в теме 1.1.3!!! Нумерацию ведем с того конца основной
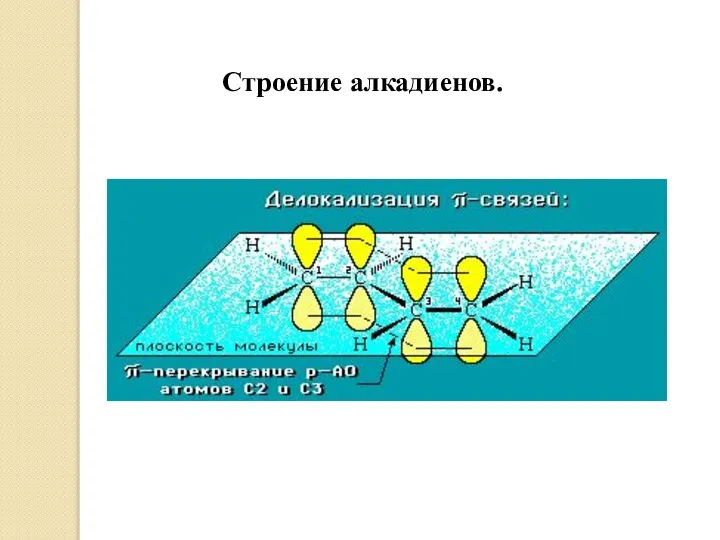
- 5. Строение алкадиенов.
- 6. Изомерия алкадиенов. I Структурные изомеры 1. Изомеры углеродного скелета.
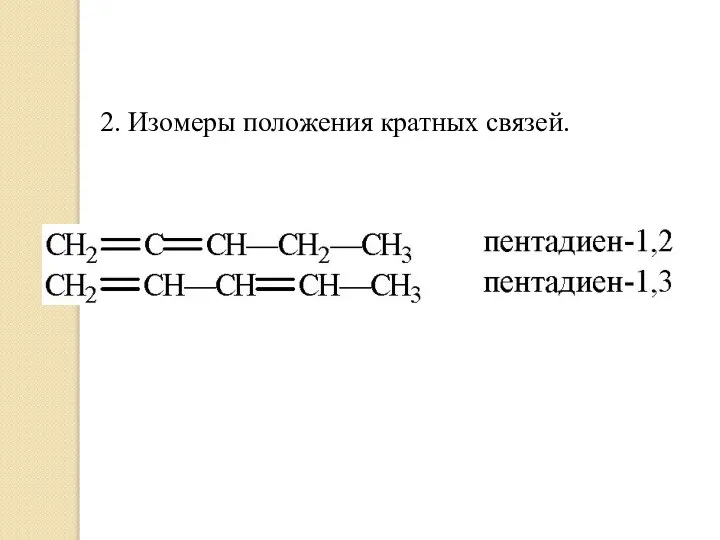
- 7. 2. Изомеры положения кратных связей.
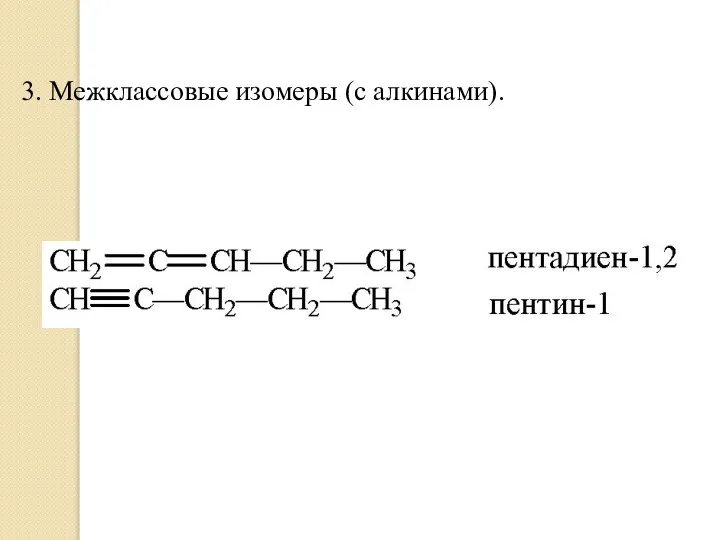
- 8. 3. Межклассовые изомеры (с алкинами).
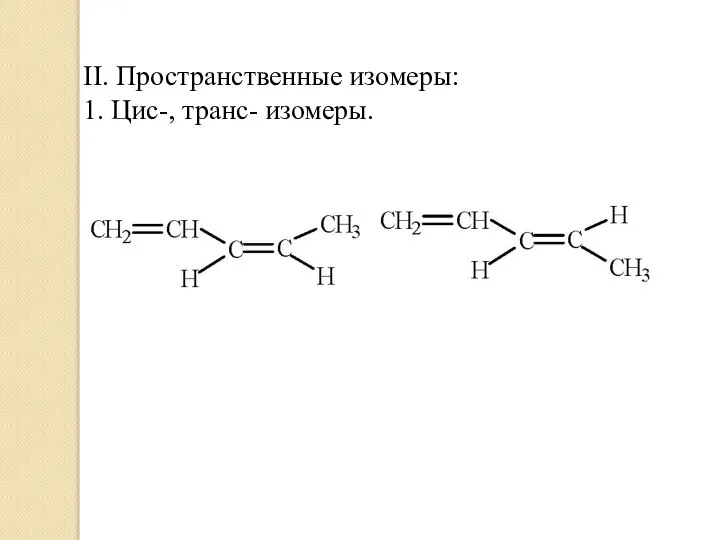
- 9. II. Пространственные изомеры: 1. Цис-, транс- изомеры.
- 10. Физические свойства алкадиенов.
- 11. Химические свойства алкадиенов. 1. Реакции присоединения: В отличие от алкенов, для сопряженных алкадиенов может идти как
- 12. Пример 2: Рвутся обе двойные связи, водород присоединяется к первому и четвертому атому углерода, а между
- 13. Б) Реакция гидрогалогенирования (+НHal). В) Реакция галогенирования (+Hal). Г) Реакция гидратации (+Н2О). *Реакции Б, В и
- 14. 2. Реакция каталитического окисления алкенов: А) Реакция мягкого окисления (реакция Вагнера). Пример 1: Аналогично реакции с
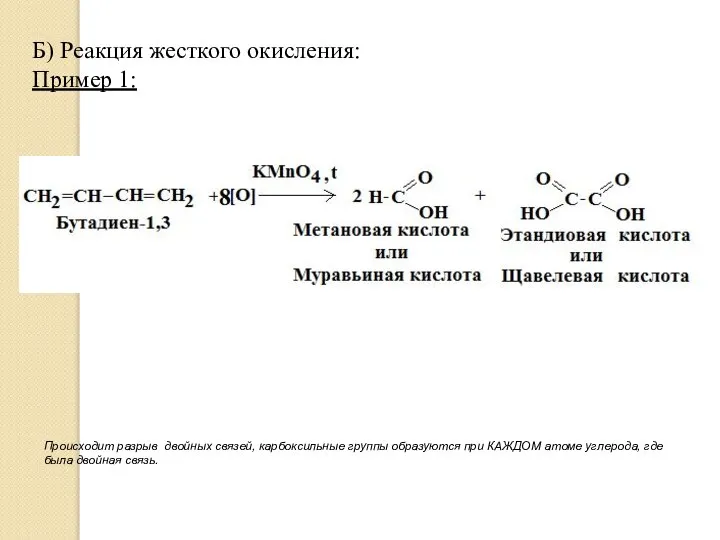
- 15. Б) Реакция жесткого окисления: Пример 1: Происходит разрыв двойных связей, карбоксильные группы образуются при КАЖДОМ атоме
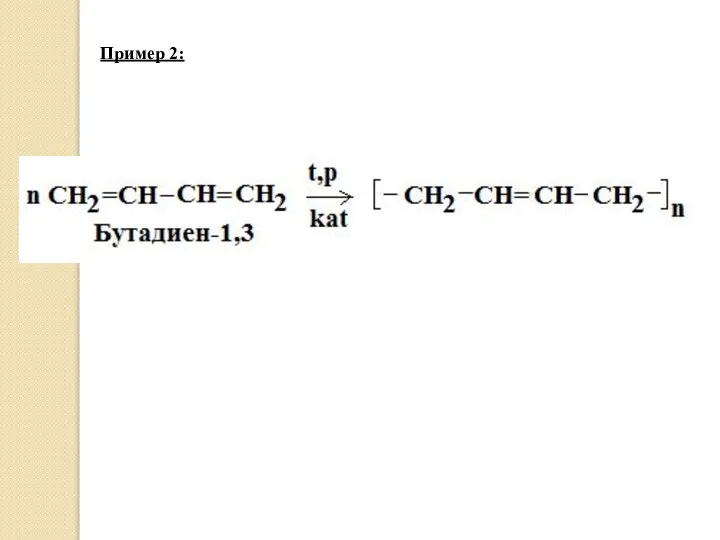
- 16. 3. Реакция полимеризации. Аналогично реакции присоединения бывает 1,2- и 1,4- полимеризация. Пример 1: Между первым и
- 17. Пример 2:
- 18. Получение алкадиенов. 1. Дегалогенирование тетрагалогеналканов, у которых галогены находится при соседних атомах углерода: Пример 1:
- 19. 2. Дегидрогалогенирование дигалогеналканов при действии на них спиртовым раствором щелочи: Пример 1:
- 20. 3. Дегидратация многоатомных спиртов:
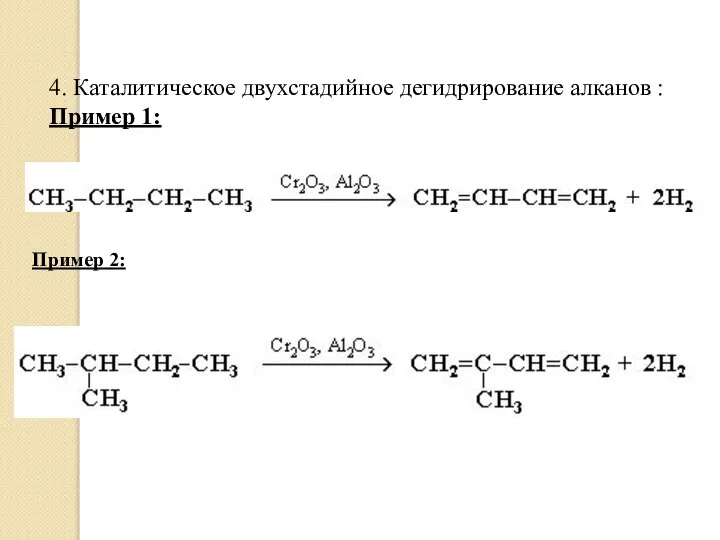
- 21. 4. Каталитическое двухстадийное дегидрирование алканов : Пример 1: Пример 2:
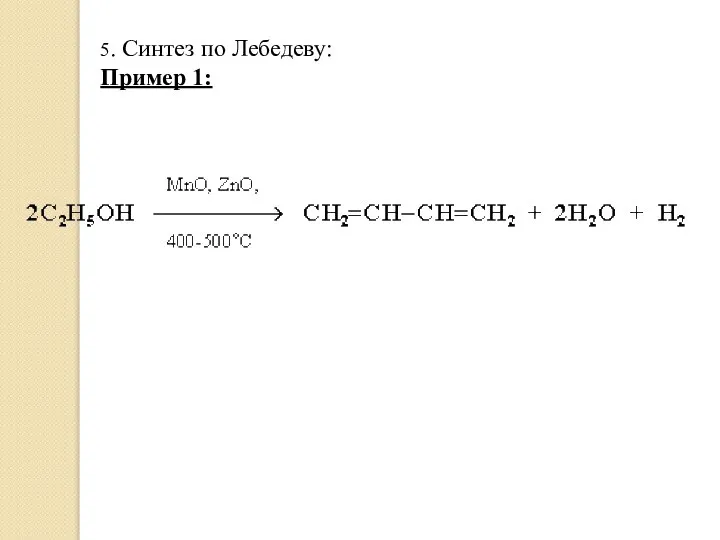
- 22. 5. Синтез по Лебедеву: Пример 1:
- 23. Применение алкадиенов. Алкадиены используются в основном для синтеза синтетических каучуков. Первым синтетическим каучуком, имевшим промышленное значение,
- 25. Скачать презентацию













 Генетическая классификация горных пород
Генетическая классификация горных пород Химические элементы. Простые и сложные вещества Задачи урока: Познакомиться с понятием химический элемент. Познакомиться с поня
Химические элементы. Простые и сложные вещества Задачи урока: Познакомиться с понятием химический элемент. Познакомиться с поня Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Альдегиды. Кетоны
Альдегиды. Кетоны Эстетическая, биологическая и культурная роль коллоидных систем в жизни человека
Эстетическая, биологическая и культурная роль коллоидных систем в жизни человека Почвенные коллоиды
Почвенные коллоиды Органические галогениды. (Лекция 7)
Органические галогениды. (Лекция 7) Химическая связь
Химическая связь Министерство образования и науки астраханской области ОГОУ НПО «Профессиональный лицей № 1 » Авторы: Усенов А.А. группа № 318-319
Министерство образования и науки астраханской области ОГОУ НПО «Профессиональный лицей № 1 » Авторы: Усенов А.А. группа № 318-319  Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева
Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева Сверхпроводимость. Основные свойства
Сверхпроводимость. Основные свойства Коллоидные растворы. Электрические, молекулярно-кинетические, оптические свойства коллоидных растворов. (Часть 2)
Коллоидные растворы. Электрические, молекулярно-кинетические, оптические свойства коллоидных растворов. (Часть 2) Методы титриметрического анализа
Методы титриметрического анализа Карбонат натрия
Карбонат натрия Вещества и явления в окружающем мире. 5 класс
Вещества и явления в окружающем мире. 5 класс Комплексные соединения
Комплексные соединения Алканы
Алканы Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1 Генетическая связь между классами веществ
Генетическая связь между классами веществ Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск
Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск  Химические свойства солей
Химические свойства солей Количественный анализ. Гравиметрия
Количественный анализ. Гравиметрия Сплавы серебра
Сплавы серебра Внеклассная работа по химии Система внеклассной работы по химии
Внеклассная работа по химии Система внеклассной работы по химии Колба Вюрца
Колба Вюрца Возбудители колибактериоза
Возбудители колибактериоза Титриметрический анализ
Титриметрический анализ