Содержание
- 2. Лекция № 1 Тема: «Введение. Теория строения органических соединений А.М.Бутлерова» План: 1. Предмет и задачи органической
- 3. 1. Предмет и задачи органической химии. Значение орг. химии для медицины и фармации. Объектом изучения органической
- 4. В состав орг. соединений кроме углерода входят и другие элементы, чаще всего водород, кислород , азот,
- 5. 2. Роль русских ученых в становлении и развитии органической химии. Бутлеров Александр Михайлович (1828-1886), русский химик,
- 6. Зинин Николай Николаевич (1812-1880), русский химик-органик, академик Петербургской АН с 1865 г. По окончании Казанского университета
- 7. Марковников Владимир Васильевич (1837-1904), русский химик. Ученик А. М. Бутлерова. Окончил в 1860 Казанский университет; с
- 8. Зайцев Александр Михайлович(1841-1910), русский химик-органик, член-корреспондент Петербургской АН (1885). Ученик А. М. Бутлерова. По окончании Казанского
- 9. 3елинский Николай Дмитриевич(1861-1953), советский химик-органик, академик АН СССР (1929), один из основоположников учения об органическом катализе.
- 10. Кучеров Михаил Григорьевич (1850-1911), русский химик-органик. В 1871 окончил Петербургский земледельческий (с 1877 — лесной) институт
- 11. Лебедев Сергей Васильевич (1874-1934), советский химик, академик АН СССР (1932; член-корреспондент 1928). Ученик А. Е. Фаворского.
- 12. Несмеянов Александр Николаевич (1899-1980), советский химик-органик, академик АН СССР (1943; член-корреспондент 1939), общественный деятель, Герой Социалистического
- 13. 3. Теория строения орг. соединений А.М.Бутлерова. Гибридизация атома углерода. Виды гибридизации. Основные положения теории: 1. Атомы
- 14. 2. Атомы в молекулах орг. веществ соединяются в определенной последовательности, что обуславливает химическое строение молекулы: Н
- 15. 3. Свойства орг.соединений зависят не только от числа и природы входящих в их состав атомов, но
- 16. 4. Атомы в молекулах орг. соединений оказывают взаимное влияние друг на друга. Наибольшее влияние оказывают атомы,
- 17. Гибридизация атомов углерода Гибридизация – это смещение валентных электронных облаков и образование качественно новых, равноценных гибридных
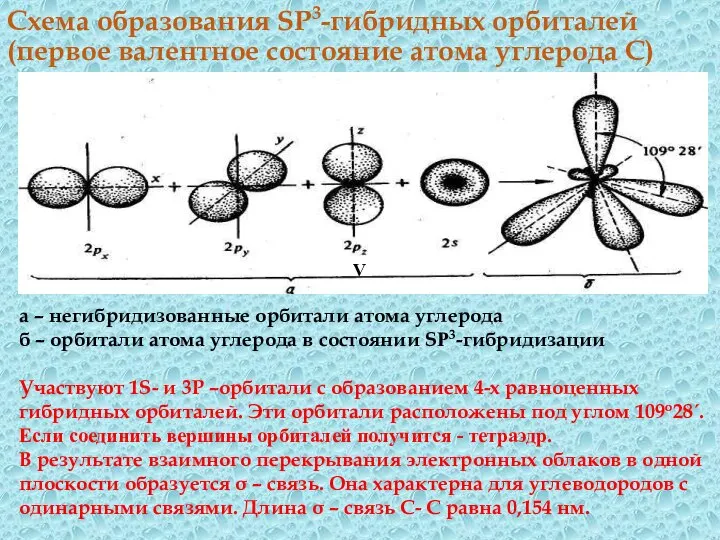
- 18. Схема образования SP3-гибридных орбиталей (первое валентное состояние атома углерода С) V а – негибридизованные орбитали атома
- 19. Схема образования SP2-гибридных орбиталей (второе валентное состояние атома углерода С) а б а б а –
- 20. Отличие от sp3 –орбиталей –большая лопасть объёмной восьмёрки короче. sp2- орбитали лежат в одной плоскости и
- 21. Схема образования SP-гибридных орбиталей (третье валентное состояние атома углерода С) а – негибридизованные орбитали атома углерода
- 22. В результате образуются две равноценные гибридные орбитали, имеющие форму объёмных восьмёрок с еще более короткой лопастью.
- 23. 4. Классификация органических соединений. Органические соединения отличаются своей многочисленностью и разнообразием. Поэтому необходима их систематизация. Органические
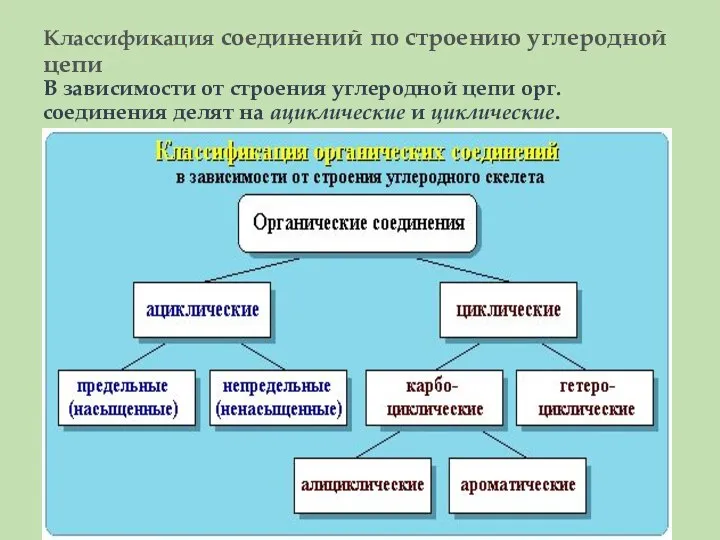
- 24. Классификация соединений по строению углеродной цепи В зависимости от строения углеродной цепи орг. соединения делят на
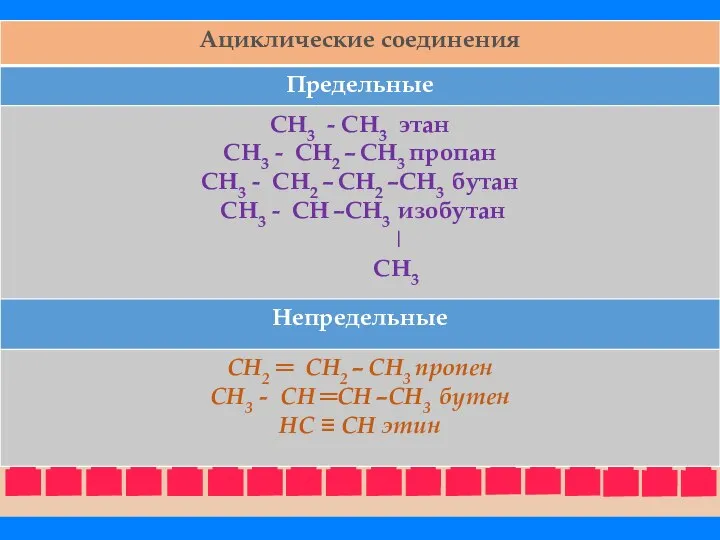
- 25. Ациклические соединения - соединения с открытой (незамкнутой) углеродной цепью. Эти соединения называются также алифатическими. Среди ациклических
- 27. Ациклические соединения подразделяют также на соединения с неразветвленной и разветвленной цепью. В этом случае учитывается число
- 28. Циклические соединения - соединения с замкнутой углеродной цепью. В зависимости от природы атомов, составляющих цикл, различают
- 30. Гетероциклические соединения - содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов -
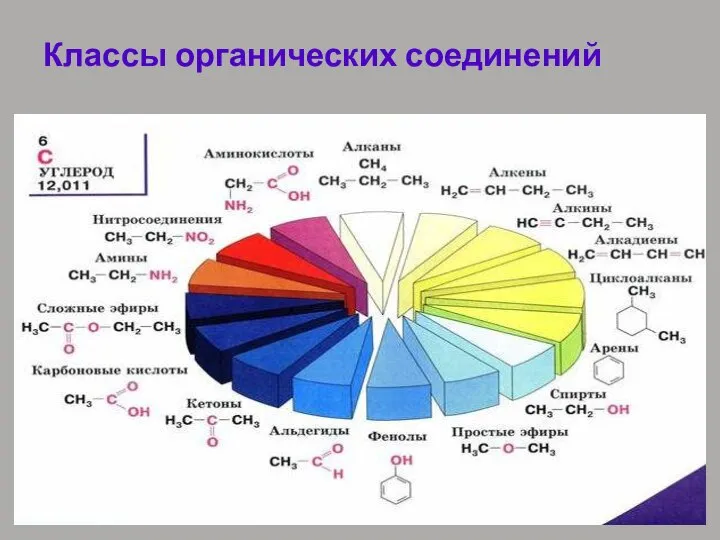
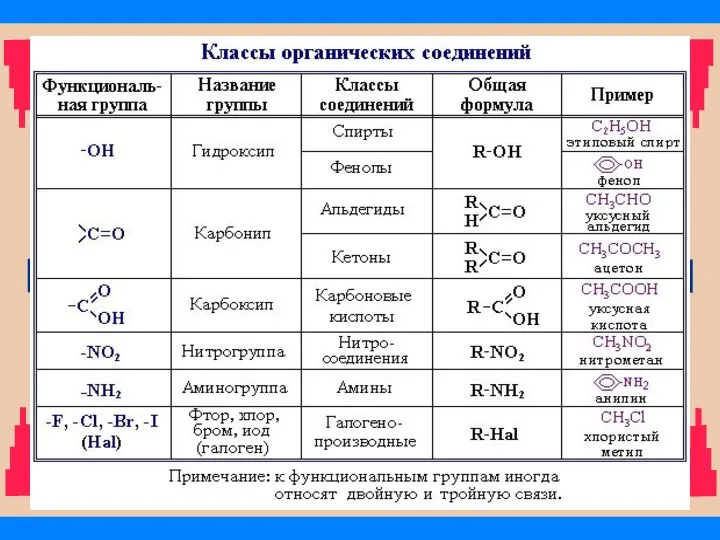
- 31. Классификация соединений по функциональным группам Соединения, в состав которых входят только углерод и водород, называются углеводородами.
- 32. Классы органических соединений
- 34. В состав молекул органических соединений могут входить две или более одинаковых или различных функциональных групп. Например:
- 35. Лекция № 2 Тема: «АЛКАНЫ» План: 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. 2. Методы синтеза
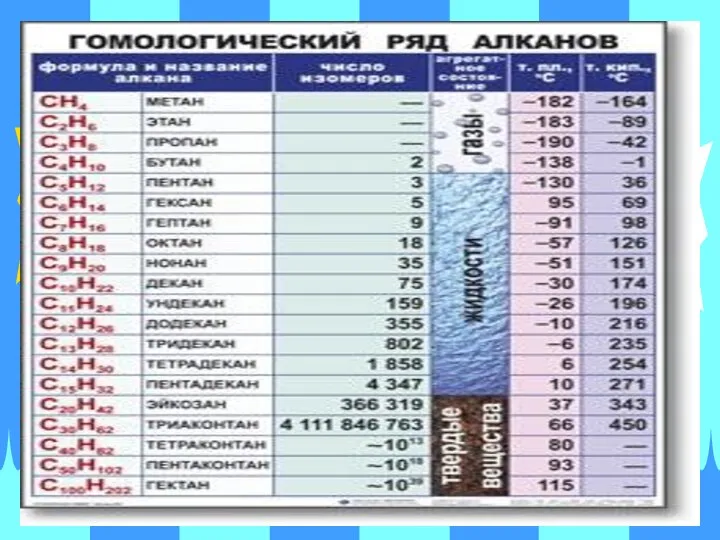
- 36. 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. Алканы – алифатические углеводороды, в молекулах которых атомы углерода
- 38. Изомерия Атомы углерода в молекулах алканов находятся в SP3 – гибризизации. Для алканов характерна структурная изомерия-
- 39. Номенклатура Для названия алканов с разветвлённой углеродной цепью необходимо знать названия органических радикалов –алкилов. Алкил –
- 40. Радикалы :
- 41. Систематическая (научная) номенклатура – ИЮПАК 1. Выбираем самую длинную цепочку. 2. Нумеруем её с той стороны,
- 42. Рациональная номенклатура 1. Выбираем центральный атом и обозначаем его *. Центральный атом тот, который имеет максимальное
- 43. 2. Методы синтеза алканов. Для получения алканов используют в основном природные источники. Газообразные алканы получают из
- 44. 3. Щелочной гидролиз солей карбоновых кислот ( лабораторный способ получения – берём смесь Na2CO3 + Са(ОН)2,
- 45. 3. Физико-химические свойства. 1).Физические свойства алканов указаны в таблице «Гомологический ряд алканов» (смотри слайд № 36).
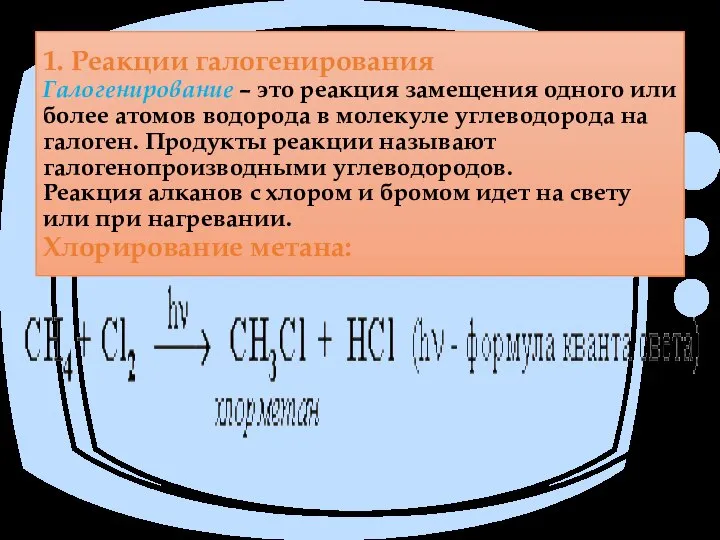
- 46. 1. Реакции галогенирования Галогенирование – это реакция замещения одного или более атомов водорода в молекуле углеводорода
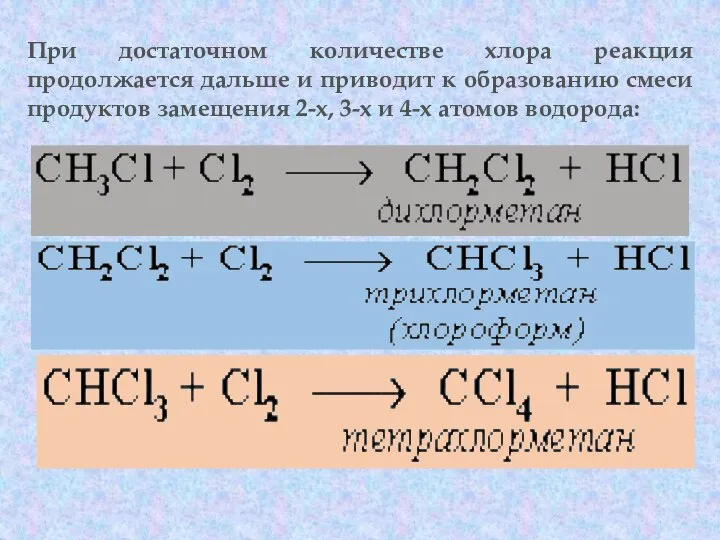
- 47. При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х
- 48. При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода
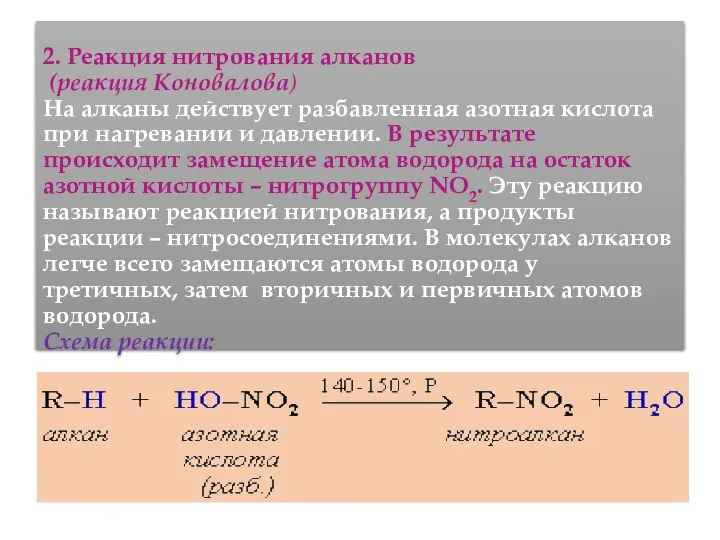
- 49. 2. Реакция нитрования алканов (реакция Коновалова) На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении.
- 50. 3. Реакции горения алканов Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается
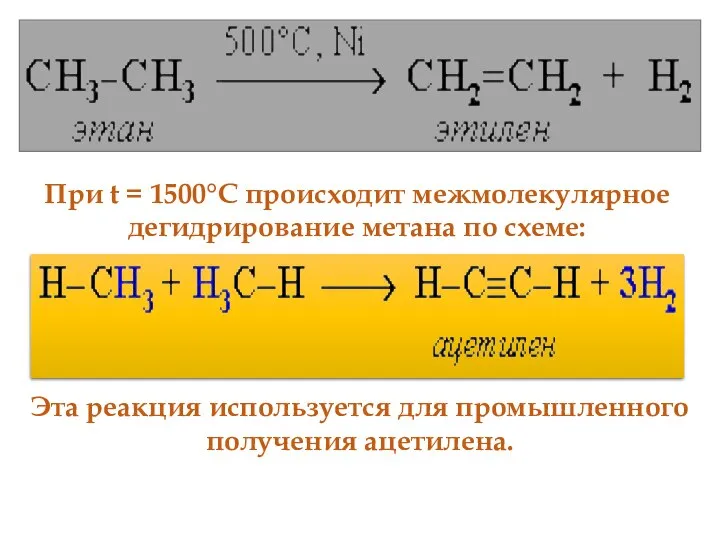
- 51. 4. Реакция дегидрирования алканов По связям С–Н возможны реакции отщепления атома водорода (дегидрирование). При нагревании алканов
- 52. При t = 1500°С происходит межмолекулярное дегидрирование метана по схеме: Эта реакция используется для промышленного получения
- 53. 4. Отдельные представители. Метан - СН4 – бесцветный газ, без запаха, мало растворим в воде, легче
- 55. Скачать презентацию










































 Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Кремний – бог неорганической природы
Кремний – бог неорганической природы Неметаллы: общая характеристика
Неметаллы: общая характеристика Новые катализаторы
Новые катализаторы Презентация по Химии "Пищевые добавки. Е - коды" - скачать смотреть
Презентация по Химии "Пищевые добавки. Е - коды" - скачать смотреть  Инструментальные методы анализа
Инструментальные методы анализа Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В
Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Презентация по химии Фосфор
Презентация по химии Фосфор  Аллотропия углерода
Аллотропия углерода Презентация по Химии "Презентація на тему : «Фосфатні добрива у нашому житті»" - скачать смотреть бесплатно
Презентация по Химии "Презентація на тему : «Фосфатні добрива у нашому житті»" - скачать смотреть бесплатно Строение атома. Периодический закон
Строение атома. Периодический закон Углеводы. Моносахариды. Дисахариды
Углеводы. Моносахариды. Дисахариды Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Производные дигидропиридина (нефидипин, амлодипин, форидон) и пиридина (супрастин)
Производные дигидропиридина (нефидипин, амлодипин, форидон) и пиридина (супрастин) Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Етиловий спирт та його вплив на організм людини
Етиловий спирт та його вплив на організм людини Машиностроительные материалы
Машиностроительные материалы Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15)
Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15) Структура периодической системы химических элементов
Структура периодической системы химических элементов Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат
Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат