Содержание
- 2. Предельные углеводороды, состоящие из атомов углерода и водорода, соединенные между собой одинарной связью. Общая формула CnH2n+2
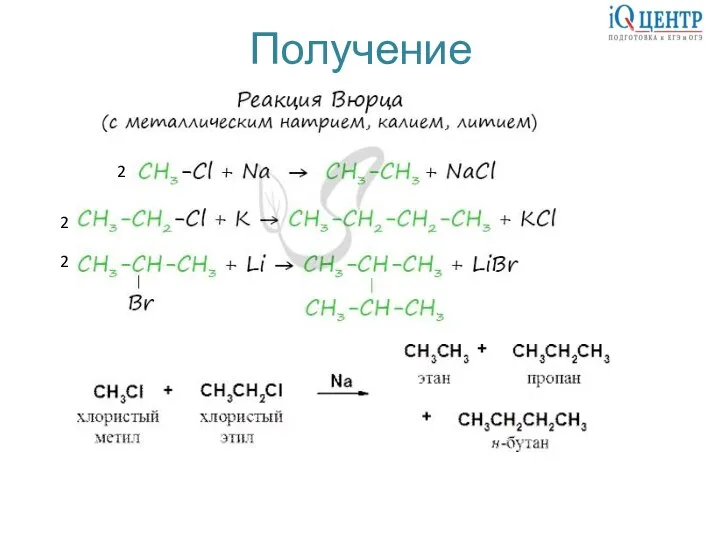
- 3. Получение 2 2 2
- 4. Синтез по Кольбе, электролиз конц.водных растворов солей карбоновых кислот Реакция Дюма, декарбоксилирование солей карбоновых кислот
- 5. Гидрирование ненасыщенных углеводородов на Pt/Ni/Pd катализаторе, t R-СH=CH-R+H2 = R-CH2-CH2-R Гидрирование оксидов углерода nCO+(2n+1)H2=CnH2n+2+nH2O (Co, t)
- 6. Из карбидов металлов(лаб) Переработка нефти, природного газа, попутного нефтяного газа, каменного угля Газификация твердого топлива С+2H2=CH4
- 7. Химические свойства Качественные реакции Не обесцвечивает р-р KMnO4 и бромную воду Горит голубоватым пламенем Реакции окисления
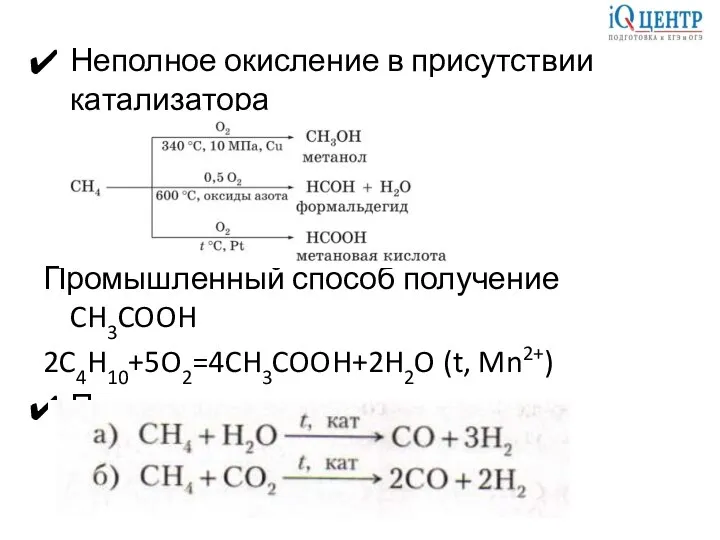
- 8. Неполное окисление в присутствии катализатора Промышленный способ получение CH3COOH 2C4H10+5O2=4CH3COOH+2H2O (t, Mn2+) Получение синтез-газа из метана
- 9. Термолиз 2CH4=C2H2+3H2(t=1500 C) CH4=C+2H2(t>1500 C) +риформинг
- 10. Реакции радикального замещения Галогенирование
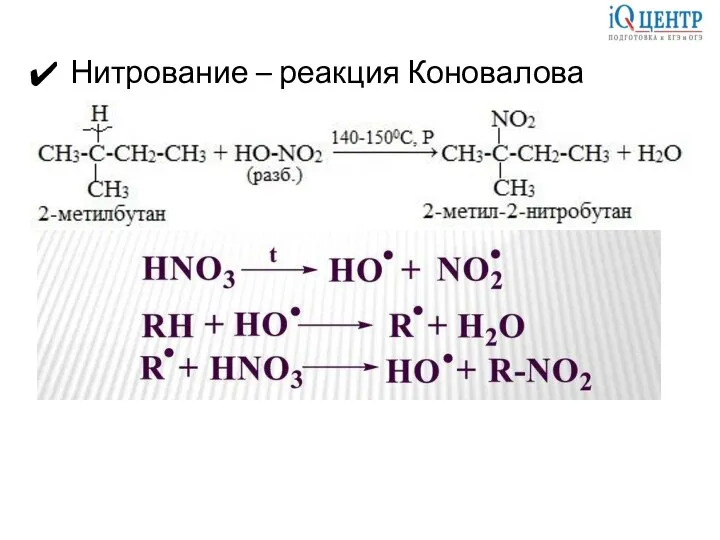
- 12. Нитрование – реакция Коновалова
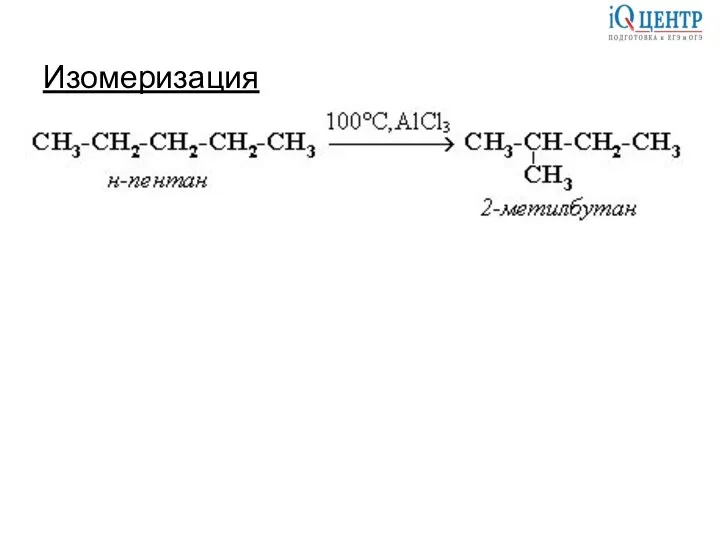
- 13. Изомеризация
- 15. Скачать презентацию








 Тема урока: «Классификация и свойства кислот»
Тема урока: «Классификация и свойства кислот» Энергетика химических реакций. Лекция 4
Энергетика химических реакций. Лекция 4 Аттестаионная работа. Сахар. Изучаем и исследуем
Аттестаионная работа. Сахар. Изучаем и исследуем Драгоценные камни
Драгоценные камни Великие химики
Великие химики Тепловой эффект химических реакций 8 класс
Тепловой эффект химических реакций 8 класс Учитель химии МОУ СОШ №18 Лаврик Виктория Александровна
Учитель химии МОУ СОШ №18 Лаврик Виктория Александровна 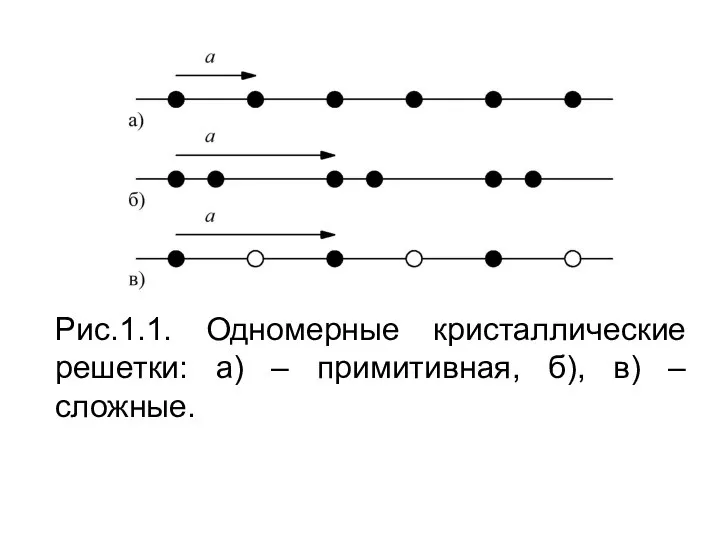 Кристаллические решётки
Кристаллические решётки Углеводы Органические соединения, содержащие в составе молекул наряду с карбонильной несколько гидроксильных групп, их пр
Углеводы Органические соединения, содержащие в составе молекул наряду с карбонильной несколько гидроксильных групп, их пр Спирты (карбинолы)
Спирты (карбинолы) Презентация по Химии "Промышленное получение аминокислот и их применение в медицыне и диетологии" - скачать смотреть бесплат
Презентация по Химии "Промышленное получение аминокислот и их применение в медицыне и диетологии" - скачать смотреть бесплат Удивительные свойства воды
Удивительные свойства воды Проблема химического элемента. Концепции структуры химических соединений
Проблема химического элемента. Концепции структуры химических соединений Химия Для студентов I курса специальностей: 2080165 — экология, 08040165 — товароведение и экспертиза товаров, 260800 — технология, конс
Химия Для студентов I курса специальностей: 2080165 — экология, 08040165 — товароведение и экспертиза товаров, 260800 — технология, конс Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации
Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации Валентность (8 класс)
Валентность (8 класс) Работу выполняла: Шумкова Елизавета. Руководитель: Шилоносова Елена Леонидовна.
Работу выполняла: Шумкова Елизавета. Руководитель: Шилоносова Елена Леонидовна. Крахмал. Физические свойства
Крахмал. Физические свойства Нанохимия
Нанохимия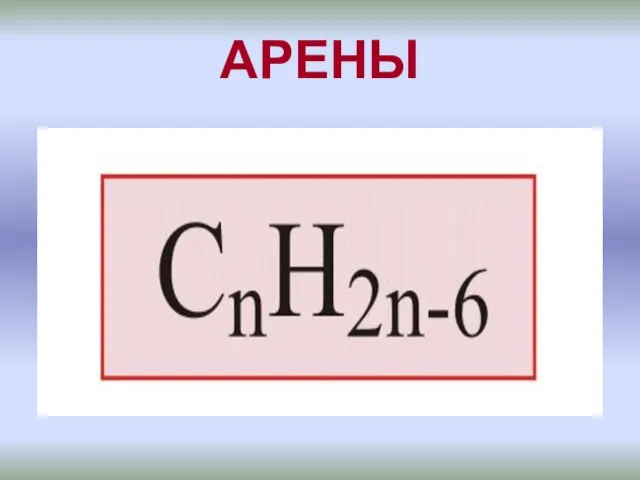 Бензоидные ароматические углеводороды - арены
Бензоидные ароматические углеводороды - арены Химия. Атомы, молекулы и ионы
Химия. Атомы, молекулы и ионы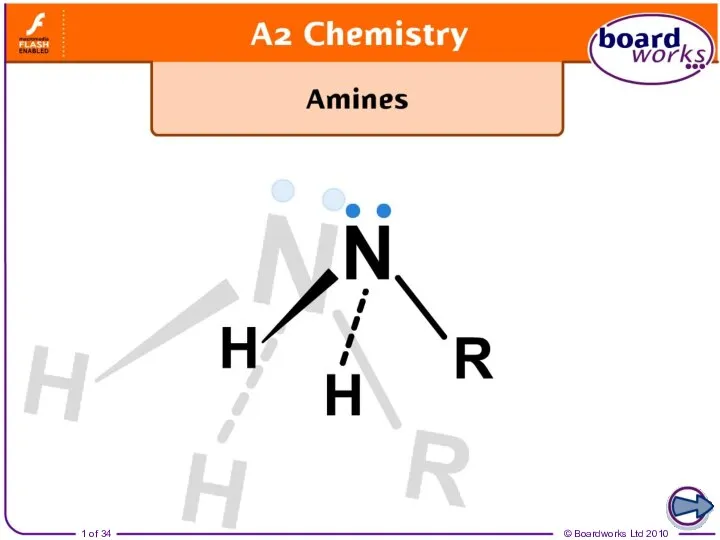 Ammonia and amines
Ammonia and amines Каучук. Применение
Каучук. Применение 5 группа элементов
5 группа элементов Аттестационная работа. Окраска ткани природными красителями
Аттестационная работа. Окраска ткани природными красителями Методы исследования и характеризации поверхностей. Поверхностное и межфазное натяжение. Тензиометрия и эллипсометрия
Методы исследования и характеризации поверхностей. Поверхностное и межфазное натяжение. Тензиометрия и эллипсометрия Растворы. Термодинамическая теория растворов
Растворы. Термодинамическая теория растворов Презентация по Химии "Синтетические материалы" - скачать смотреть
Презентация по Химии "Синтетические материалы" - скачать смотреть