Содержание
- 2. Теории растворов Корпускулярная теория (18 век). Раствор рассматривается как механическая смесь компонентов. Частицы растворенного вещества проникают
- 3. Химическая теория (19 век, Менделеев). Растворение – разновидность химического взаимодействия между частицами растворителя и растворенных веществ,
- 4. Общая характеристика растворов. Раствор – термодинамически устойчивая гомогенная система переменного состава, состоящая из двух или более
- 5. Классификация растворов 1. По агрегатному состоянию: газообразные, жидкие, твердые. 2. По термодинамическим свойствам: идеальные и неидеальные
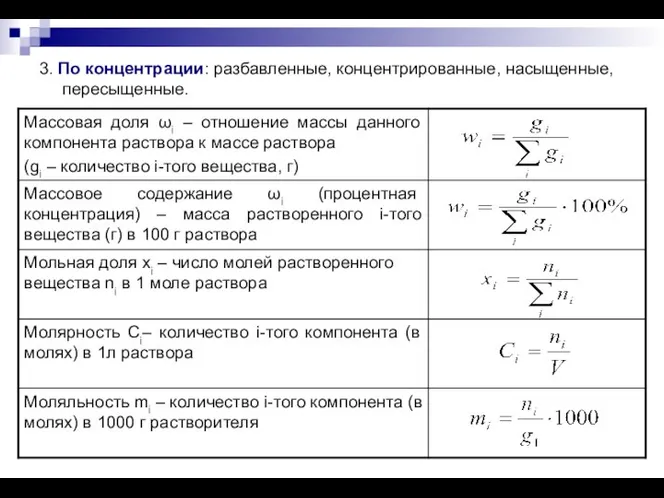
- 6. 3. По концентрации: разбавленные, концентрированные, насыщенные, пересыщенные.
- 7. ПАРЦИАЛЬНЫЕ МОЛЬНЫЕ ВЕЛИЧИНЫ (ПМВ)
- 8. Раствор образован двумя или более компонентами, поэтому все его свойства являются экстенсивными и относятся к раствору
- 9. Парциальная мольная величина отражает изменение какого-либо экстенсивного свойства раствора при добавлении к нему 1 моля i-того
- 11. Свойства ПМВ
- 13. ПМВ первого и второго рода
- 14. Методы определения ПМВ
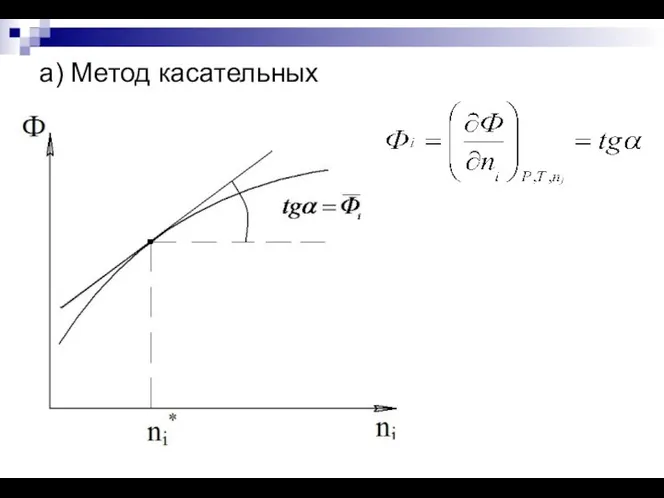
- 15. а) Метод касательных
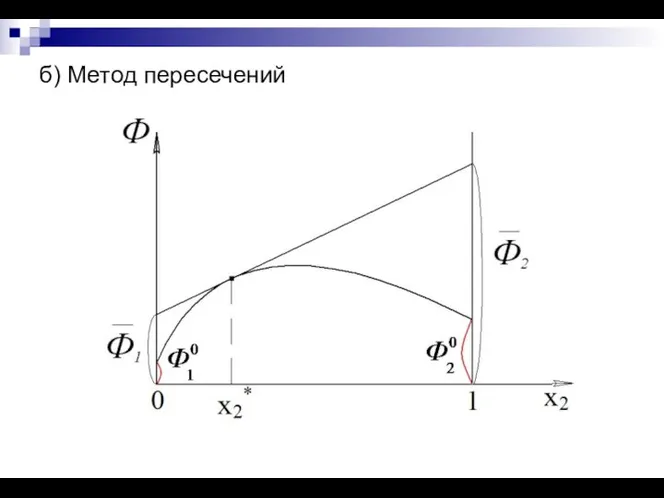
- 16. б) Метод пересечений
- 17. Парциальные мольные величины характеризуют не само свойство, а его изменение, поэтому в отличие от мольных величин
- 18. Уравнение Гиббса-Дюгема
- 21. Скачать презентацию















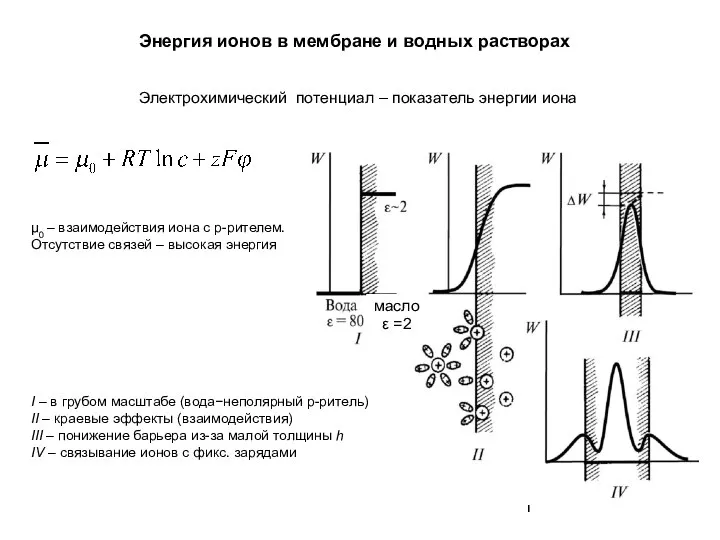 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Строение вещества. Молекулы
Строение вещества. Молекулы Поверхностные явления
Поверхностные явления Лужні метали. Фізичні та хімічні властивості простих речовин. Біологічна роль елементів.
Лужні метали. Фізичні та хімічні властивості простих речовин. Біологічна роль елементів.  Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Реакции ионного обмена
Реакции ионного обмена Основные способы получения металлов
Основные способы получения металлов Общая характеристика аргона
Общая характеристика аргона Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23)
Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23) Презентация по Химии "Отбеливатели" - скачать смотреть
Презентация по Химии "Отбеливатели" - скачать смотреть  Презентация по Химии "Пероксид водорода" - скачать смотреть
Презентация по Химии "Пероксид водорода" - скачать смотреть  Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов
Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов Методы разделения и концентрирования
Методы разделения и концентрирования Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть
Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть  Презентация урока по химии и окружающему миру учителя МБОУ СО школы №11 г. Новочеркасска Ростовской области Ивановой Н
Презентация урока по химии и окружающему миру учителя МБОУ СО школы №11 г. Новочеркасска Ростовской области Ивановой Н Коллигативные свойства растворов
Коллигативные свойства растворов Цветные металлы
Цветные металлы Строение атома водорода
Строение атома водорода Железо и его соединения
Железо и его соединения Нітрати – токсичні речовини
Нітрати – токсичні речовини  Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Малоугловое рассеяние нейтронов и рентгеновских лучей в исследованиях золь-гель материалов
Малоугловое рассеяние нейтронов и рентгеновских лучей в исследованиях золь-гель материалов Химическая связь
Химическая связь Щелочные металлы
Щелочные металлы Мел - полезное ископаемое моего села
Мел - полезное ископаемое моего села Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования