Содержание
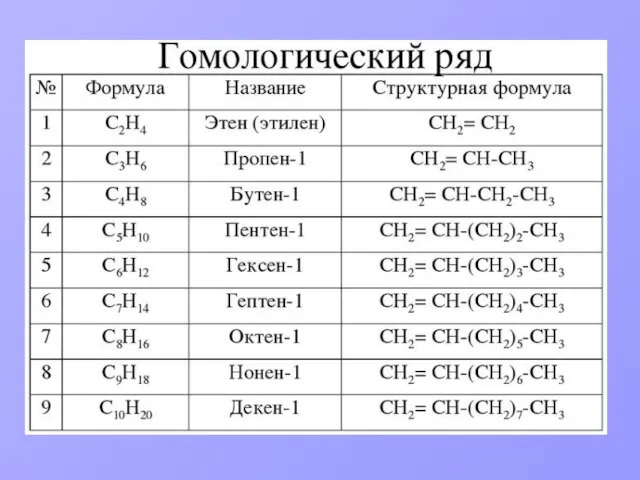
- 2. ПЛАН Определение. Общая формула класса углеводородов. Гомологический ряд. Виды изомерии. Номенклатура. Строение молекулы. Физические свойства. Способы
- 3. Алкены – ациклические углеводороды, в молекуле которых кроме одинарных связей содержится одна двойная связь между атомами
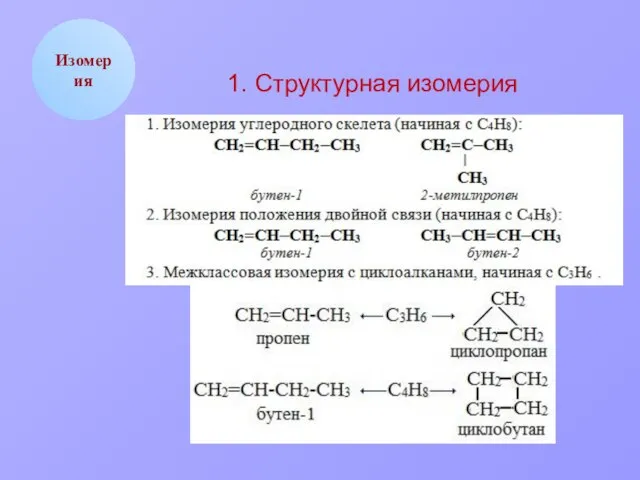
- 5. Изомерия 1. Структурная изомерия
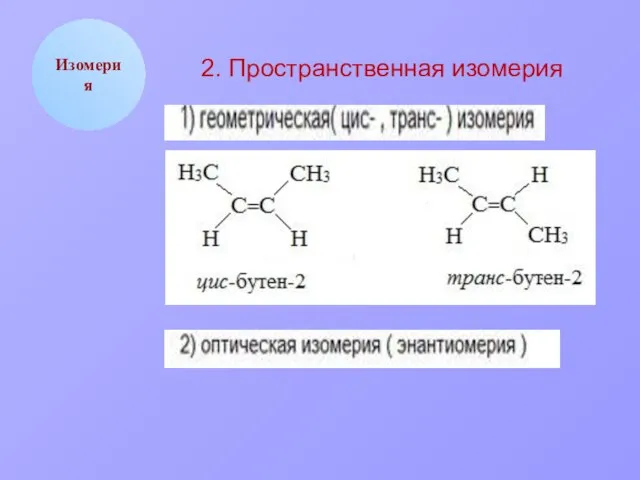
- 6. Изомерия 2. Пространственная изомерия
- 7. Н С Номенклатура 1. Выбор главной цепи. Н Н3 С С С С С СН3 Н
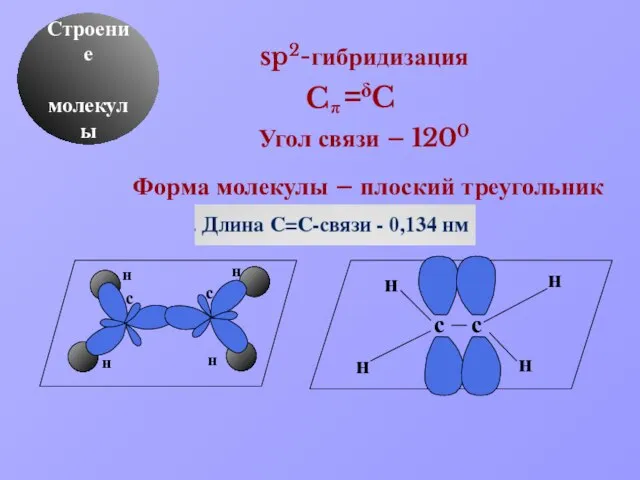
- 8. δ Строение молекулы sp2-гибридизация Угол связи – 1200 Форма молекулы – плоский треугольник C π C
- 9. Физические свойства
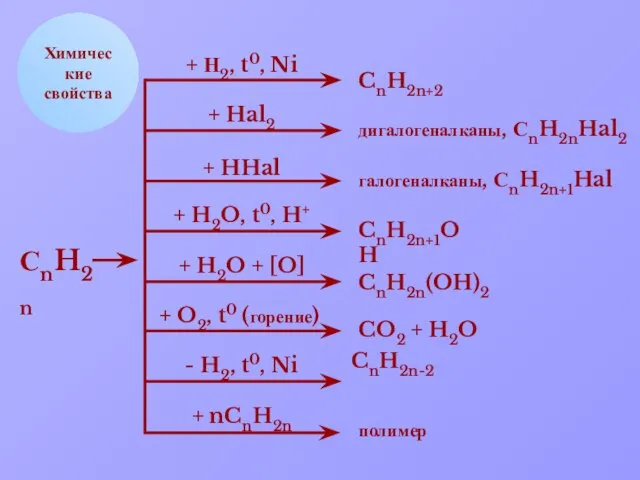
- 10. Химические свойства + Н2, t0, Ni + Hal2 + HHal + H2O, t0, H+ + H2O
- 11. СН ОН 4. Гидратация: Pt, t Химические свойства алкенов 1. Гидрирование: СН2 СН2 + Н2 СН3
- 12. Получение
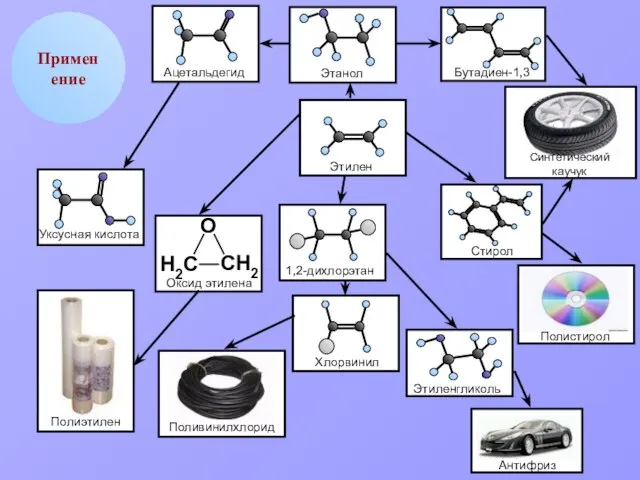
- 14. Применение
- 16. Скачать презентацию







 Физико-химические свойства газов
Физико-химические свойства газов Пены. Пенообразование
Пены. Пенообразование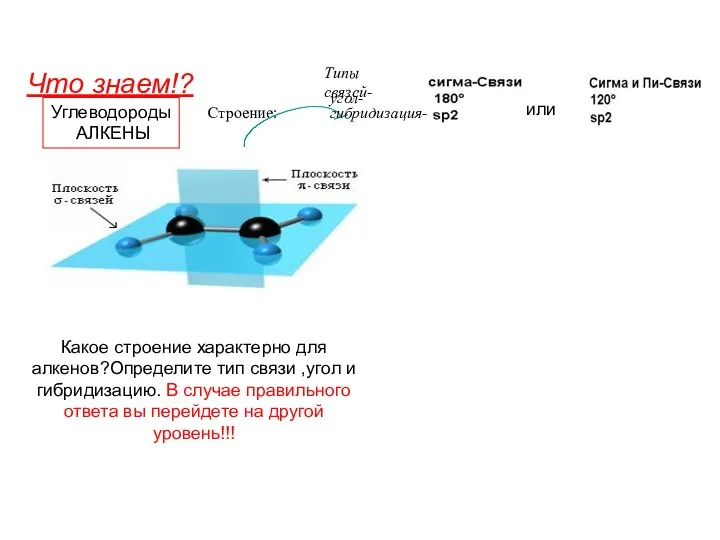 Углеводороды. Алкены
Углеводороды. Алкены Тема: Неметаллы
Тема: Неметаллы Презентация по Химии "Периодическая система химических элементов" - скачать смотреть
Презентация по Химии "Периодическая система химических элементов" - скачать смотреть  Химические реакции. Закон сохранения массы веществ
Химические реакции. Закон сохранения массы веществ «Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія
«Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія  Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Свойства растворов ВМС
Свойства растворов ВМС Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Химическая промышленность. Создание пигментов
Химическая промышленность. Создание пигментов Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Правила ориентации в монозамещённых и дизамещённых ароматических углеводородах
Правила ориентации в монозамещённых и дизамещённых ароматических углеводородах Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599
Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599 Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика Алкины. 10 класс
Алкины. 10 класс Сними с полки банку с горючей жидкостью
Сними с полки банку с горючей жидкостью Поверхностно-активные полимеры. Лекция 10
Поверхностно-активные полимеры. Лекция 10 Оксиды азота.
Оксиды азота. Акцепторы катионов. Криптанды. Cферанды
Акцепторы катионов. Криптанды. Cферанды Самородные элементы. Сера, ртуть
Самородные элементы. Сера, ртуть Аргентум, или серебро
Аргентум, или серебро Лекция 4. Химическая термодинамика
Лекция 4. Химическая термодинамика “TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі
“TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі Інсектициди для захисту сливи та персеку
Інсектициди для захисту сливи та персеку Физические и химические свойства воды
Физические и химические свойства воды Чистые вещества и смеси. Методы разделения и очистки веществ
Чистые вещества и смеси. Методы разделения и очистки веществ Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака