Содержание
- 2. Количество водяных паров в воздухе зависит от температуры воздуха и степени его насыщения. Принято различать влажность
- 3. Для определения влажности применяются фотоэлектронные индикаторы влажности 8Ш-31 и 15Ш-26М, гигрометры Г-2, которые позволяют непосредственно найти
- 4. Работа прибора. Продуть в течение 10 мин чистым воздухом под давлением не менее 120 кгс/см2 подходящие
- 5. Абсолютную влажность находят по таблицам, если известна точка росы, или вычисляют через относительную влажность. Пример 1.
- 6. Кислород Кислород О2 — самый распространенный элемент на Земле. В свободном состоянии кислород находится в атмосферном
- 7. Водород Водород Н2 в обычных условиях — газ без цвета, запаха и вкуса. Водород в 14,5
- 8. Углекислый газ Углекислый газ СО2, называемый в химии двуокисью углерода или ангидридом угольной кислоты, при нормальных
- 10. Скачать презентацию
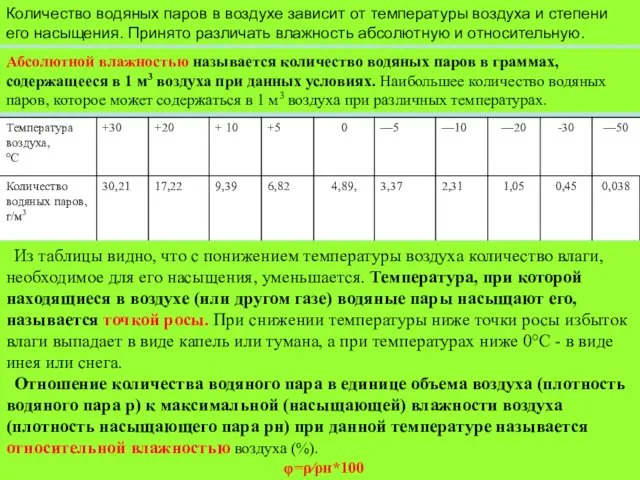
Количество водяных паров в воздухе зависит от температуры воздуха и степени
Количество водяных паров в воздухе зависит от температуры воздуха и степени
Абсолютной влажностью называется количество водяных паров в граммах, содержащееся в 1 м3 воздуха при данных условиях. Наибольшее количество водяных паров, которое может содержаться в 1 м3 воздуха при различных температурах.
Из таблицы видно, что с понижением температуры воздуха количество влаги, необходимое для его насыщения, уменьшается. Температура, при которой находящиеся в воздухе (или другом газе) водяные пары насыщают его, называется точкой росы. При снижении температуры ниже точки росы избыток влаги выпадает в виде капель или тумана, а при температурах ниже 0°С - в виде инея или снега.
Отношение количества водяного пара в единице объема воздуха (плотность водяного пара р) к максимальной (насыщающей) влажности воздуха (плотность насыщающего пара рн) при данной температуре называется относительной влажностью воздуха (%).
φ=ρ⁄ρн*100
Для определения влажности применяются фотоэлектронные индикаторы влажности 8Ш-31 и 15Ш-26М, гигрометры
Для определения влажности применяются фотоэлектронные индикаторы влажности 8Ш-31 и 15Ш-26М, гигрометры
Этот прибор предназначен для непрерывного и периодического контроля влагосодержания воздуха и работает как в режиме «контроль», так и в режиме «измерение». Прибор может эксплуатироваться при температуре окружающей среды от
—40 до +50°С. Билет-39
Работа прибора. Продуть в течение 10 мин чистым воздухом под давлением
Работа прибора. Продуть в течение 10 мин чистым воздухом под давлением
Установить шкалу температуры реохорда в положение +35°С и прогреть прибор в течение 10 мин. Когда температура на шкале реохорда при его вращении станет выше температуры зеркала, загорается лампа «Подогрев» и одна из сигнальных ламп «Влажный» или «Сухой». Нажать кнопку «Проверка нуля» и вращением ручки потенциометра установить стрелку миллиамперметра «на нуль».
Открыть запорный вентиль в подводящей магистрали и вентиль «Расход контролируемого газа».
Работа на приборе в режиме «Контроль». Этот вид работ выполняется, когда задана точка росы.
Замер влажности воздуха в режиме «Измерение». Для выполнения этих работ необходимо тумблер «Контроль — измерение» поставить в положение «Измерение», а вращением ручки реохорда «Температура зеркала» удерживать стрелку миллиамперметра на нуле. В момент начала выпадения росы загорится контрольная лампа «Влажный», а положение шкалы реохорда покажет точку росы воздуха. После окончания работ необходимо закрыть вентиль «Давление над зеркалом» и плавно открыть вентиль «Расход контролируемого газа». В этом случае давление по правому манометру понижается до нуля, что указывает на отсутствие давления в измерительной головке прибора. Тумблером «Сеть» выключить прибор.
Абсолютную влажность находят по таблицам, если известна точка росы, или вычисляют
Абсолютную влажность находят по таблицам, если известна точка росы, или вычисляют
Пример 2. Относительная влажность воздуха равна 0,85 при температуре 25° С. Найти содержание влаги в 1 м3 воздуха. Решение. Из табл. 2 находим, что при температуре 25° С для насыщения 1 м3 воздуха требуется 22,03 г влаги. Следовательно, абсолютная влажность = 22,03-0,85=18,7 г/м3.
Количество механических примесей в воздухе непостоянно от 0,005 до 0,01 г/м3.
Масса 1 м3 воздуха при 0°С и давлении 0,1 МПа (760 мм рт. ст.) равна 1,293 кг. Средний молекулярный вес равен 29. Теплоемкость, т. е. количество тепла, необходимое для нагревания 1 кг воздуха на 1°, измеряется в Дж/К.
В международной системе единиц СИ (система интернациональная) за единицу количества теплоты принят джоуль (Дж), равный работе, произведенной силой в 1 ньютон (Н) при перемещении точки ее приложения на 1 м.
При пересчете количества теплоты из одной системы единиц в другую принимаем:
1 ккал = 1000 кал = 4186,8 Дж = 4,187 кДж;
1 Дж 1/4,187=0,24 кал = 0,00024 ккал; 1 кДж = 0,24 ккал.
При постоянном объеме удельная теплоемкость
Су = 0,72КДж/кг-К = 0,172ккал/кг*°С
При постоянном давлении
су = 1,009 КДж/кг-К = 0,241 ккал/кг*°С
Воздух при температуре —140,6° С и ниже может находиться в жидком состоянии, при этом давление должно быть не менее 3,84 МПа (38,4 кгс/см2). Эта температура называется критической температурой воздуха, а соответствующее ей наименьшее давление 3,84 МПа — критическим давлением. При давлении 0,1 МПа (760 мм рт. ст.) температура начала кипения воздуха равна —194,4° С, а начала конденсации — 192°С. Воздух используется как сырье в установках, добывающих кислород и азот.
Кислород
Кислород О2 — самый распространенный элемент на Земле. В свободном состоянии
Кислород
Кислород О2 — самый распространенный элемент на Земле. В свободном состоянии
Горючие газы (ацетилен, водород, метан и другие) образуют с кислородом взрывчатые смеси. Различного рода жиры и масла при соприкосновении со сжатым кислородом способны самовоспламеняться. Пористые горючие вещества (уголь, угольная пыль, торф), пропитанные жидким кислородом, при воспламенении в замкнутом пространстве дают взрыв большой силы.
Кислородное дутье находит все более широкое применение в металлургии. при выплавке чугуна и стали. Кислород применяется для резки и сварки. Используется в ракетных двигателях и для огневого бурения твердых пород.
В медицине кислород используют в качестве лечебного и профилактического средства. В авиации кислород широко применяется для обеспечения полетов на больших высотах.
Водород
Водород Н2 в обычных условиях — газ без цвета, запаха и
Водород
Водород Н2 в обычных условиях — газ без цвета, запаха и
Жидкий водород — прозрачная, бесцветная, легко испаряющаяся жидкость, теплота испарения его 452,2 кДж/кг(108 ккал /кг).1л жидкого водорода весит 0,07кг.
Горит. В смеси с кислородом образует гремучий газ, самовозгораться.
Водород преобладает в составе атмосферы звезд и Солнца (до 84%), Содержание водорода в земной коре составляет 1%, в составе воды — 11,2% (по весу). Водород легко диффундирует (проникает) через фарфор, каучук, резину. Водород применяется для наполнения аэростатов и аппаратов легче воздуха. В метеорологической службе он применяется для наполнения шаров-пилотов при наблюдении за движением атмосферных слоев воздуха. Водород используется для сварки и плавки металлов. Кислородно-водородное пламя служит для пайки свинца, платины и кварца. С помощью водорода осуществляется восстановление окислов металлов при получении молибдена, вольфрама и других тугоплавких металлов.
В химической промышленности применяется для получения аммиака, метилового спирта, в реакциях восстановления и т. п. Водород обладает высокой теплопроводностью применяют его для охлаждения турбин.
Углекислый газ
Углекислый газ СО2, называемый в химии двуокисью углерода или ангидридом
Углекислый газ
Углекислый газ СО2, называемый в химии двуокисью углерода или ангидридом
Он не горит и не поддерживает горения. Широко применяется как огнегасительное средство характеризуется следующими данными: при концентрации 6—12% С02 в воздухе открытое пламя гаснет, а при 30% —прекращается тление.






 Цикл трикарбоновых кислот (цикл Кребса)
Цикл трикарбоновых кислот (цикл Кребса) Биосфера и организм
Биосфера и организм Птерин және изоаллоксазин туындыларының дәрілік препараттарын талдау
Птерин және изоаллоксазин туындыларының дәрілік препараттарын талдау Химические реакции
Химические реакции Як захистити себе від нітратів
Як захистити себе від нітратів  SVOJSTVA (1)
SVOJSTVA (1) Химическая связь
Химическая связь Тяжелосредные гидроциклоны
Тяжелосредные гидроциклоны Пластмассы или пластики
Пластмассы или пластики Презентация по Химии "История семи великих камней Алмазного фонда России" - скачать смотреть
Презентация по Химии "История семи великих камней Алмазного фонда России" - скачать смотреть  Ionimplantáció. Monolit technika előadás
Ionimplantáció. Monolit technika előadás Биохимия соединительной ткани
Биохимия соединительной ткани Фестиваль исследовательских и творческих работ учащихся «Портфолио» «Создание экспертной системы распознавания минеральных у
Фестиваль исследовательских и творческих работ учащихся «Портфолио» «Создание экспертной системы распознавания минеральных у Гідроліз солей
Гідроліз солей Види аналізів – мікрохімічний, люмінесцентний, хімічний
Види аналізів – мікрохімічний, люмінесцентний, хімічний Окисно-відновні процеси
Окисно-відновні процеси Реакции, протекающие между ионами, называются ионными реакциями
Реакции, протекающие между ионами, называются ионными реакциями Теория и практика решения задач высокого уровня сложности в процессе обучения химии
Теория и практика решения задач высокого уровня сложности в процессе обучения химии Вакуумная перегонка мазута
Вакуумная перегонка мазута Летучие яды
Летучие яды Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Дать характеристику новому классу органических веществ
Дать характеристику новому классу органических веществ  Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки
Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки Природный газ
Природный газ АМІНИ
АМІНИ  Логическая структура модуля по дисциплине "Аналитическая химия"
Логическая структура модуля по дисциплине "Аналитическая химия" Аттестационная работа. Программа кружка по химии «Юный химик»
Аттестационная работа. Программа кружка по химии «Юный химик»