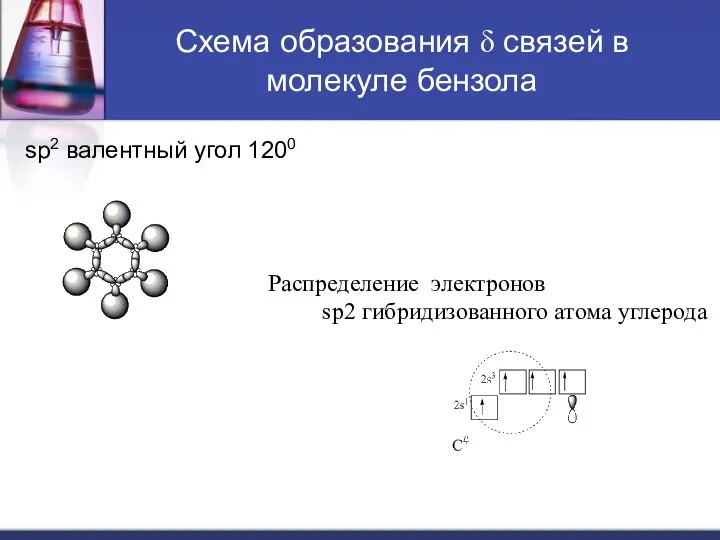
У каждого sp2 гибридизованного атома углерода остаётся один не спаренный гибридный
p-электрон (имеющий форму ) эти шесть p-электронов взаимно перекрываясь над плоскостью и под плоскостью δ-связи образуют единуюp-молекулярную орбиталь.
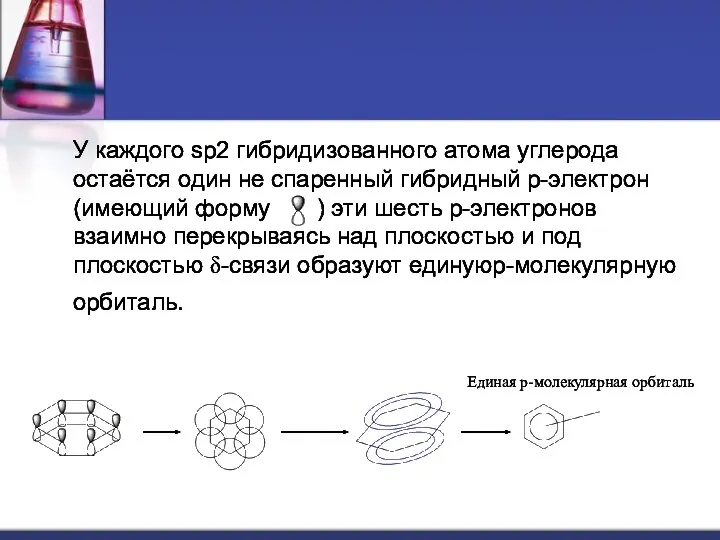
Единая p-молекулярная орбиталь
У каждого sp2 гибридизованного атома углерода остаётся один не спаренный гибридный p-электрон (имеющий форму ) эти шесть p-электронов взаимно перекрываясь над плоскостью и под плоскостью δ-связи образуют единуюp-молекулярную орбиталь.
У каждого sp2 гибридизованного атома углерода остаётся один не спаренный гибридный p-электрон (имеющий форму ) эти шесть p-электронов взаимно перекрываясь над плоскостью и под плоскостью δ-связи образуют единуюp-молекулярную орбиталь.
У каждого sp2 гибридизованного атома углерода остаётся один не спаренный гибридный p-электрон (имеющий форму ) эти шесть p-электронов взаимно перекрываясь над плоскостью и под плоскостью δ-связи образуют единуюp-молекулярную орбиталь.
Единая p-молекулярная орбиталь
Единая p-молекулярная орбиталь


 Распределение молекул в системе по энергиям при разных температурах
Распределение молекул в системе по энергиям при разных температурах Электротехнический фарфор – разновидность твердого фарфора
Электротехнический фарфор – разновидность твердого фарфора Особенности строения, реакционной способности и методы синтеза алкенов
Особенности строения, реакционной способности и методы синтеза алкенов Биохимические и физико-химические процессы при производстве молочных продуктов
Биохимические и физико-химические процессы при производстве молочных продуктов Пищевые жиры
Пищевые жиры  Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»
Презентация на тему «Металлы и сплавы в моей профессии. Антикоррозийные покрытия»  Про шкідливість побутової хімії
Про шкідливість побутової хімії  Железо Fe
Железо Fe Побутові хімікати Підготував
Побутові хімікати Підготував  Презентация по Химии "Посвящение в химики" - скачать смотреть
Презентация по Химии "Посвящение в химики" - скачать смотреть  Омыляемые Липиды
Омыляемые Липиды Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Презентация по Химии "Соли, их состав и названия" - скачать смотреть
Презентация по Химии "Соли, их состав и названия" - скачать смотреть  Метод окислительно-восстановительного титрования
Метод окислительно-восстановительного титрования Биологическая роль и строение углеводов
Биологическая роль и строение углеводов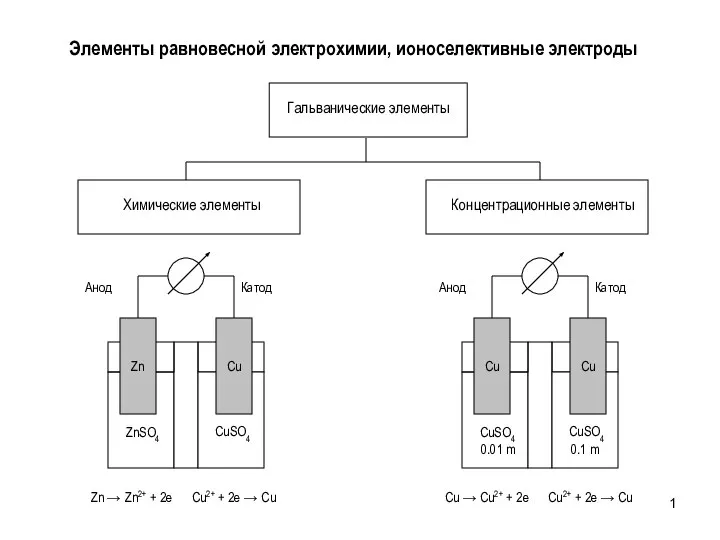 Элементы равновесной электрохимии, ионоселективные электроды
Элементы равновесной электрохимии, ионоселективные электроды Наблюдения в сходящемся свете. Коноскопия
Наблюдения в сходящемся свете. Коноскопия Механизмы нейропротекторного действия уабаина при эксайтотоксическом стрессе в нейронах коры крыс
Механизмы нейропротекторного действия уабаина при эксайтотоксическом стрессе в нейронах коры крыс Автометаморфизм
Автометаморфизм Лабораторная посуда и оборудование
Лабораторная посуда и оборудование Иониты и цеолиты. Цеолитные катализаторы
Иониты и цеолиты. Цеолитные катализаторы Урок – сказка Первоначальные сведения о строении вещества
Урок – сказка Первоначальные сведения о строении вещества Аттестационная работа. Методическая разработка защиты проекта по исследовательской работе Выращивание кристалла
Аттестационная работа. Методическая разработка защиты проекта по исследовательской работе Выращивание кристалла Системы трансдукции сигнала при ответе на феромоны и другие соединения межорганизменного взаимодействия. (Лекция 2)
Системы трансдукции сигнала при ответе на феромоны и другие соединения межорганизменного взаимодействия. (Лекция 2) Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть
Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть  Гидрирование альдегидов и кетонов
Гидрирование альдегидов и кетонов Окислительное фосфорилирование
Окислительное фосфорилирование Дека́н (н-декан) — органическое соединение класса алканов
Дека́н (н-декан) — органическое соединение класса алканов