Содержание
- 2. Учебная цель: изучить способы получения, химические свойства и применение алкенов на примере непредельного углеводорода - этилена
- 3. Эпиграф к уроку «Границ научному познанию и предсказанию предвидеть невозможно» Д.И.Менделеев
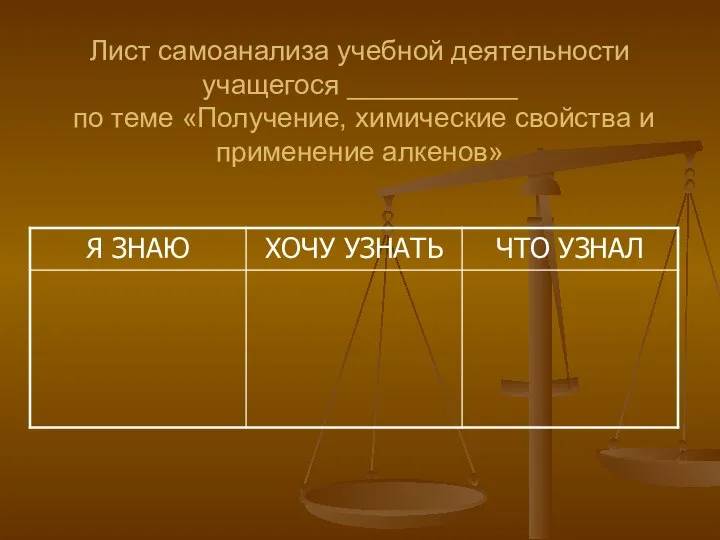
- 4. Лист самоанализа учебной деятельности учащегося ___________ по теме «Получение, химические свойства и применение алкенов»
- 5. Ответьте, пожалуйста, на следующие вопросы: Какие углеводороды называются алкенами? Какова общая формула алкенов? Какова структурная формула
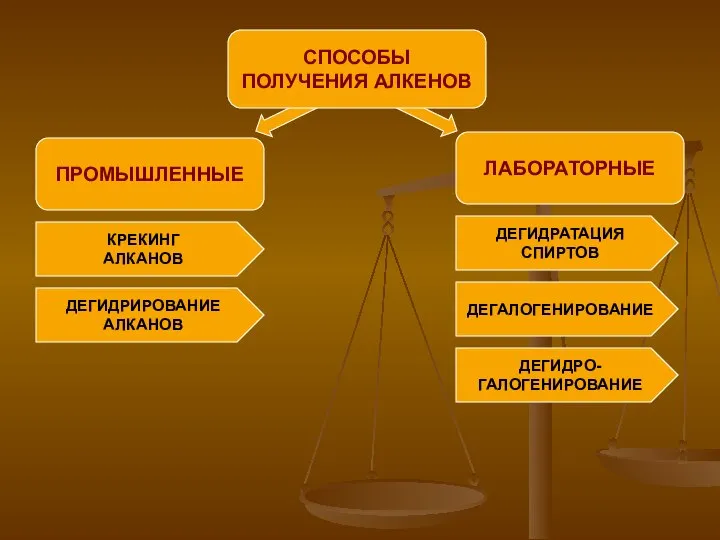
- 6. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
- 7. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ
- 8. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3
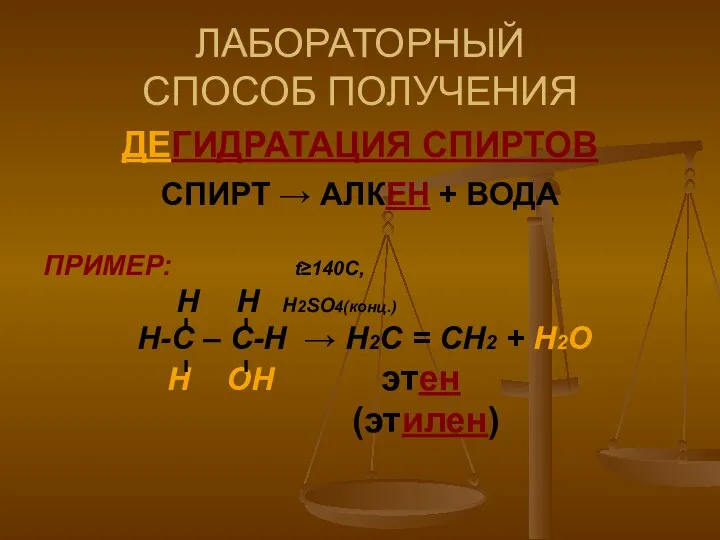
- 9. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С
- 10. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 +
- 11. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl
- 12. СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 13. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен
- 14. РЕАКЦИИ ОКИСЛЕНИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2С2Н6 + 7О2 4СО2 + 6Н2О
- 15. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] +
- 16. Применение этилена
- 18. СИНКВЕЙН 1 строка – имя существительное (тема синквейна) 2 строка – два прилагательных (раскрывающие тему синквейна)
- 19. Этилен Ненасыщенный, активный Горит, обесцвечивает, присоединяет Этилен – представитель непредельных углеводородов Алкен
- 20. ДОМАШНЕЕ ЗАДАНИЕ Оценка «3»: параграф 4, ТПО стр. 24-25, № 5-7 Оценка «4»: Хомченко И.Г.: 20.21
- 22. Скачать презентацию
















 Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Использование нефтепродуктов
Использование нефтепродуктов Определение содержания агрессивных ионов в атмосфере при проведении коррозионных испытаний
Определение содержания агрессивных ионов в атмосфере при проведении коррозионных испытаний Гетероциклические соединения
Гетероциклические соединения Обмен жиров
Обмен жиров Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Кремний и его соединения
Кремний и его соединения Классификация и номенклатура органических соединений. (Лекция 1)
Классификация и номенклатура органических соединений. (Лекция 1) Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Гигиенические нормативы. Химические факторы окружающей среды
Гигиенические нормативы. Химические факторы окружающей среды Обмен липидов
Обмен липидов Радиогеохимия экзогенных процессов
Радиогеохимия экзогенных процессов Капилярлық конденсация. Дәріс 14
Капилярлық конденсация. Дәріс 14 Алкадієни (дiєнові вуглеводні або дiєни)
Алкадієни (дiєнові вуглеводні або дiєни) В мире кристаллов
В мире кристаллов Взаимодействие кислоты с основанием
Взаимодействие кислоты с основанием Витамины. Классификация витаминов
Витамины. Классификация витаминов Термодинамика и термохимия процессов горения и взрыва
Термодинамика и термохимия процессов горения и взрыва Презентация по физике Закон постоянства состава 8 класс
Презентация по физике Закон постоянства состава 8 класс Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Масла и функциональные жидкости
Масла и функциональные жидкости Буровые технологические жидкости для бурения и крепления горизонтальных скважин
Буровые технологические жидкости для бурения и крепления горизонтальных скважин Соли
Соли Алкены. Пропилен (пропен)
Алкены. Пропилен (пропен) Девиз урока: «Зажечь, увлечь и подвести»
Девиз урока: «Зажечь, увлечь и подвести»