Содержание
- 2. Цели: Ознакомиться с гомологическим рядом, изомерией, номенклатурой алкинов. Рассмотреть способы получения ацетилена, изучить физические и химические
- 3. Решите задачу: Массовая доля углерода в УВ равна 92,3%, массовая доля водорода – 7,7 %. Относительная
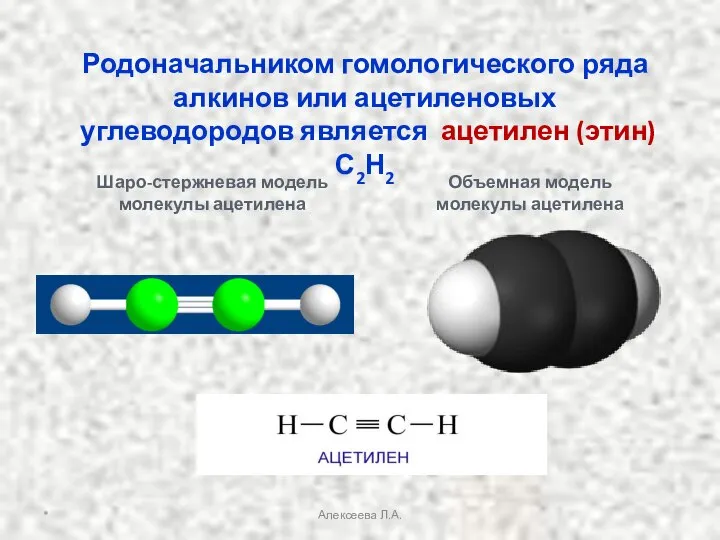
- 4. Родоначальником гомологического ряда алкинов или ацетиленовых углеводородов является ацетилен (этин) С2Н2 Объемная модель молекулы ацетилена Шаро-стержневая
- 5. Схема образования sp -гибридных орбиталей
- 6. Строение алкинов(характеристика тройной связи) Вид гибридизации атома С– sp – III валентное состояние атома углерода Валентный
- 7. Гомологический ряд ацетиленовых углеводородов (алкинов) СН Ξ СН С2Н2 этин, ацетилен СН Ξ С – СН3
- 8. Особенности составления названий алкинов по международной номенклатуре Главная цепь углеродных атомов должна включать в себя тройную
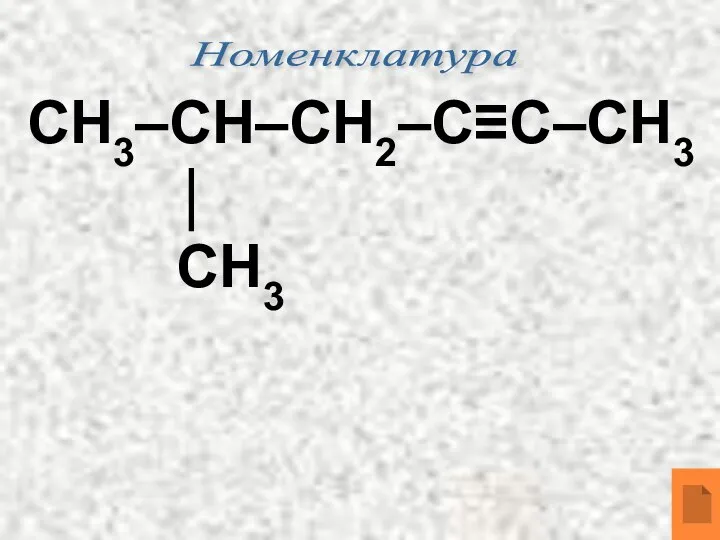
- 9. Номенклатура СН3–СН–СН2–С≡С–СН3 ⏐ СН3
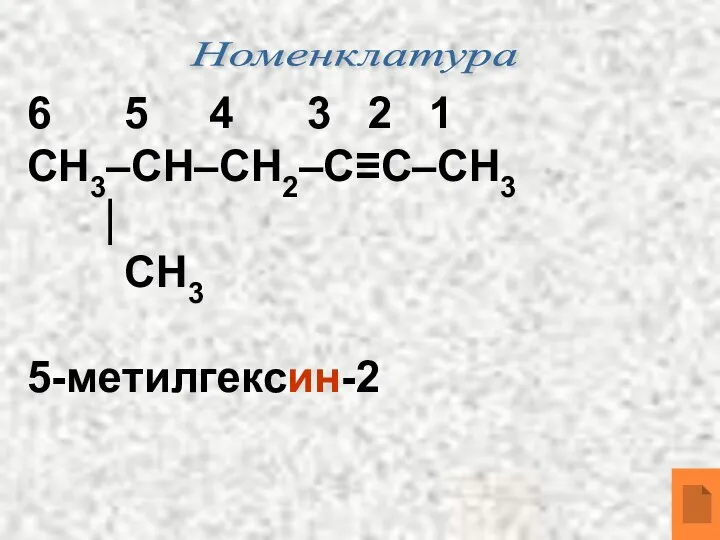
- 10. Номенклатура 6 5 4 3 2 1 СН3–СН–СН2–С≡С–СН3 ⏐ СН3 5-метилгексин-2
- 11. Выполните упражнение: Постройте формулу вещества: 3,3–диметилгексин-1 4-метилпентин-2
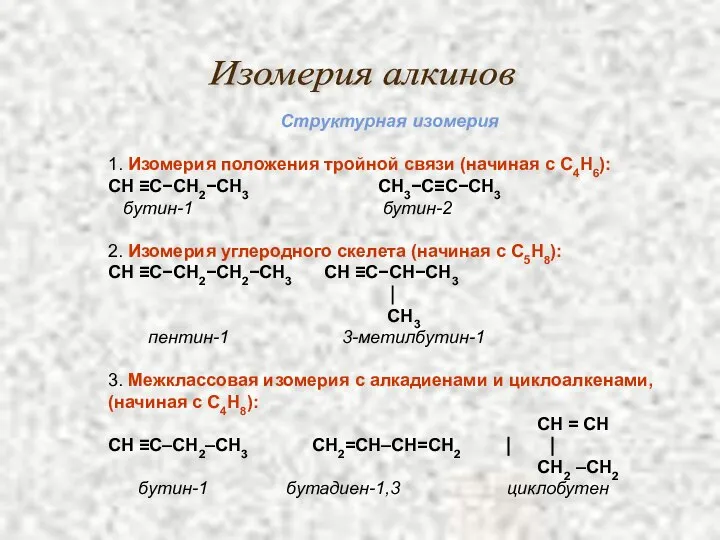
- 12. Изомерия и номенклатура алкинов: Для ацетиленовых углеводородов характерна структурная изомерия: изомерия углеродной цепи изомерия положения кратной
- 13. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
- 14. Выполните задание: 1.Для вещества 3-метилпентин-1 постройте формулы: а) двух гомологов, б) по одному изомеру каждого вида.
- 15. * Алексеева Л.А. Выберите формулы : а) гомологов б) изомеров; дайте названия всем алкинам по современной
- 16. * Алексеева Л.А. Ответ: Названия алкинов по современной номенклатуре Бутин-1 Этин 3,3-диметилбутин-1 Гексин-1 Гексин-2 1) 2)
- 17. Физические свойства При обычных условиях алкины С2Н2 - С4Н6 – газы, С5Н8 - С16Н30 – жидкости,
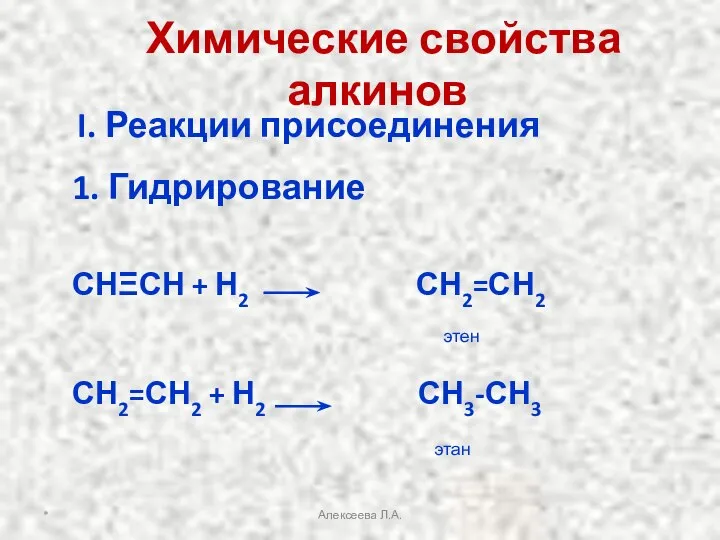
- 18. Химические свойства алкинов I. Реакции присоединения 1. Гидрирование СНΞСН + Н2 СН2=СН2 СН2=СН2 + Н2 СН3-СН3
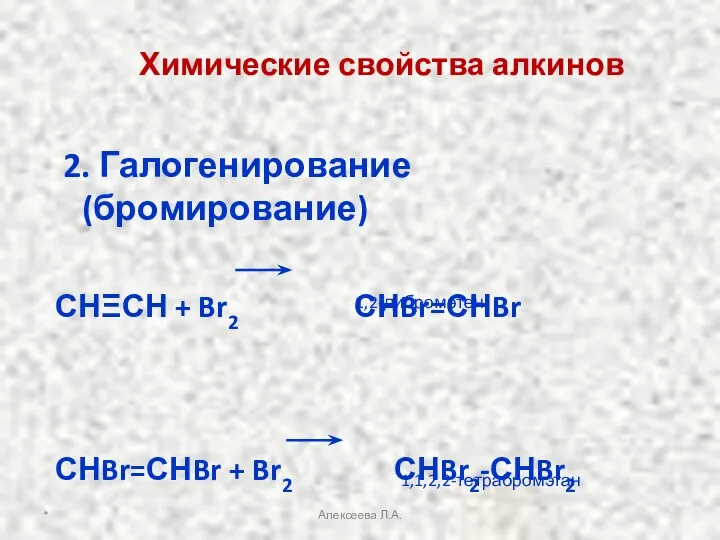
- 19. Химические свойства алкинов 2. Галогенирование(бромирование) СНΞСН + Br2 СНBr=СНBr СНBr=СНBr + Br2 СНBr2-СНBr2 1,2-дибромэтен 1,1,2,2-тетрабромэтан *
- 20. Химические свойства алкинов 3. Гидрогалогенирование СНΞСН + НCl СН2=СНCl nСН2=СНCl (-СН2-СНCl-)n поливинилхлорид Хлорэтен,хлорвинил, винилхлорид * Алексеева
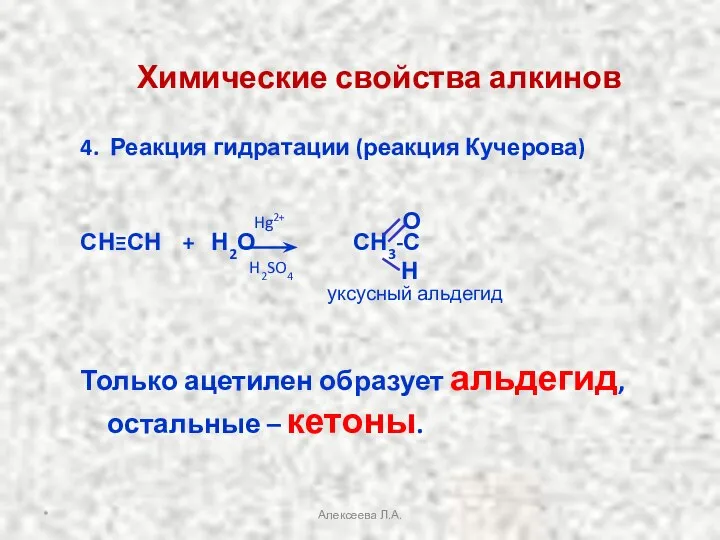
- 21. 4. Реакция гидратации (реакция Кучерова) СНΞСН + Н2О СН3-С Только ацетилен образует альдегид, остальные – кетоны.
- 22. 4. Гидратация (реакция Кучерова) HgSO4 CH3−C≡CH + HOН ⎯→ [CH3−C=CH2 ] → CH3−C−CH3 ⏐ ⏐⏐ OH
- 23. 5.Реакция полимеризации 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
- 24. II. Реакции окисления 1. Горение 2 С2Н2 + 5 О2 4 СО2 + 2 Н2О +
- 25. 2. Ацетилен обесцвечивает водный раствор перманганата калия (качественная реакция на непредельные углеводороды) Химические свойства алкинов *
- 26. Окисление Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 27. III. Реакции замещения При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых
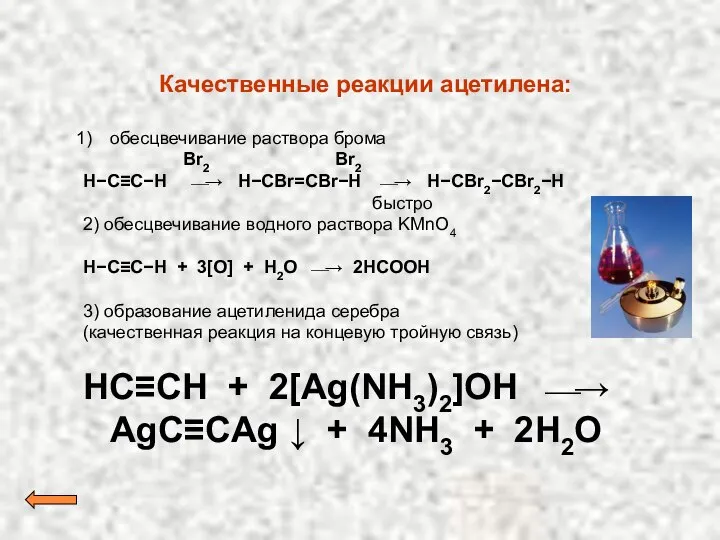
- 28. Качественные реакции ацетилена: обесцвечивание раствора брома Br2 Br2 H−C≡C−H ⎯→ H−CBr=CBr−H ⎯→ H−CBr2−CBr2−H быстро 2) обесцвечивание
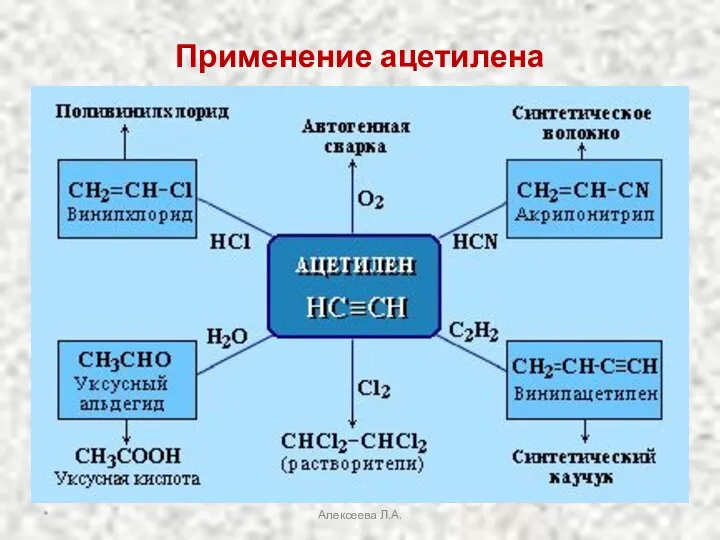
- 29. Применение ацетилена * Алексеева Л.А.
- 30. Способы получения ацетилена 1. Пиролиз метана (природного газа) 2 СН4 С2Н2 + 3 Н2 2. Гидролиз
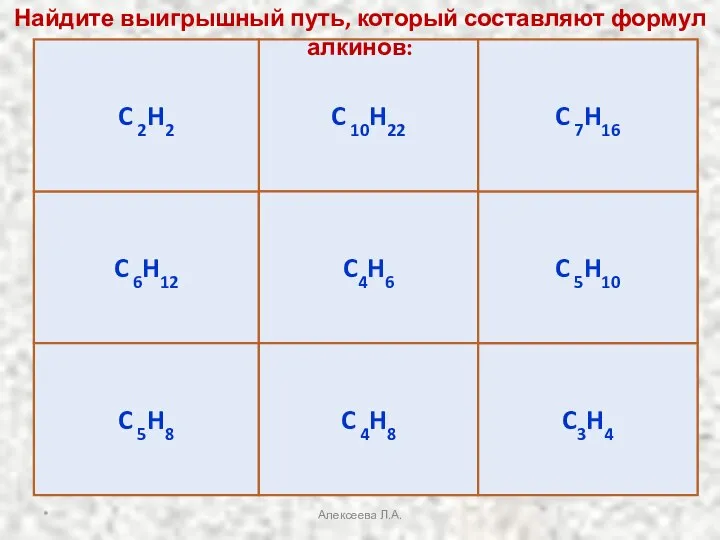
- 31. C 6H12 C 10H22 C4H6 C 5H8 C 4H8 C3H4 C 5H10 C 7H16 C 2H2
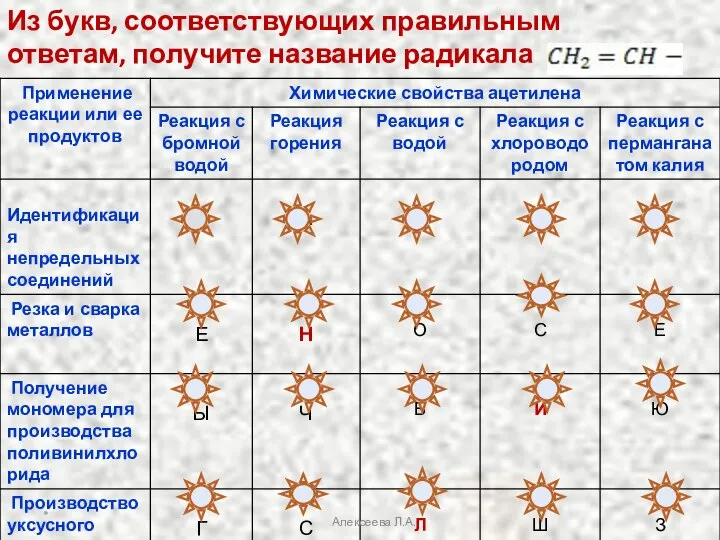
- 32. Из букв, соответствующих правильным ответам, получите название радикала * Алексеева Л.А.
- 33. Ресурсы: http://www.gaz-m.ru/catalog/67-acetilen.html Материалы семинара «Секреты химического мастерства» http://files.school-collection.edu.ru/dlrstore/c8c113f6-5d18-96a2-84ae-aef37fcc8d57/00119627211535778.htm http://school-collection.edu.ru/catalog/rubr/4842a792-b504-427a-53c5-c94cd3e47e34/45283/?interface=pupil&class=53&subject=31 * Алексеева Л.А.
- 34. * Алексеева Л.А. Ответ: Гомологи - 214 2) 1) 4)
- 36. Скачать презентацию













![4. Гидратация (реакция Кучерова) HgSO4 CH3−C≡CH + HOН ⎯→ [CH3−C=CH2 ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/719984/slide-21.jpg)








 Металлоорганические соединения непереходных металлов
Металлоорганические соединения непереходных металлов Производство чугуна. (9 и 11 класс)
Производство чугуна. (9 и 11 класс) Наркозға арналған дәрілер
Наркозға арналған дәрілер Аттестационная работа. Образовательная программа дополнительного образования «Нанотехнологии»
Аттестационная работа. Образовательная программа дополнительного образования «Нанотехнологии» Значення білків, жирів та вуглеводів у харчуванні людини
Значення білків, жирів та вуглеводів у харчуванні людини  Лекарственные и косметические средства из группы ароматических соединений
Лекарственные и косметические средства из группы ароматических соединений Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10)
Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10) История появления новогодней открытки
История появления новогодней открытки  Аналитический контроль качества химических соединений.
Аналитический контроль качества химических соединений. Природные полимеры. Белки и нуклеиновые кислоты
Природные полимеры. Белки и нуклеиновые кислоты Золото. 79-й элемент таблицы
Золото. 79-й элемент таблицы «Природные источники углеводородов и их переработка»
«Природные источники углеводородов и их переработка» Обмен липидов
Обмен липидов Простые и сложные полиэфиры. Пентапласт
Простые и сложные полиэфиры. Пентапласт Классификация витаминов. Витаминоподобные соединения
Классификация витаминов. Витаминоподобные соединения Презентация по химии Синтетические каучуки, строение, свойства, применение.
Презентация по химии Синтетические каучуки, строение, свойства, применение.  Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Массообменные процессы
Массообменные процессы Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения Минералы и их классификация
Минералы и их классификация Композитные материалы
Композитные материалы Аэрированный сшитый полимерный раствор (АСПР)
Аэрированный сшитый полимерный раствор (АСПР) Ароматические эфирные масла и их использование
Ароматические эфирные масла и их использование Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Фосфор – тіршілік пен ақыл – ой элементі
Фосфор – тіршілік пен ақыл – ой элементі Яды
Яды Некоторые примеры использования Ферментов в промышленности
Некоторые примеры использования Ферментов в промышленности Механика полимеров
Механика полимеров