Содержание
- 2. СОДЕРЖАНИЕ Ученые, получившие алюминий Характеристика элемента - алюминия Нахождение в природе Физические свойства Химические свойства Применение
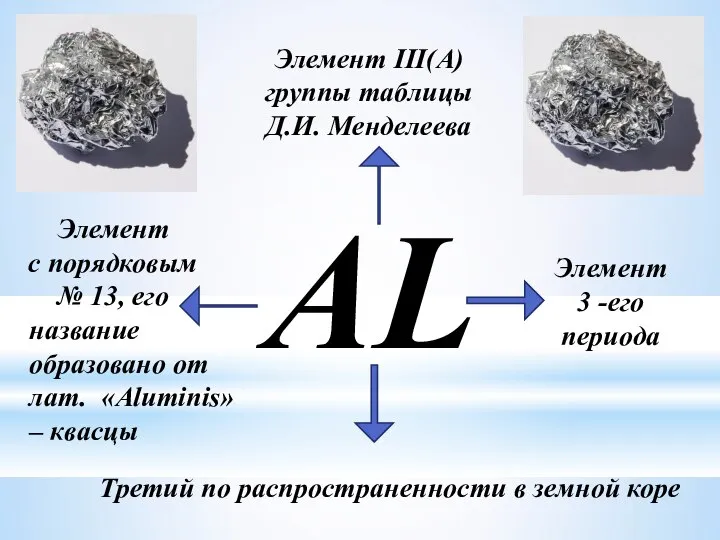
- 3. AL Элемент III(A) группы таблицы Д.И. Менделеева Элемент с порядковым № 13, его Элемент 3 -его
- 4. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 5. Современное получение алюминия Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и
- 6. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 7. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 8. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит Основной химический компонент боксита - глинозем
- 9. Физические свойства мягкий легкий (с малой плотностью – 2,7 г/см3) с высокой тепло- и электропроводностью легкоплавкий
- 10. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 11. Химические свойства 1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 +
- 12. ПРИМЕНЕНИЕ АЛЮМИНИЯ Легкий сплав дюраль используется в различных областях В Авиации В Космической технике В Электротехнике
- 13. Соединения алюминия Оксид алюминия (AL2O3) Гидроксид алюминия AL(OH)3
- 14. Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами Реагирует с щелочами AL2O3 + 6HCL=2ALCL3 +
- 15. AL2O3 Глинозём Корунд сапфир рубин Боксит
- 16. Применение сапфиров знаменитые сапфиры английской королевской семьи
- 17. Применение рубинов
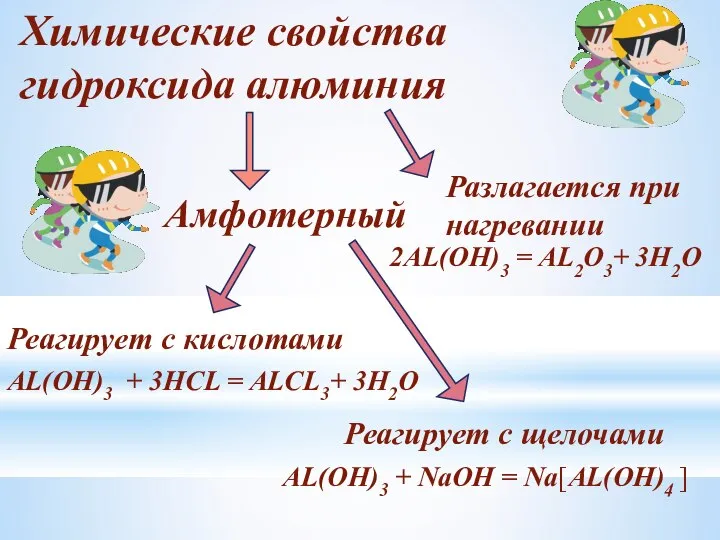
- 18. Химические свойства гидроксида алюминия Амфотерный Реагирует с кислотами Реагирует с щелочами AL(OH)3 + 3HCL = ALCL3+
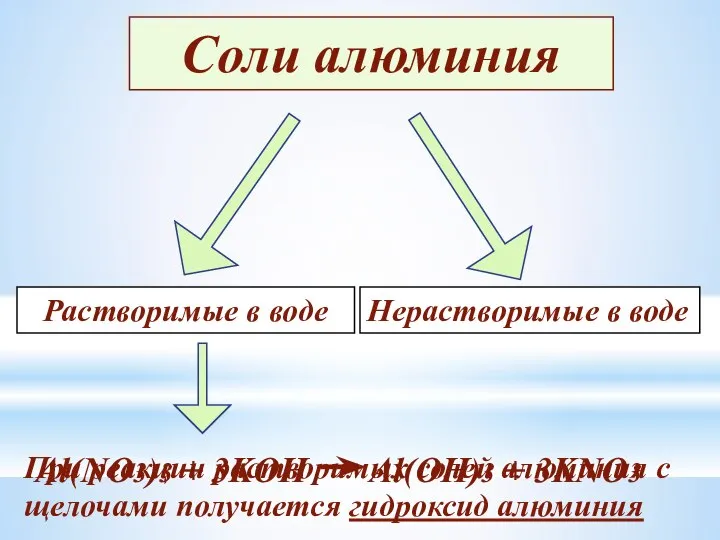
- 19. Соли алюминия Растворимые в воде Нерастворимые в воде При реакции растворимых солей алюминия с щелочами получается
- 20. Вставьте пропущенные слова в текст: Проверьте себя: Алюминий – это металл, у которого в соединениях степень
- 21. Какие из соединений вступят в реакцию с алюминием: Cl2 K2O CuSO4 H2O S BaSO4 HCL Cr
- 23. Скачать презентацию
















 Презентация по Химии "Простые вещества - неметаллы" - скачать смотреть
Презентация по Химии "Простые вещества - неметаллы" - скачать смотреть 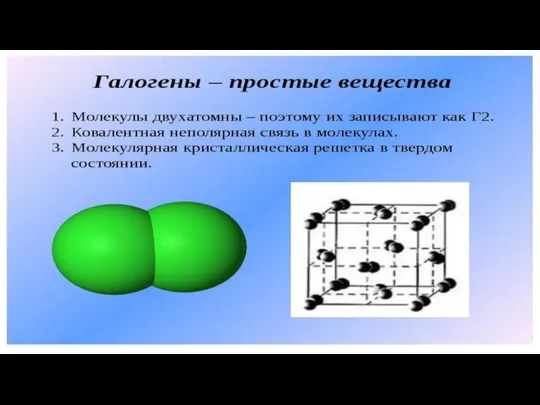 Галогены - простые вещества
Галогены - простые вещества Сульфаты. Лекция 13
Сульфаты. Лекция 13 Совместимость материалов
Совместимость материалов Электроны в кристаллах. Приложения зонной теории
Электроны в кристаллах. Приложения зонной теории Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Химия и сельское хозяйство
Химия и сельское хозяйство Подгруппа мышьяка
Подгруппа мышьяка Аттестационная работа. Связь химии и жизни на примере красок
Аттестационная работа. Связь химии и жизни на примере красок Полудрагоценные камни
Полудрагоценные камни Оксид кремния - это.......
Оксид кремния - это....... Презентация по Химии "Агрегатные состояния вещества" - скачать смотреть
Презентация по Химии "Агрегатные состояния вещества" - скачать смотреть  алгоритм
алгоритм Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно
Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно Карбоновые кислоты
Карбоновые кислоты Оксиды и кислородсодержащие кислоты неметаллов
Оксиды и кислородсодержащие кислоты неметаллов Фосфор
Фосфор Золото
Золото Семь чудес света и роль металлов в их создании
Семь чудес света и роль металлов в их создании Углеводороды
Углеводороды Композиционные материалы
Композиционные материалы Наука плазмохимия
Наука плазмохимия Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Составления электронных и электронно-графических схем строения атома Разработал: учитель химии высшей категории Лебедев Сергей
Составления электронных и электронно-графических схем строения атома Разработал: учитель химии высшей категории Лебедев Сергей  Презентация Поспеловой С.В. учителя химии ГОУ школа №122 Центрального р-на Санкт-Петербурга Алюминий и его соединения
Презентация Поспеловой С.В. учителя химии ГОУ школа №122 Центрального р-на Санкт-Петербурга Алюминий и его соединения Зачем нам нужно стекло
Зачем нам нужно стекло 6 КАЗ Изохинолин туынд
6 КАЗ Изохинолин туынд Количество вещества
Количество вещества