Содержание
- 2. Фосфор: нахождение в природе Одиннадцатый по распространенности элемент в земной коре (~0,112%) В земной коре представлен
- 3. Получение фосфора США – Э. Аубертин, Л. Боблик (1867); усовершенствован Дж. Ридменом. Процесс энергоемкий и требует
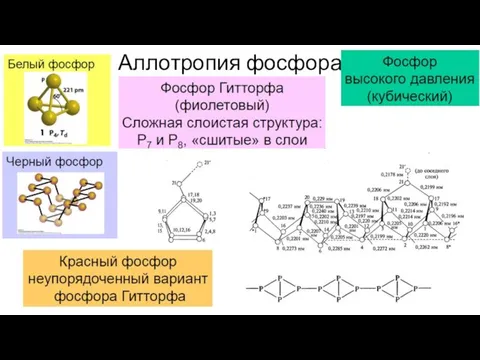
- 4. Аллотропия фосфора
- 5. Белый фосфор (P4) – термодинамическое стандартное состояние (по определению) Белый фосфор (техническое название – желтый фосфор)
- 6. Красный фосфор менее химически активен Красный фосфор может быть получен полимеризацией белого фосфора при его нагревании
- 7. Водородные соединения фосфора Фосфин PH3 Дифосфин P2H4 Полифосфины PnHn и др. P5H5
- 8. Монофосфин (фосфин PH3) Токсичный, химически активный газ со слабым чесночным запахом. Гораздо более слабое основание, чем
- 9. Химические свойства фосфина Основность очень мала, из солей фосфония относительно устойчивы лишь йодид и перхлорат, но
- 10. Фосфиды Классификация фосфидов: 1) Реакционноспособные (ионные) – фосфиды щелочных, щелочноземельных металлов, магния, лантаноидов. Склонны к гидролизу:
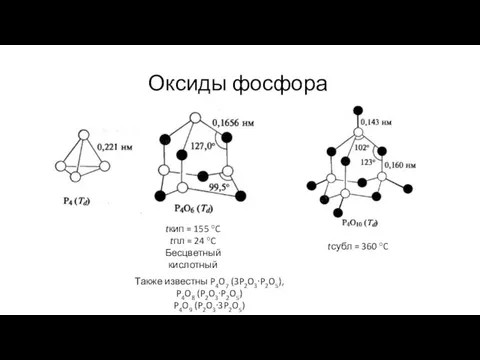
- 11. Оксиды фосфора tкип = 155 °C tпл = 24 °C Бесцветный кислотный tсубл = 360 °C
- 12. P4O6 Получение – контролируемое окисление P4 в атмосфере, содержащей 75% O2 и 25% N2 при давлении
- 13. P4O10 Образуется при сжигании фосфора на воздухе. При быстрой конденсации паров образуется H-форма, состоящая из тетраэдрформы,
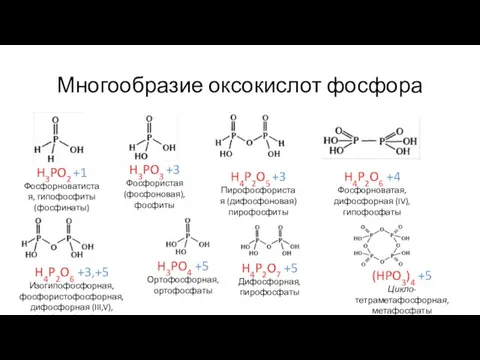
- 14. Многообразие оксокислот фосфора H3PO2 +1 Фосфорноватистая, гипофосфиты (фосфинаты) H3PO3 +3 Фосфористая (фосфоновая), фосфиты H4P2O5 +3 Пирофосфористая
- 15. Все атомы фосфора в оксокислотах имеют координационное число 4 и содержат хотя бы одну связь фосфор−кислород.
- 17. Фосфорноватистая кислота и гипофосфиты Получение раствора кислоты: P4 + 3H2O + 3OH- PH3 + 3H2PO2- (в
- 18. Фосфористая (фосфоновая) кислота В водных растворах равновесие полностью смещено влево. Фосфористая кислота двухосновна (Na2HPO3). Образование второй
- 19. Фосфорные кислоты Ортофосфорная кислота . Не окислитель. Не разлагается в растворах. Трехосновная кислота. Получение: Экстракционная фосфорная
- 20. Соли фосфорных кислот Растворимые соли ортофосфорной кислоты подвержены гидролизу: Na3PO4 – сильнощелочная среда, pH = 12-13
- 21. Галогениды фосфора
- 22. PCl3 – бесцветная, дымящая во влажном воздухе жидкость PCl5 – твердое вещество, склонное к сублимации PCl5
- 23. POCl3 − бесцветная жидкость (tпл = 1,25 °C, tкип = 105,1 °C).
- 25. Скачать презентацию



















 Спирты
Спирты Исследовательская работа. На тему: « Исследование цитрусовых»
Исследовательская работа. На тему: « Исследование цитрусовых» Дикарбоновые кислоты
Дикарбоновые кислоты Простой борный суперфосфат
Простой борный суперфосфат Дисперсные системы: получение и свойства. Часть 2
Дисперсные системы: получение и свойства. Часть 2 Алкины. Свойства, получение и применение
Алкины. Свойства, получение и применение Методы, основанные на индуцированном переходе из одной фазы в другую через разделяющую их третью фазу. (Лекция 7)
Методы, основанные на индуцированном переходе из одной фазы в другую через разделяющую их третью фазу. (Лекция 7) Предмет органической химии. Основные понятия. Лекция 1
Предмет органической химии. Основные понятия. Лекция 1 Презентация Промышленные способы получения металлов
Презентация Промышленные способы получения металлов  Презентація на тему «Основи»
Презентація на тему «Основи»  Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Топлива и их свойства. Топлива автомобилей
Топлива и их свойства. Топлива автомобилей Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Atomic mass
Atomic mass Аминокислоты – структурные единицы белков
Аминокислоты – структурные единицы белков Биологические мембраны
Биологические мембраны Витамины Материал к уроку химии в 10 классе естественнонаучного профиля
Витамины Материал к уроку химии в 10 классе естественнонаучного профиля  Общие сведения о комплексных соединениях
Общие сведения о комплексных соединениях Некрохмалисті полісахариди
Некрохмалисті полісахариди Многоатомные спирты
Многоатомные спирты Термические превращения углеводородов и других компонентов нефти
Термические превращения углеводородов и других компонентов нефти Химия и экология
Химия и экология Склероглюкан
Склероглюкан Анти-краун-эфиры
Анти-краун-эфиры Псевдовідкриття хімічних елементів
Псевдовідкриття хімічних елементів Нитрозный способ получения серной кислоты Мой любимый синтез
Нитрозный способ получения серной кислоты Мой любимый синтез Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС
Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС Аппаратура ионообменных процессов
Аппаратура ионообменных процессов