Содержание
- 2. АЛЮМИНИЙ. нахождение в природе Алюмосиликаты: Глина – Al2O3*nSiO2*mH2O Бокситы – Al2O3*nH2O
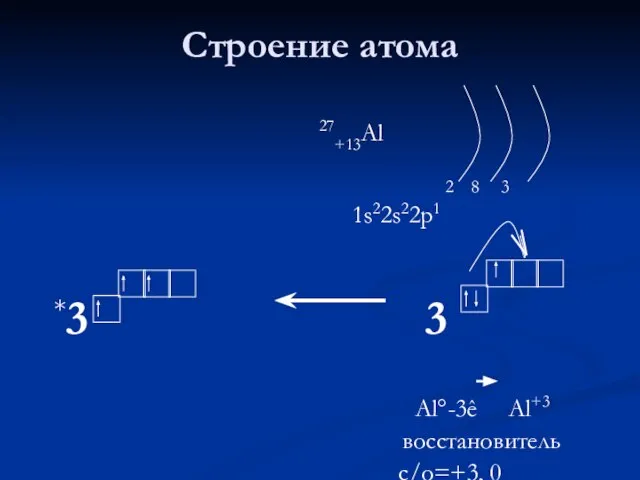
- 3. Строение атома 27+13Al 2 8 3 1s22s22p1 *3 3 Al°-3ê Al+3 восстановитель с/о=+3, 0
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА Al-серебристо-белый металл Мягкий, пластичный (легко вытягивается в проволоку и раскатывается в листы), легкий (плотность
- 5. ХИМИЧЕСКИЕ СВОЙСТВА Al – активный металл. На воздухе всегда покрыт пленкой Al2O3. Поэтому при обычных условиях
- 6. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ При нагревании Взаимодействие с углеродом: 4Al+3C=Al4C3 (1500-1700°C) Взаимодействие с серой: 2Al+3S= Al2S3
- 7. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) Al +H2O=Al(OH)3 +H2 Подберите коэффициенты
- 8. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует
- 9. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует
- 10. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует
- 11. Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4 и HNO3
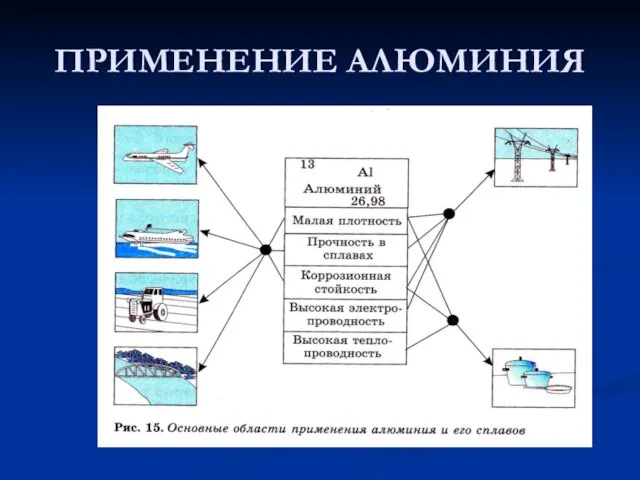
- 12. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 13. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 14. Домашнее задание § 13 (до соединений алюминия) Работа с текстом конспекта Подберите коэффициенты методом электронного баланса:
- 16. Скачать презентацию











 Презентация Углекислый газ 9 класс
Презентация Углекислый газ 9 класс Газ ацетилен
Газ ацетилен Горные породы
Горные породы Защита полимеров от старения
Защита полимеров от старения Нефть и способы её переработки
Нефть и способы её переработки Введение в кристаллографию
Введение в кристаллографию Анаэробный обмен углеводов (Лекция №8)
Анаэробный обмен углеводов (Лекция №8) Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно
Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно педагогический стаж -11 лет, год окончания вуза - 2000, вуз - Бирский государственный педагогический институт, факультет -биолого
педагогический стаж -11 лет, год окончания вуза - 2000, вуз - Бирский государственный педагогический институт, факультет -биолого Алюминий и его соединения
Алюминий и его соединения Методика решения части С2 ГИА 9 класс
Методика решения части С2 ГИА 9 класс Оксид фосфора
Оксид фосфора Хімічна промисловість
Хімічна промисловість  Виды проб. Отбор проб твердых, жидких и газообразных продуктов из различного вида тары. Хранение проб
Виды проб. Отбор проб твердых, жидких и газообразных продуктов из различного вида тары. Хранение проб Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма
Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид
Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид Теория переходного состояния. Эйринг, Эванс, Поляни. (Лекция 5)
Теория переходного состояния. Эйринг, Эванс, Поляни. (Лекция 5) Застосування електролізу
Застосування електролізу Презентация по Химии "Спирт" - скачать смотреть бесплатно
Презентация по Химии "Спирт" - скачать смотреть бесплатно Каменный уголь. Химический состав каменного угля
Каменный уголь. Химический состав каменного угля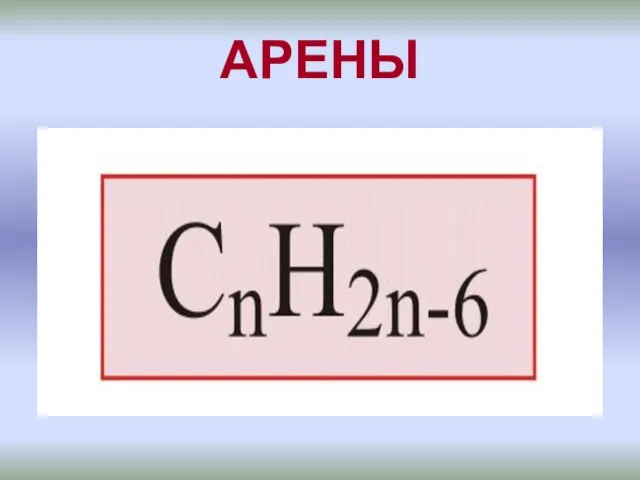 Бензоидные ароматические углеводороды - арены
Бензоидные ароматические углеводороды - арены Презентация тест по химии
Презентация тест по химии Обмен липидов
Обмен липидов Материаловедение. Текстильные волокна, пряжа и ткань
Материаловедение. Текстильные волокна, пряжа и ткань Галогены. Способы получения, применение
Галогены. Способы получения, применение Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элеме
Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элеме Урок – КВН «Подгруппа углерода и азота»
Урок – КВН «Подгруппа углерода и азота»