Содержание
- 2. Общая характеристика элементов подгруппы азота. Азот. Аммиак. Соли аммония. Оксиды азота. Азотная кислота. Фосфор и его
- 3. Азот, фосфор и мышьяк – неметаллы Сурьма и висмут металлы Характерная валентность равна III Фосфор, мышьяк,
- 7. Аммиак Фосфин Арсин Стибин Висмутин
- 8. Водные растворы аммиака и фосфина представляют собой слабые основания
- 9. Неметалл главной подгруппы пятой группы Порядковый номер 7 Относительная атомная масса 14 Простое вещество состоит из
- 10. Способы получения Промышленные Лабораторные
- 11. Физические свойства Химические свойства Азот малоактивное вещество Энергия связи в молекуле азота 945 кДж/моль Азот вступает
- 12. Схема строения молекулы азота
- 13. В химических реакциях азот может быть как окислителем, так и восстановителем Азот как окислитель
- 14. Азот как восстановитель
- 15. Получение В промышленности Лабораторные способы
- 16. Физические свойства Химические свойства Атом азота в аммиаке имеет неподеленную электронную пару эта пара может участвовать
- 17. Кислотно-основные свойства
- 19. Окислительно-восстановительные свойства
- 20. Все соли аммония хорошо растворимы в воде Имеют общие свойства солей (взаимодействие со щелочами, гидролиз) Особые
- 21. Термическое разложение солей аммония
- 22. Бесцветный газ Без запаха Малорастворим в воде Образуется при сильных электрических разрядах
- 23. Бесцветный газ Со слабым запахом и сладковатым вкусом Хорошо растворим в воде, но не взаимодействует с
- 24. Бесцветный газ Без запаха Малорастворим в воде Образуется при сильных электрических разрядах или при высокой температуре
- 25. Ядовитый газ Бурого цвета Хорошо растворим в воде Смешанный оксид, которому соответствует две кислоты При взаимодействии
- 26. При растворении в щелочах образуются две соли: В избытке кислорода образуется только нитрат Получение В промышленности
- 27. Темно-синяя жидкость Кислотный оксид Бесцветные кристаллы Хорошо растворимые в воде:
- 28. Физические свойства Бесцветная жидкость Имеет резкий запах Легко испаряется Кипит при температуре 83°С Смешивается с водой
- 29. Химические свойства Кислотно-основные свойства
- 30. Окислительно-восстановительные свойства Азотная кислота – один из сильнейших окислителей Взаимодействует практически со всеми металлами (кроме золота
- 35. Получение В промышленности – процесс идет в три стадии
- 36. В лаборатории
- 39. Характерные степени окисления -3 0 +3 +5
- 40. Получение
- 41. Физические свойства Несколько аллотропных модификаций
- 43. Химические свойства Окислительно-восстановительные свойства
- 48. Получение Физические свойства
- 49. Химические свойства Кислотно-основные свойства
- 50. Окислительно-восстановительные
- 51. Бесцветный порошок Без запаха Кислотный оксид При растворении в воде дает следующие кислоты
- 52. Выраженные водоотнимающие свойства
- 53. Бесцветное кристаллическое вещество Хорошо растворима в воде Трехосновная, средней силы Диссоциация ступенчато
- 54. Получение В промышленности – экстракционный метод В лаборатории – окислением фосфора разбавленной азотной кислотой
- 57. Скачать презентацию






















































 Кинетика химических реакций. (Лекция 12)
Кинетика химических реакций. (Лекция 12) Углеводороды. Природный газ. Алканы
Углеводороды. Природный газ. Алканы Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений Исследование химического состава шоколада и способов его приготовления
Исследование химического состава шоколада и способов его приготовления Природные источники углеводородов
Природные источники углеводородов Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ
Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ Химические свойства карбокатионов
Химические свойства карбокатионов Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Химия переходных элементов
Химия переходных элементов ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале
ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие
Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Презентация по Химии "Азотная кислота" - скачать смотреть
Презентация по Химии "Азотная кислота" - скачать смотреть  Історія виникнення мила Розмаїтого Дмитра, 9-Б клас
Історія виникнення мила Розмаїтого Дмитра, 9-Б клас  Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Тривиальные названия неорганических соединений
Тривиальные названия неорганических соединений Структура аминокислот
Структура аминокислот Дифференцированный подход в обучении химии
Дифференцированный подход в обучении химии Физико-химические методы анализа
Физико-химические методы анализа Кинетические методы анализа
Кинетические методы анализа Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы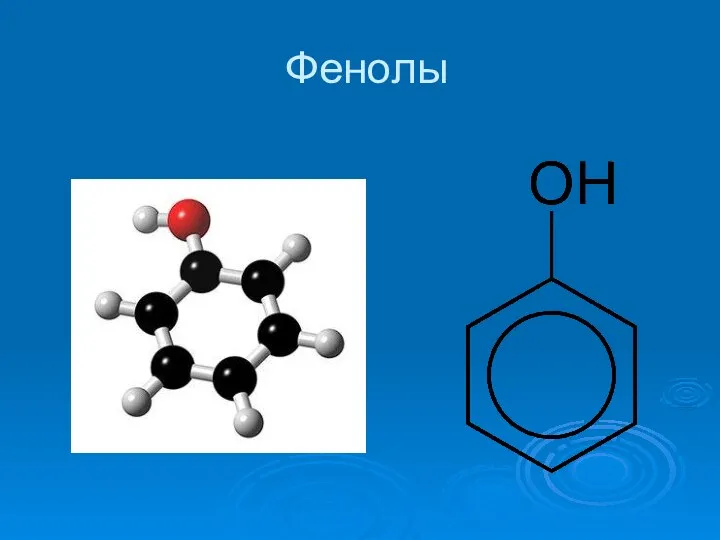 Фенолы. Физические свойства. Получение
Фенолы. Физические свойства. Получение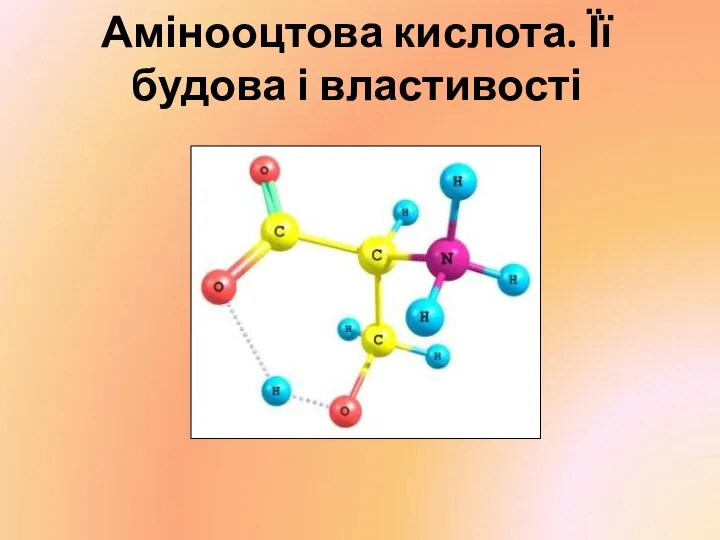 Амінооцтова кислота. Її будова і властивості
Амінооцтова кислота. Її будова і властивості Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері
Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері Пища, с точки зрения химика
Пища, с точки зрения химика Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией  Классификация минералов по химическому принципу
Классификация минералов по химическому принципу