Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора….. аллотропных модификаций а) две б) три в) четыре г) пять в) четыре – белый, черный, красный, фиолетовый 3.
Содержание
- 2. Тест 5. Причина свечения белого фосфора…. а)изменение агрегатного состояния вещества б) химическое явление в) физическое явление
- 3. Фосфор Соединения фосфора химия 9 класс
- 4. План Оксид фосфора - Р2О5 Фосфорная кислота - Н3РО4 Соли фосфорной кислоты – Са3 (РО4)3 Са(Н2РО4)2
- 5. Фосфор в природе В природе фосфор в свободном виде не встречается – только в виде соединений.
- 6. Кислотный оксид Р2О5 Физические свойства Белое гигроскопичное порошкообразное вещество. Хорошо растворимое в воде, образует несколько кислот.
- 7. Кислотный оксид Р2О5 Химические свойства 1) с водой Р2О5 + 3 Н2О = 2Н3РО4 (ортофосфорная кислота)
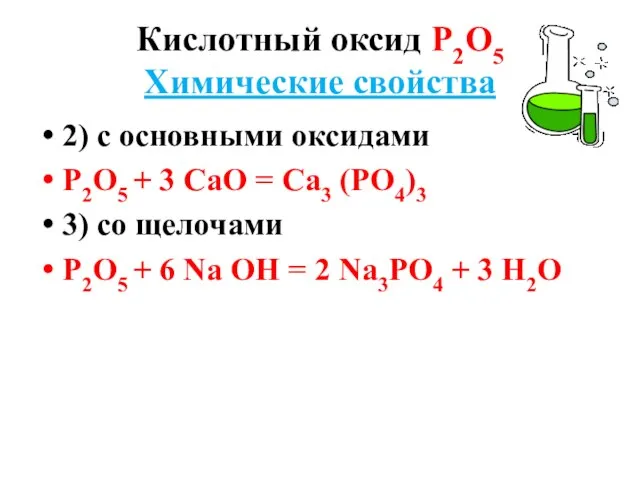
- 8. Кислотный оксид Р2О5 Химические свойства 2) с основными оксидами Р2О5 + 3 СаО = Са3 (РО4)3
- 9. Ортофосфорная кислота Н3РО4 Физические свойства Белые прозрачные кристаллы, не ядовита Кислота средней силы С водой смешивается
- 10. Ортофосфорная кислота Н3РО4 Является трехосновной кислотой и образует три ряда солей: 1) средние соли, или фосфаты
- 11. Ортофосфорная кислота Н3РО4 3) Кислые-гидрофосфаты- СаНРО4 Которые малорастворимы в воде (кроме фосфатов натрия, калия и аммония),
- 12. Ортофосфорная кислота Н3РО4 Химические свойства Н3РО4 проявляет все свойства кислот Реагирует: 1) со щелочами: NaOH, КОН
- 13. Ортофосфорная кислота Н3РО4 Химические свойства Фосфаты всех металлов (КромеЩМе) нерастворимы, поэтому на поверхности этих металлов образуется
- 14. Ортофосфорная кислота Н3РО4 Химические свойства Некоторые реакции с металлами протекают в очень разбавленных растворах: 2 Н3РО4
- 15. Качественная реакция на фосфат-ион РО43- РО43- + 3 Ag+ = Ag3РО4 ↓ (желтый фосфат серебра) Полученный
- 16. Задание Напишите уравнение диссоциации солей Фосфата натрия Гидрофосфата натрия Дигидрофосфата натрия Обратите внимание: средние соли диссоциируют
- 17. Диссоциация солей фосфора Вывод: Каждая последующая ступень диссоциации протекает в меньшей степени, чем предыдущая.
- 18. Источники Горковенко М.Ю. Поурочные разработки по химии: 9 класс. – М.: ВАКО, 2010. – 368 с.
- 20. Скачать презентацию
















 Уксусная кислота
Уксусная кислота Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе.
Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе. Выявление уровня токсичности почв пришкольного участка и прилежащих к нему территорий
Выявление уровня токсичности почв пришкольного участка и прилежащих к нему территорий Гидролиз солей
Гидролиз солей Урок обобщения и систематизации знаний по теме: «Важнейшие классы неорганических соединений.» «Мощь и сила науки во множестве фа
Урок обобщения и систематизации знаний по теме: «Важнейшие классы неорганических соединений.» «Мощь и сила науки во множестве фа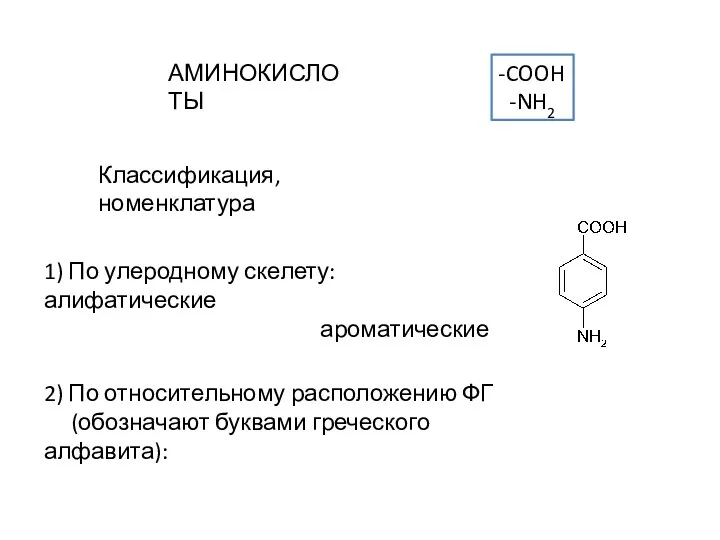 Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний
Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний  Полимеры. Природные и синтетические полимеры
Полимеры. Природные и синтетические полимеры Органическая химия. Лекция. Стероиды
Органическая химия. Лекция. Стероиды Сверхпроводимость как явление микромира
Сверхпроводимость как явление микромира Карбоновые кислоты
Карбоновые кислоты Химические свойства кислорода. Применение кислорода
Химические свойства кислорода. Применение кислорода Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Кислородные соединения азота
Кислородные соединения азота Азотсодержащие и гетероциклические соединения. Низкомолекулярные биологическиактивные соединения
Азотсодержащие и гетероциклические соединения. Низкомолекулярные биологическиактивные соединения ДОСЛІДЖЕННЯ ДОСЛІДЖЕННЯ НАЙМАСОВІШИХ КУПАННЯ смт
ДОСЛІДЖЕННЯ ДОСЛІДЖЕННЯ НАЙМАСОВІШИХ КУПАННЯ смт Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары
Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары Тест с подсказками для закрепления знаний по теме Кислоты (8 класс)
Тест с подсказками для закрепления знаний по теме Кислоты (8 класс) Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6 Формы представления петрохимических данных
Формы представления петрохимических данных Кристаллохимические радиусы
Кристаллохимические радиусы Аминокислоты. Номенклатура аминокислот
Аминокислоты. Номенклатура аминокислот Общая характеристика ферментов как биологических катализаторов
Общая характеристика ферментов как биологических катализаторов Фенол қосылыстары
Фенол қосылыстары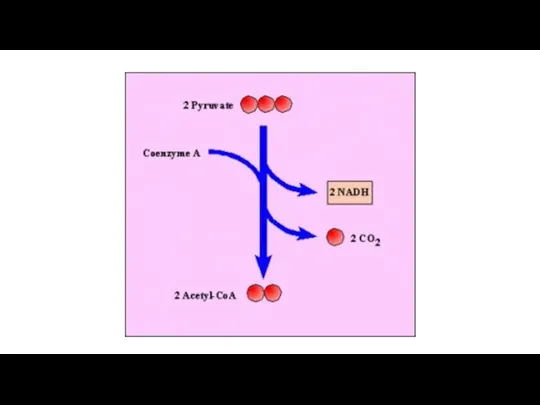 Link reaction
Link reaction Мыло. Компоненты мыла
Мыло. Компоненты мыла Гексены. Физические и химические свойства
Гексены. Физические и химические свойства