Содержание
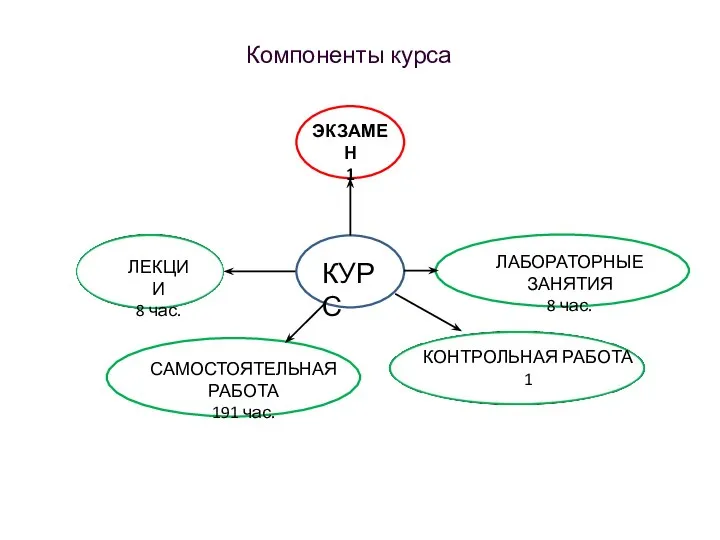
- 2. Компоненты курса ЭКЗАМЕН 1 ЛЕКЦИИ 8 час. САМОСТОЯТЕЛЬНАЯ РАБОТА 191 час. ЛАБОРАТОРНЫЕ ЗАНЯТИЯ 8 час. КУРС
- 3. Аналитическая химия – это наука о методах и средствах химического анализа и в известной мере установления
- 4. Классификация методов анализа по объектам анализа: неорганический и органический; по цели: качественный и количественный анализ; Качественный
- 5. В основе химических методов (гравиметрия, титриметрия) лежат химические реакции, главным требованием к которым является наличие аналитического
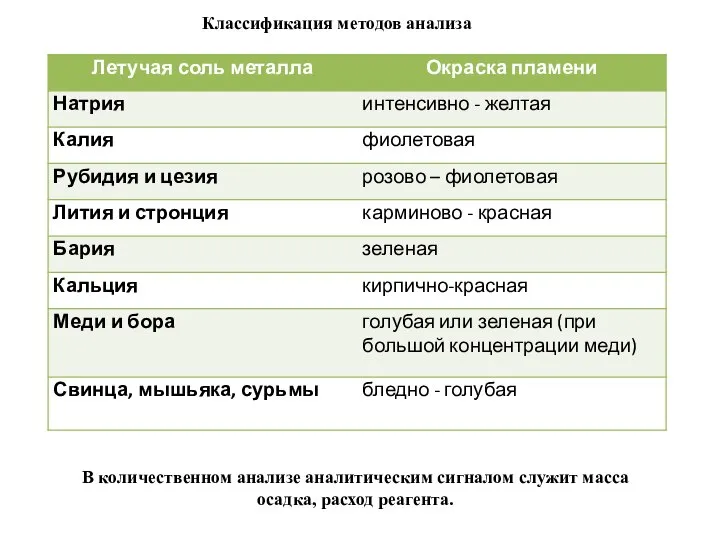
- 6. Классификация методов анализа В количественном анализе аналитическим сигналом служит масса осадка, расход реагента.
- 7. В основе физических методов лежит измерение какого-либо физического параметра, который является функцией состава. В основе физико-химических
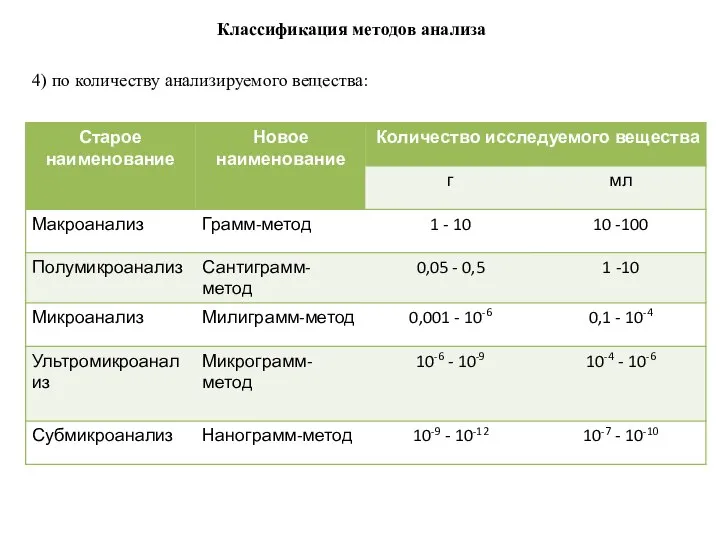
- 8. Классификация методов анализа 4) по количеству анализируемого вещества:
- 9. Требования, предъявляемые к методам анализа правильность – параметр, характеризующий близость экспериментальных и истинных значений измеряемой величины;
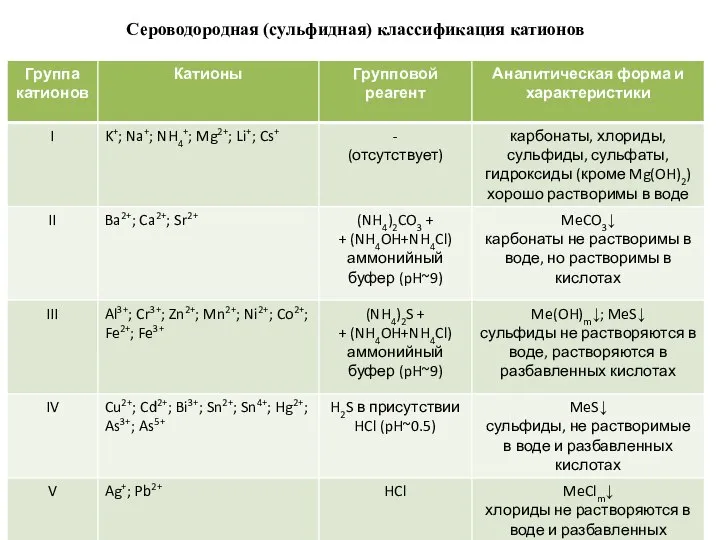
- 10. Качественный анализ Аналитические группы катионов и анионов Сероводородная (сульфидная) классификация катионов Катионы делят на 5 аналитических
- 11. Сероводородная (сульфидная) классификация катионов
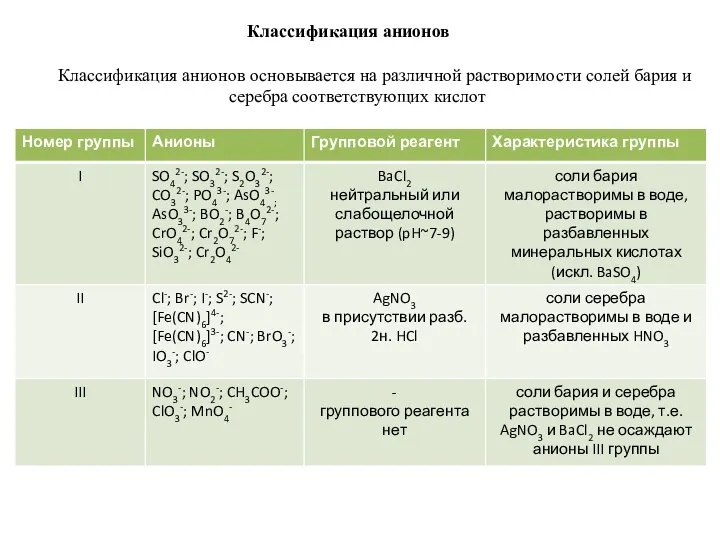
- 12. Классификация анионов Классификация анионов основывается на различной растворимости солей бария и серебра соответствующих кислот
- 13. Методы проведения качественного анализа Систематический метод – основан на переведении пробы в раствор, разделении смеси ионов
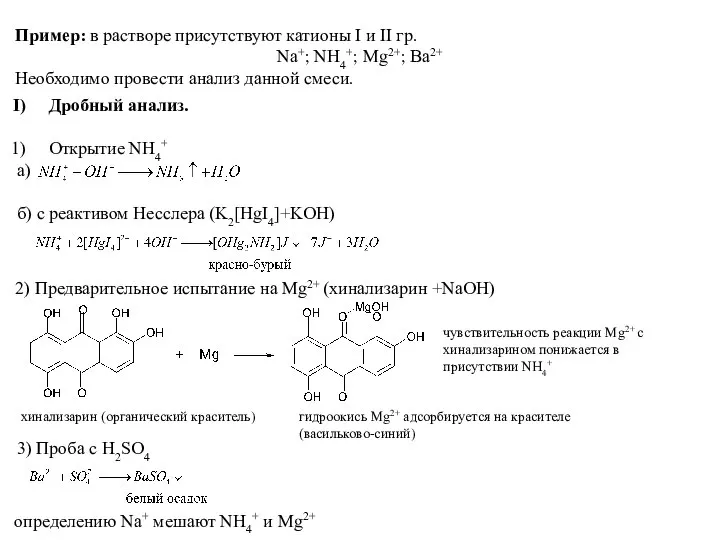
- 14. Пример: в растворе присутствуют катионы I и II гр. Na+; NH4+; Mg2+; Ba2+ Необходимо провести анализ
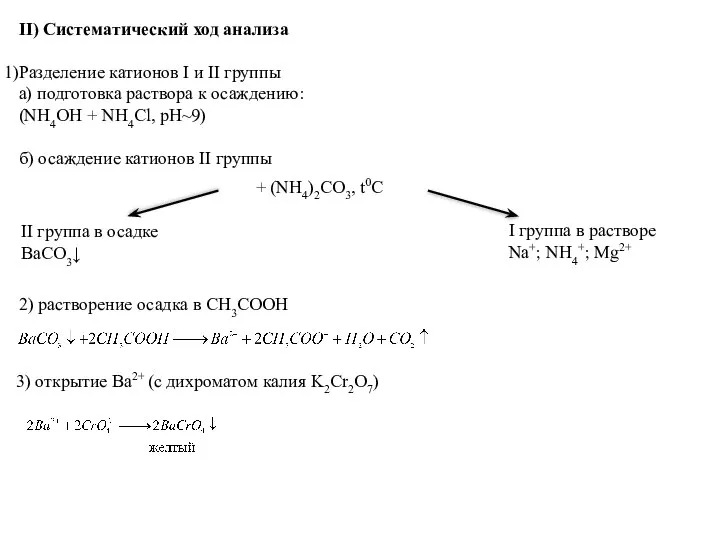
- 15. II) Систематический ход анализа Разделение катионов I и II группы а) подготовка раствора к осаждению: (NH4OH
- 16. Исследуем раствор, содержащий катионы I группы 4) открытие Mg2+ (Na2HPO4+NH4OH+NH4Cl) Соль аммония NH4Cl прибавляют, чтобы не
- 17. Исследуем раствор, содержащий катионы I группы 4) открытие Mg2+ (Na2HPO4+NH4OH+NH4Cl) Соль аммония NH4Cl прибавляют, чтобы не
- 18. Открыт опытным путем К.М. Гульдбергом и П.Вааге в 1967 г. Взаимодействие между различными веществами происходит при
- 19. Состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны между собой, называется химическим
- 20. Сильные и слабые электролиты Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Электролитическая диссоциация
- 21. По степени диссоциации в растворах все электролиты делят на группы: 1) α > 30% - сильные
- 22. Диссоциация кислот, оснований и солей Диссоциация сильных одно- и двухосновных кислот в разбавленных растворах проходит по
- 23. Диссоциация кислот, оснований и солей Слабые многокислотные основания диссоциируют ступенчато: 3) Соли диссоциируют в растворе на
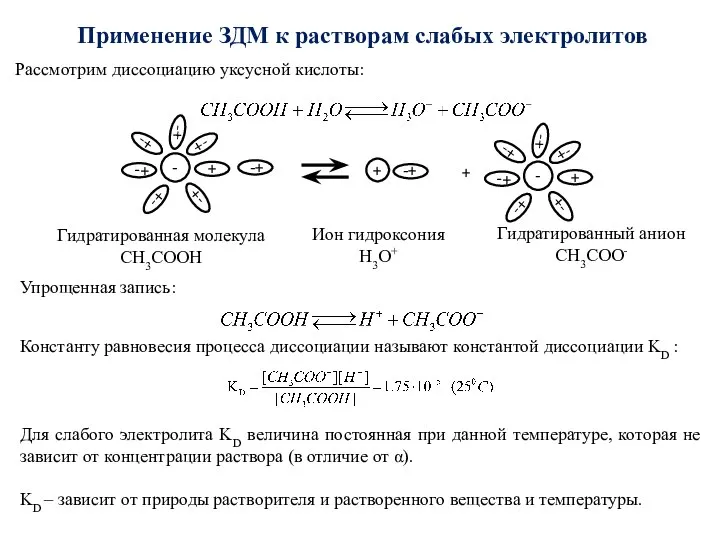
- 24. Применение ЗДМ к растворам слабых электролитов Рассмотрим диссоциацию уксусной кислоты: Гидратированная молекула CH3COOH Ион гидроксония H3O+
- 25. Обозначим: C – исходная концентрация уксусной кислоты (моль/л); α – степень диссоциации уксусной кислоты. Подставляем полученные
- 26. Сильные электролиты в растворах Диссоциация сильных электролитов ЗДМ не подчиняется. Это означает, что если определить экспериментально
- 27. Ионное произведение воды. Водородный показатель pH 1 л воды весит 997 г. при 250С. Kw -
- 28. [H+] > 10-7 > [OH-] – кислый раствор; [H+] [H] = [OH-] = 10-7 – нейтральный
- 29. Гидролиз солей Гидролиз солей – это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию
- 30. 4) Соль, образованная слабым основанием и слабой кислотой. Слабое основание, слабая кислота: CH3COONH4 – гидролиз по
- 31. Константу гидролиза можно рассчитать исходя из константы диссоциации воды и константы диссоциации образующегося в результате гидролиза
- 32. Методы количественного анализа Методами количественного анализа определяют количественный состав соединения или его содержание в смеси. Разнообразные
- 33. Массовая доля ω(В) растворенного вещества В – это безразмерная величина, равная отношению массы растворённого вещества m(В)
- 34. Способы выражения концентраций Молярная концентрация CМ(В) – отношение числа молей n(В) растворенного вещества В к объему
- 35. Эквивалентом называется условная частица вещества, которая в кислотно-основной реакции химически равноценна (или эквивалентна) одному иону водорода.
- 36. Молярной массой эквивалента Мэкв(B) вещества В называют массу одного моля эквивалента этого вещества, равную произведению фактора
- 37. Способы выражения концентраций Нормальная и молярная концентрации взаимосвязаны: В окислительно-восстановительных реакциях эквивалент – часть атома, молекулы
- 38. Ошибки в количественном анализе Все ошибки принято делить на три группы: грубые ошибки (промах); систематические ошибки;
- 39. Ошибки в количественном анализе Ошибка может быть выражена абсолютным или относительным значением. Абсолютная ошибка (∆X) –
- 40. Равновесия в гетерогенных системах В химический стакан поместили труднорастворимую соль AmBn и добавили дистиллированную воду. Будем
- 41. Равновесия в гетерогенных системах Как и любое равновесие данный процесс можно описать константой химического равновесия. Активность
- 42. Равновесия в гетерогенных системах ПР можно вычислить, зная растворимость соединения при данной температуре, и наоборот, зная
- 43. Образование осадков [Ax+]m[By-]n > ПР – перенасыщенный раствор; [Ax+]m[By-]n [Ax+]m[By-]n = ПР – насыщенный раствор. Условия,
- 44. Условия, влияющие на растворимость осадка 2) Влияние одноименного иона. Растворимость труднорастворимых электролитов понижается в присутствии других
- 45. Условия, влияющие на растворимость осадка Влияние количества осадителя. Для более полного осаждения употребляют избыток осадителя. 4)
- 46. Условия, влияющие на растворимость осадка Вычисление коэффициентов активности является довольно сложной задачей, но для очень разбавленных
- 47. Условия, влияющие на растворимость осадка 5) Влияние кислотности раствора. Пусть необходимо растворить осадок BaCO3: Добавив в
- 48. Гравиметрический метод анализа Гравиметрический метод анализа основан на точном измерении массы определяемого компонента, выделенного либо в
- 49. Требования к осаждаемой форме Осаждаемая форма должна обладать малой растворимостью. Практически полное осаждение может быть достигнуто
- 50. Требования к весовой форме 1) Весовая форма должна быть химически чистой, без примесей. 2) Весовая форма
- 51. Этапы гравиметрического анализа Осаждение соединения, содержащего определяемое вещества (т.е. получение осаждаемой формы) Осадитель всегда добавляют в
- 52. Этапы гравиметрического анализа 3) Промывание осадка для удаления примесей. Малорастворимые в воде осадки промывают горячей дистиллированной
- 53. Титриметрический метод анализа В этом методе измеряют точный объем растворов двух веществ, реагирующих между собой, при
- 54. Требования к реакциям, используемым в титриметрии реакция должна протекать в соответствии со стехиометрическим уравнением; реакция должна
- 55. Классификация титриметрических методов анализа 1.3) комплексонометрическое титрование – реакции комплексообразования, т.е. образование малодиссоциирующих прочных комплексных соединений;
- 56. Способы титрования прямое титрование: титрант добавляют к титруемому веществу. Например, раствор соляной кислоты с известной концентрацией
- 57. Способы титрования 3) заместительное титрование: Например, определение солей аммония HCl титруют стандартным раствором NaOH: Приготовление раствора
- 58. Буферные растворы Кислотно-основная буферная система – это система, состоящая из слабой кислоты или основания в присутствии
- 59. Буферная сила (емкость) Буферная сила – это способность буферного раствора сопротивляться внешним воздействиям. Она зависит: -
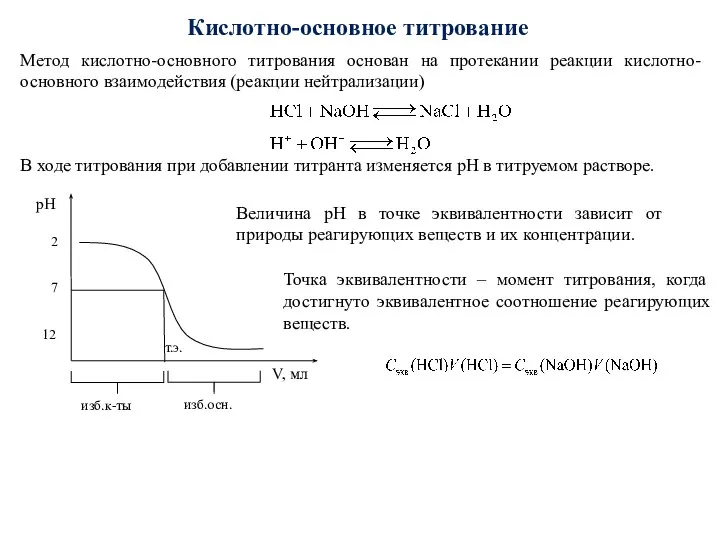
- 60. Кислотно-основное титрование Метод кислотно-основного титрования основан на протекании реакции кислотно-основного взаимодействия (реакции нейтрализации) В ходе титрования
- 61. Кислотно-основные индикаторы Кислотно-основные индикаторы – это органические соединения, которые изменяют свою окраску в зависимости от pH
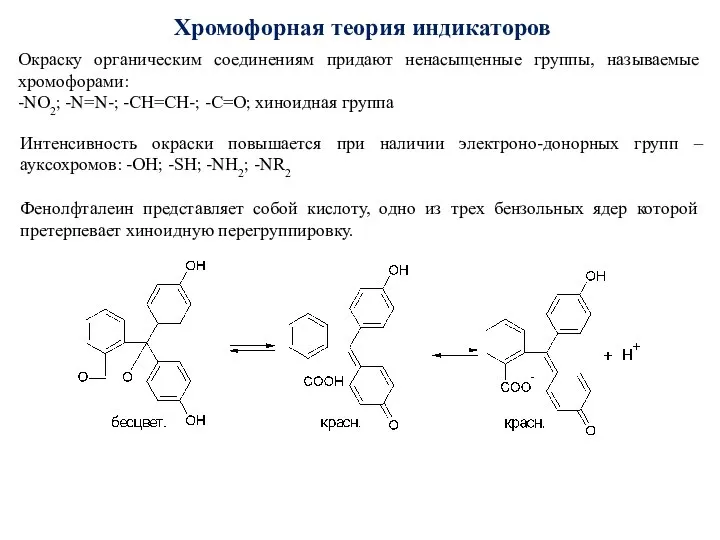
- 62. Хромофорная теория индикаторов Окраску органическим соединениям придают ненасыщенные группы, называемые хромофорами: -NO2; -N=N-; -CH=CH-; -C=O; хиноидная
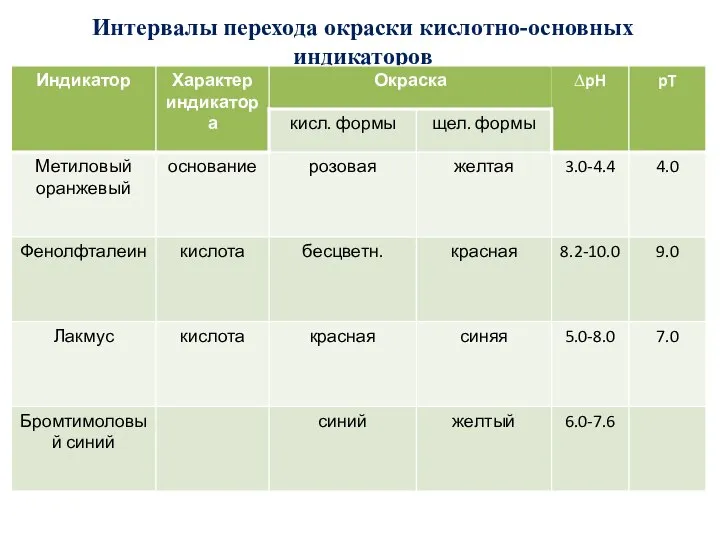
- 63. Интервал перехода окраски индикатора Интервал перехода окраски индикатора (∆pH) – это область значений pH раствора, в
- 64. Интервалы перехода окраски кислотно-основных индикаторов
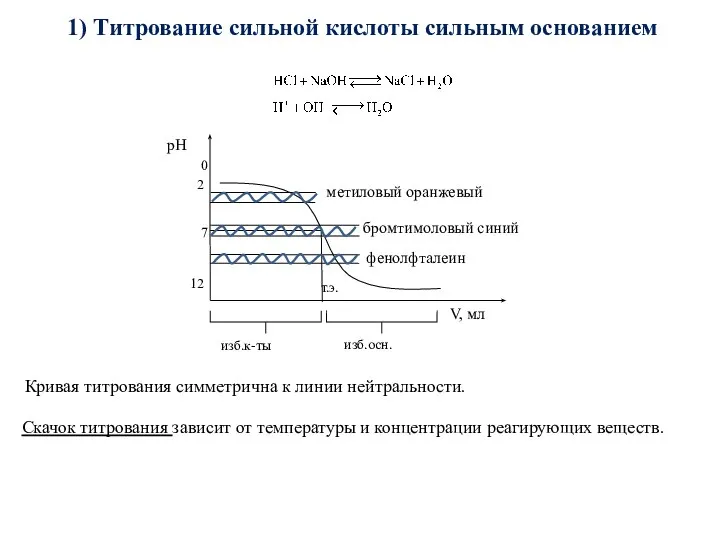
- 65. 1) Титрование сильной кислоты сильным основанием Кривая титрования симметрична к линии нейтральности. Скачок титрования зависит от
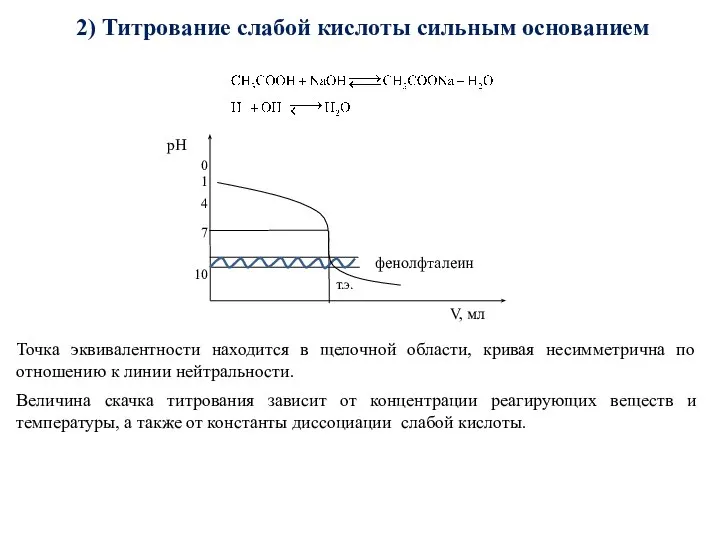
- 66. 2) Титрование слабой кислоты сильным основанием Точка эквивалентности находится в щелочной области, кривая несимметрична по отношению
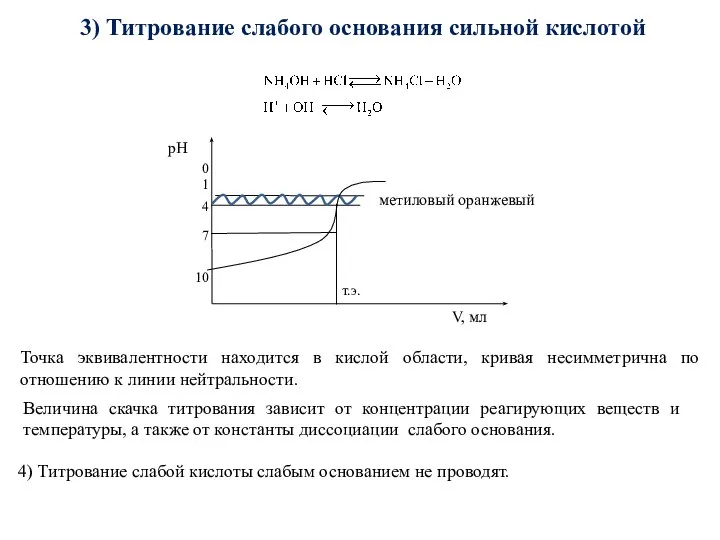
- 67. 3) Титрование слабого основания сильной кислотой Точка эквивалентности находится в кислой области, кривая несимметрична по отношению
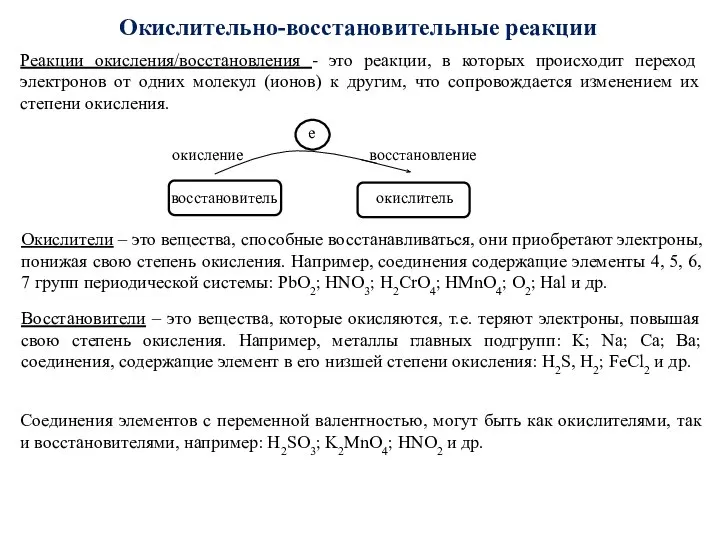
- 68. Окислительно-восстановительные реакции Реакции окисления/восстановления - это реакции, в которых происходит переход электронов от одних молекул (ионов)
- 69. В любой окислительно-восстановительной реакции окислитель и восстановитель взаимодействуют друг с другом с образованием нового (сопряженного) восстановителя
- 70. Чем больше потенциал данной пары, тем более сильным окислителем является соответствующая окисленная форма. Чем меньше потенциал
- 71. Подбор коэффициентов в окислительно-восстановительных реакциях 1) Метод электронного баланса Метод электронного баланса не показывает реальных изменений,
- 72. Классификация методов окислительно-восстановительного титрования В зависимости от используемых рабочих растворов различают: Перманганатометрия (титрант KMnO4); Иодометрия (титранты
- 73. Перманганатометрия Титрование стандартным раствором KMnO4 проводят в кислой среде. E0 MnO4-/Mn2+ = +1.52в; Иногда, титрование стандартным
- 74. Приготовление раствора KMnO4 Раствор KMnO4 по точной навеске приготовить нельзя. Поэтому раствор KMnO4 относится к вторичным
- 75. Стандартизация раствора KMnO4 по щавелевой кислоте 5НООС-СООН + 2KMnO4 + 3Н2SО4 → 2MnSO4 + 10CO2↑ +
- 76. Преимущества перманганатометрического метода Исходные стандартные растворы KMnO4 окрашены в малиновый цвет, поэтому можно не прибегать к
- 77. Йодометрия Метод основан на окислительно-восстановительных процессах, связанных с восстановлением J2 до иодид-ионов 2J- или окислением их
- 78. Индикатор - крахмал При титровании йодом применяют специфический индикатор – раствор крахмала. Амилоза, входящая в состав
- 79. Преимущества иодометрического метода Иодометрический метод применим для определения многих соединений, не реагирующих непосредственно с йодом или
- 80. Осадительное титрование Осадительное титрование – группа титриметрических методов анализа, основанных на реакциях образования малорастворимых соединений, выделяющихся
- 81. Метод Мора В качестве индикатора для обнаружения конечной точки титрования используется хромат калия К2СrO4– осадительный индикатор.
- 82. Меркурометрическое титрование Меркурометрическое титрование – титриметрический метод анализа, основанный на образовании малорастворимых соединений ртути (I). Меркурометрическое
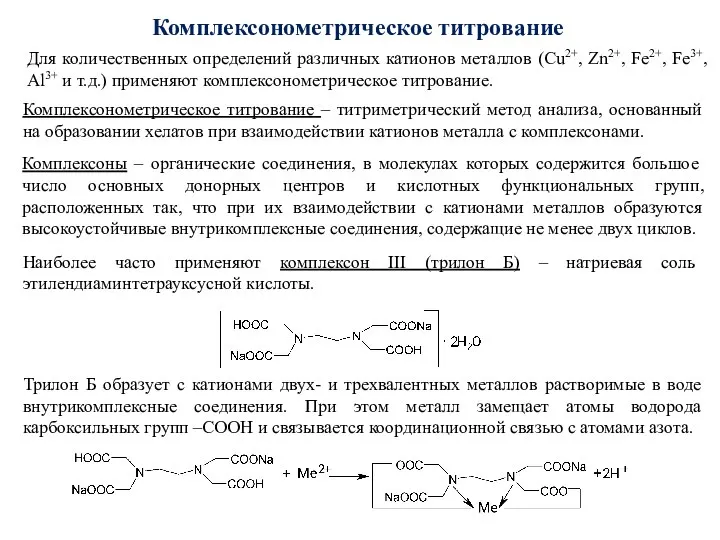
- 83. Комплексонометрическое титрование Комплексонометрическое титрование – титриметрический метод анализа, основанный на образовании хелатов при взаимодействии катионов металла
- 84. Комплексонометрическое титрование Комплексы обладают различной прочностью и образуются при определенных значениях pH для каждого катиона. Для
- 85. Перечень основной литературы по дисциплине : Основы аналитической химии: в 2-х т. / ред. Ю. А.
- 87. Скачать презентацию


















![[H+] > 10-7 > [OH-] – кислый раствор; [H+] [H] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/692695/slide-27.jpg)














![Образование осадков [Ax+]m[By-]n > ПР – перенасыщенный раствор; [Ax+]m[By-]n [Ax+]m[By-]n =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/692695/slide-42.jpg)


































 Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Презентация по Химии "Основания." - скачать смотреть бесплатно
Презентация по Химии "Основания." - скачать смотреть бесплатно Санитарно-гигиенические показатели питьевой воды
Санитарно-гигиенические показатели питьевой воды Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Коррозия металлов
Коррозия металлов Презентация по Химии "«Тверда вода»" - скачать смотреть бесплатно
Презентация по Химии "«Тверда вода»" - скачать смотреть бесплатно Основные понятия и законы химии
Основные понятия и законы химии Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Щелочные металлы
Щелочные металлы Функциональные свойства и анализ каротиноидов в пищевых продуктах
Функциональные свойства и анализ каротиноидов в пищевых продуктах Система инактивации лекарственных средств в организме человека
Система инактивации лекарственных средств в организме человека Интеллектуальная химическая викторина Умники и умницы
Интеллектуальная химическая викторина Умники и умницы Современные проблемы химической технологии керамики
Современные проблемы химической технологии керамики Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация по Химии "Белирий, магний и щелочноземельные металлы" - скачать смотреть
Презентация по Химии "Белирий, магний и щелочноземельные металлы" - скачать смотреть  Галогены. Галогеноводородные кислоты и их соли
Галогены. Галогеноводородные кислоты и их соли Метаболизм процесіндегі липидтер мен нуклеин қышқылдарының орны
Метаболизм процесіндегі липидтер мен нуклеин қышқылдарының орны Обмен белков и аминокислот. Азотистый баланс. (Лекция 14)
Обмен белков и аминокислот. Азотистый баланс. (Лекция 14) Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии
Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии Закись азота – наркотик!
Закись азота – наркотик! Ароматические соединения (арены)
Ароматические соединения (арены) Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Посвящение в химики. Игра-викторина. Внеклассное мероприятие по химии для учащихся 8 классов.
Посвящение в химики. Игра-викторина. Внеклассное мероприятие по химии для учащихся 8 классов. Презентация по Химии "открытие органической химии" - скачать смотреть
Презентация по Химии "открытие органической химии" - скачать смотреть  Великие ученые-химики
Великие ученые-химики Презентация по Химии "Основные химические понятия" - скачать смотреть
Презентация по Химии "Основные химические понятия" - скачать смотреть  Урок-упражнение по веществам
Урок-упражнение по веществам Химическая связь (лекция 4)
Химическая связь (лекция 4)