Содержание
- 2. Щелочные металлы — элементы 1-й группы периодической таблицы химических элементов. При растворении щелочных металлов в воде
- 3. Литий - очень легкий, мягкий щелочной металл серебристо-белого цвета. Натрий - очень легкий, мягкий щелочной металл
- 4. Франций Этот элемент был предсказан Д. И. Менделеевым (как «эка-цезий»), и был открыт в 1939 году
- 5. Получение щелочных металлов 1) Электролиз расплавов галогенидов: 2) Электролиз расплавов гидроксидов: 3) Восстановление из галогенидов: Поскольку
- 6. Применение щелочных металлов и их солей Щелочные металлы и их соединения широко используются в технике. Литий
- 7. Опасность щелочных металлов Все щелочные металлы проявляют высокую активность при взаимодействии с водой, кислородом, галогенами и
- 9. Скачать презентацию
Щелочные металлы — элементы 1-й группы периодической таблицы химических элементов. При
Щелочные металлы — элементы 1-й группы периодической таблицы химических элементов. При
Свойства
1) Низкие температуры плавления, малые значения плотностей, мягкие, режутся ножом.
2) С увеличением порядкового номера атомный радиус увеличивается, способность отдавать валентные электроны увеличивается и восстановительная активность увеличивается.
3) Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды.
Литий - очень легкий, мягкий щелочной металл серебристо-белого цвета.
Натрий - очень
Литий - очень легкий, мягкий щелочной металл серебристо-белого цвета.
Натрий - очень
Калий - мягкий щелочной металл серебристо-белого цвета.
Рубидий - это мягкий легкоплавкий щелочной металл серебристо-белого цвета.
Цезий - мягкий, вязкий щелочной металл серебристо-жёлтого цвета.
Франций — один из редчайших элементов.
Почти все щелочные металлы серебристо-белого цвета, кроме цезия и франция.
Франций
Этот элемент был предсказан Д. И. Менделеевым (как «эка-цезий»), и был
Франций
Этот элемент был предсказан Д. И. Менделеевым (как «эка-цезий»), и был
Среди элементов, постоянно существующих в земной коре, только астат имеет меньшее содержание. Весь природный франций является радиогенным, его радиоактивный распад компенсируется одновременным возникновением новых атомов франция в качестве промежуточных продуктов распада урана-235 и тория-232. Общее содержание франция в земной коре оценивается в 340 граммов.
Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций.
Одна из наиболее распространённых ядерных реакций для получения франция:
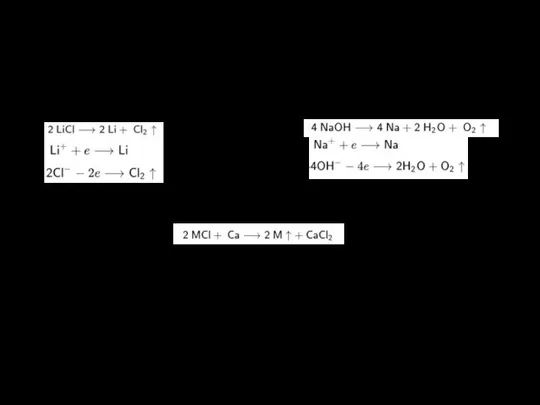
Получение щелочных металлов
1) Электролиз расплавов галогенидов:
2) Электролиз расплавов гидроксидов:
3) Восстановление из
Получение щелочных металлов
1) Электролиз расплавов галогенидов:
2) Электролиз расплавов гидроксидов:
3) Восстановление из
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из водных растворов солей невозможно. В этом случае образуются соответствующие щёлочи и водород.
Применение щелочных металлов и их солей
Щелочные металлы и их соединения широко
Применение щелочных металлов и их солей
Щелочные металлы и их соединения широко
Кристаллическая сода применяется в производстве стекла, бумаги и мыла. В быту более известна соль – гидрокарбонат натрия, она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода). Карбонат калия – используется в производстве жидкого мыла и для приготовления тугоплавкого стекла. Хлорид натрия, или поваренная соль, является важнейшим сырьем в химической промышленности, широко применяется в быту.
Опасность щелочных металлов
Все щелочные металлы проявляют высокую активность при взаимодействии с
Опасность щелочных металлов
Все щелочные металлы проявляют высокую активность при взаимодействии с





 Карбонильные соединения (оксосоединения)
Карбонильные соединения (оксосоединения) Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1
Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1 Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Тип перовскита
Тип перовскита Нефть и способы её переработки.
Нефть и способы её переработки. Виды присадок к моторному топливу
Виды присадок к моторному топливу Смазочные материалы
Смазочные материалы Colloidal solutions coarsely dispersed systems
Colloidal solutions coarsely dispersed systems Рецепторы анионов
Рецепторы анионов Едкость Coca-Cola
Едкость Coca-Cola Кислоты
Кислоты Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Альдегиды. Строение молекул
Альдегиды. Строение молекул Фильтрационные свойства.Решение уравнений Стокса для несжимаемой жидкости
Фильтрационные свойства.Решение уравнений Стокса для несжимаемой жидкости Химия в моей специальности
Химия в моей специальности Общее понятие о липидах. Переваривание и всасывание липидов
Общее понятие о липидах. Переваривание и всасывание липидов Обмен липидов
Обмен липидов Электрохимические методы анализа
Электрохимические методы анализа XIII конференция ИХТРЭМС «Научно-практические проблемы в области химии и химических технологий»
XIII конференция ИХТРЭМС «Научно-практические проблемы в области химии и химических технологий» Азот и его соединения
Азот и его соединения Строение, получение и применение полимеров
Строение, получение и применение полимеров Химический элемент медь. (11 класс)
Химический элемент медь. (11 класс) Нефть. Способы её переработки. Продукты переработки нефти
Нефть. Способы её переработки. Продукты переработки нефти Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Химические свойства металлов
Химические свойства металлов Варианты заданий к расчету однократной экстракции
Варианты заданий к расчету однократной экстракции Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства