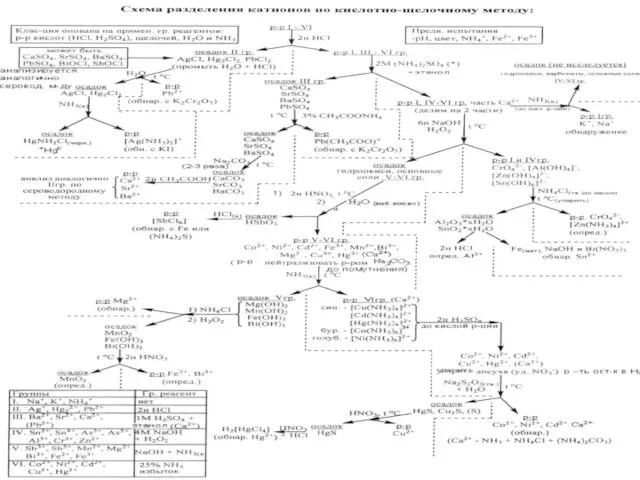
Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие
Содержание
- 2. Логарифмы
- 3. Математика Логарифмы - характеристика и мантисса. Переход от логарифма к числу. Логарифмы – натуральный и десятичный,
- 4. План лекции: Химические методы обнаружения неорганических веществ. Реакции обнаружения смеси катионов I -3 аналитических групп. 2.
- 5. Анализ смеси катионов первой-третьей аналитических групп по систематическому анализу
- 7. Анализ раствора без осадка Предварительные испытания – действие щелочью с целью обнаружить ион аммония, подтверждение –
- 8. CИСТЕМ.ХОД АНАЛИЗА НА 1ГРУППУ
- 9. ПРИНЦИПИАЛЬНОЕ ОТЛИЧИЕ УЧЕТ И УСТРАНЕНИЕ МЕШАЮЩЕГО ВЛИЯНИЯ ИОНОВ
- 10. Анализ смеси катионов Li+, Na+, K+, NH4+ Сразу удаляют аммоний прокаливаем в щелочной среде, затем Li+–
- 11. Первая аналитическая группа катионов -Li+, Na+, K+, NH4+
- 12. Анализ смеси катионов Li+, Na+, K+, NH4+ Сразу удаляют аммоний прокаливаем в щелочной среде, затем Li+–
- 13. Анализ смеси катионов II аналитической группы по систематическому анализу
- 14. Действие групповых реагентов –HCl, H2SO4 Осадок при действии HCl - есть катионы второй аналитической группы Осадок
- 15. Растворимость хлорида свинца ρ*(PbCl2)=0,98г/100г воды ρ*(PbSO4)=0,0045г/100г воды
- 16. Парадоксальный вывод при образовании осадков при прибавлении обеих кислот В растворе могут присутствовать только катионы свинца
- 17. ОтделениеPbCl2 Осадок обрабатывают горячей водой, при этом PbCl2 растворяется. При необходимости процедуру повторяют несколько раз.
- 18. Реакция дитизона с ионами свинца, дитизонат свинца окрашивает слой хлороформа в красный цвет
- 19. Дополнение Экстракция – явление распределения вещества между двумя несмешивающимися жидкостями. Это способ выделить соединение металла с
- 20. Продолжение хода анализа Наличие осадка после удаления PbCl2 Осадок обрабатывают раствором аммиака: при этом AgCl растворяется
- 21. ПРОДУКТЫ 2Hg22++ 4NH3+H2O = [OHg2NH2] + Hg0
- 22. Определение серебра К раствору, содержащему аммиакат серебра, прибавляют азотную кислоту – выпадение белого осадка AgCl указывает
- 23. Анализ смеси катионов III аналитической группы по систематическому анализу
- 24. Осадок не образовался при действии H2SO4 или (NH4)2SO4 Добавление этанола приводит к выпадению сульфата кальция –
- 25. Операции с осадком Перевод сульфатов в карбонаты проводят посредством многократной обработки осадка насыщенным раствором карбоната натрия
- 27. Обнаружение ионов бария Обнаружение ионов бария проводят по реакции с K2Cr2O7 в присутствии CH3COONa+ CH3COOН. Если
- 28. Обнаружение стронция Осадок 4 растворяют при нагревании в 2 М CH3COOH (раствор 3). К раствору 3
- 29. Обнаружение кальция Раствор 4 упаривают до небольшого объема и проводят обнаружение ионов кальция по реакции с
- 30. Химическое равновесие в растворах
- 31. Идеальные растворы Растворы, для которых наблюдается совпадение термодинамических свойств на основе расчета концентраций на основе масс
- 32. Идеальность растворов Наблюдается лишь для предельно разбавленных растворов при невысоких (комнатных) температурах
- 33. Отклонения от идеальности В реальных растворах наблюдаются эффекты взаимного влияния ионов - притяжение и отталкивание. Это
- 34. Активность вещества в растворе Активность (α ) – это такая концентрация вещества в растворе, при использовании
- 35. Размерность активности Размерность имеет ту же размерность, что и величина, характеризующая состав раствора, вместо которой эта
- 36. Коэффициенты активности Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности.
- 37. Индивидуальные коэффициенты активности В зависимости от способа описания количественного состава раствора различают молярный (у), моляльный (ɣ)
- 38. Выражение коэффициентов активности
- 39. Среднеионные коэффициенты активности Для характеристики активности электролитов используются среднеионные коэффициенты активности, которые можно определть экспериментально;
- 40. Индивидуальные коэффициенты активности ионов: Характеризуют активность отдельных ионов, входящих в состав электролита. Поскольку отдельных ионов (только
- 41. Ионная сила раствора
- 42. Активность растворенного вещества Зависит от концентрации растворенного электролита (для неэлектролитов она равна нулю) и квадрата заряда
- 43. Ионная сила раствора – математическое выражение
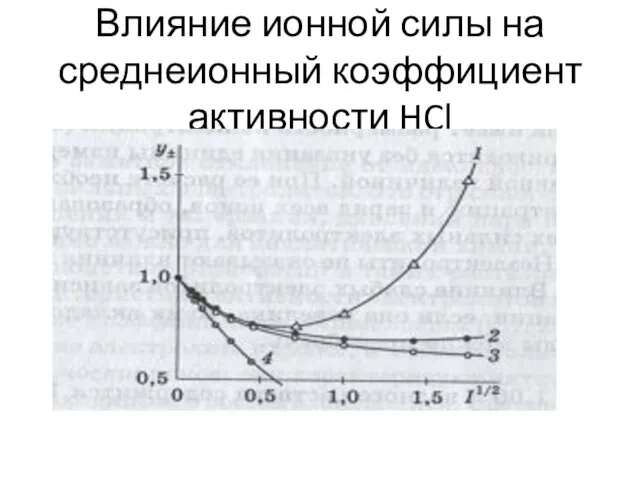
- 44. Влияние ионной силы на среднеионный коэффициент активности HCl
- 45. РАСЧЕТНЫЕ ФОРМУЛЫ Ионная сила раствора
- 46. Предельный закон Дебая-Хюккеля (I
- 47. Расширенное уравнение Дебая-Хюккеля (С=0,01-0,1 моль/литр)
- 48. Коэффициенты расширенного уравнения Дебая-Хюккеля А- аналогично предельному уравнению; В=0,328 – эмпирическая константа; (α) - эмпирическая константа,
- 49. Значения эмпирической константы а для некоторых ионов
- 50. Уравнение Дэвиса (I=0,1 – 1) В α =1
- 52. Скачать презентацию


















![ПРОДУКТЫ 2Hg22++ 4NH3+H2O = [OHg2NH2] + Hg0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/544270/slide-20.jpg)




























 Насыщенные углеводороды
Насыщенные углеводороды Нәруыз. Қасиеті және қызметі
Нәруыз. Қасиеті және қызметі Основы теории смазывания и стандарты качества моторных масел
Основы теории смазывания и стандарты качества моторных масел Химические источники тока
Химические источники тока Живые системы для производства углеводородов
Живые системы для производства углеводородов Презентация ОБЩАЯ ЖЕСТКОСТЬ ВОДЫ
Презентация ОБЩАЯ ЖЕСТКОСТЬ ВОДЫ  Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Нафта
Нафта  Point defects. Line defects. Surface Imperfections
Point defects. Line defects. Surface Imperfections Кристаллохимия как наука
Кристаллохимия как наука Кыргызстандагы химия онор жайы
Кыргызстандагы химия онор жайы Химическая связь. Природа химической связи
Химическая связь. Природа химической связи Nucleic acids
Nucleic acids Электролиз воды
Электролиз воды «Голубое золото» 10 класс базовый уровень
«Голубое золото» 10 класс базовый уровень  Схема катаболизма углеродного скилета аминокислот
Схема катаболизма углеродного скилета аминокислот Глицерин
Глицерин Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Введение в биохимию. Строение и функции белков (часть 1)
Введение в биохимию. Строение и функции белков (часть 1) Химия и сельское хозяйство
Химия и сельское хозяйство Физические свойства металлов. Сплавы
Физические свойства металлов. Сплавы Презентация по химии Электролитическая диссоциация
Презентация по химии Электролитическая диссоциация  Հիալուրոնաթթվի անջատումը ձվի կեղևից և դրա նույնականացումը բարձրարդյունավետ. Հեղուկային քրոմատոգրաֆիայի եղանակով
Հիալուրոնաթթվի անջատումը ձվի կեղևից և դրա նույնականացումը բարձրարդյունավետ. Հեղուկային քրոմատոգրաֆիայի եղանակով Стеклянные товары. Основные сырьевые материалы для производства стекла
Стеклянные товары. Основные сырьевые материалы для производства стекла Презентация по Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими
Презентация по Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими Может ли вода приносить вред здоровью? Авторы: Козлова Ирина Владимировна, Ушакова Кристина Николаевна, 9 класс МОУ «СОШ №12», г. А
Может ли вода приносить вред здоровью? Авторы: Козлова Ирина Владимировна, Ушакова Кристина Николаевна, 9 класс МОУ «СОШ №12», г. А Строение полимера. Мономерное звено. Урок № 27
Строение полимера. Мономерное звено. Урок № 27 Ксенобиотики. Микросомальное окисление
Ксенобиотики. Микросомальное окисление