Содержание
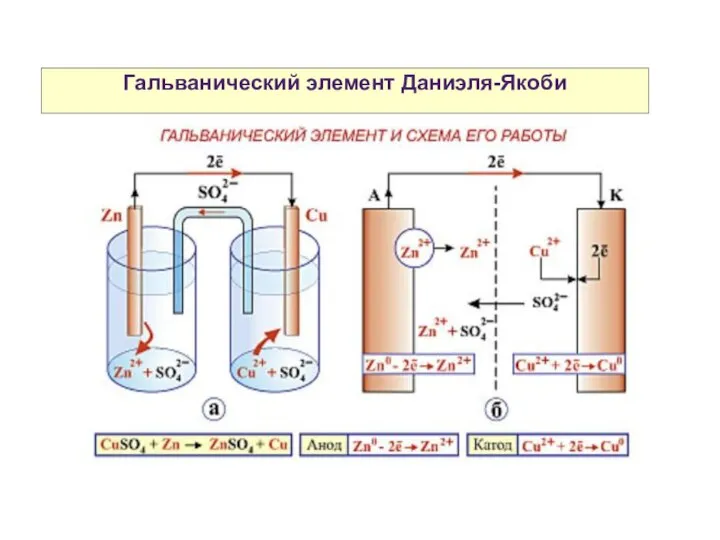
- 2. Гальванический элемент Даниэля-Якоби
- 3. Принцип работы гальванического элемента ΔНрешетки > 0 ΔНгидратации В зависимости от величины значений данных энтальпий на
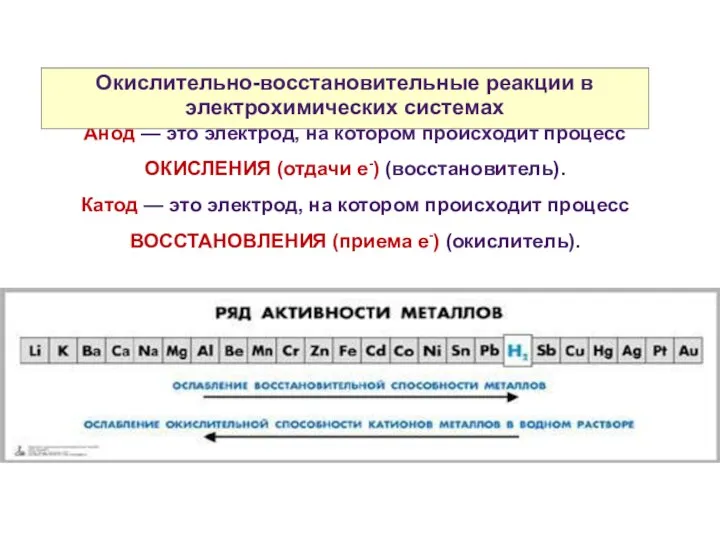
- 4. Принцип работы гальванического элемента Анод — это электрод, на котором происходит процесс ОКИСЛЕНИЯ (отдачи е-) (восстановитель).
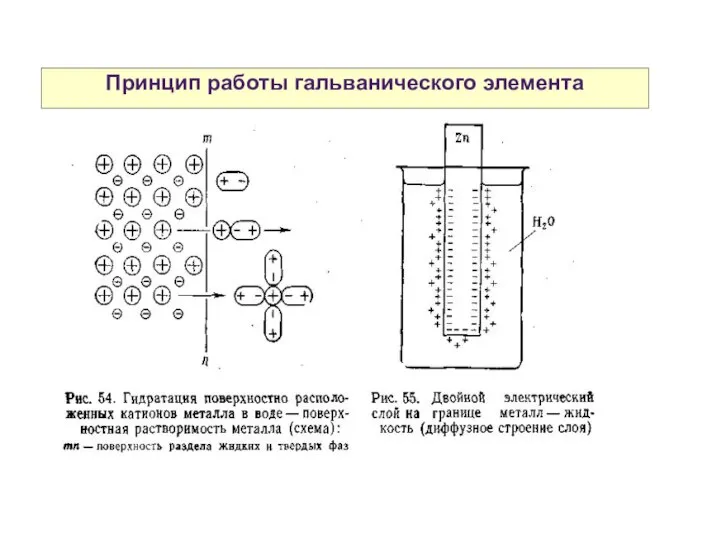
- 5. Принцип работы гальванического элемента
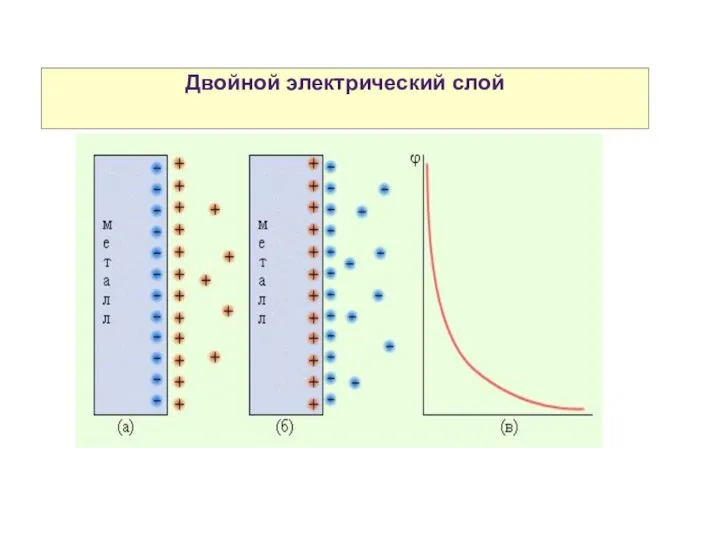
- 6. Двойной электрический слой
- 7. Гальванический элемент Даниэля-Якоби Схема гальванического элемента Даниэля-Якоби: (-) Zn|Zn2+||Cu2+|Cu (+)
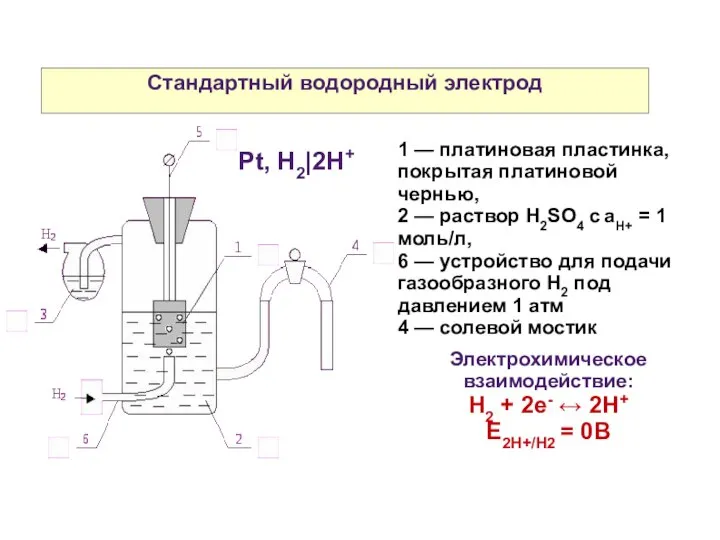
- 8. Стандартный водородный электрод 1 — платиновая пластинка, покрытая платиновой чернью, 2 — раствор H2SO4 c aH+
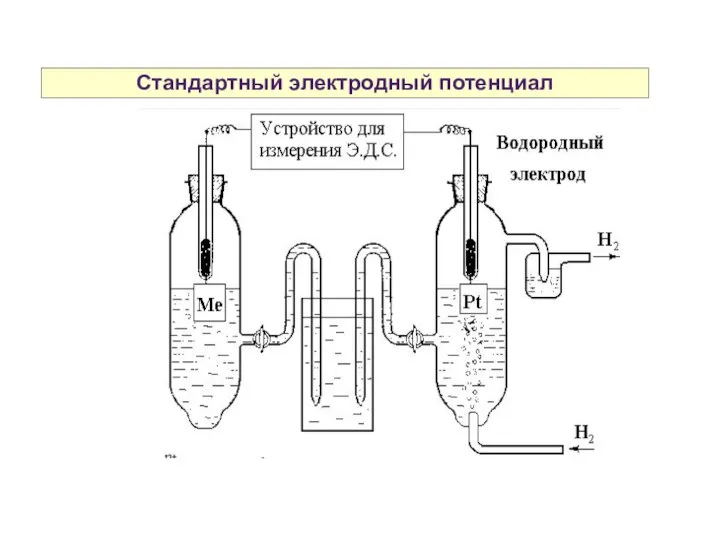
- 9. Стандартный электродный потенциал
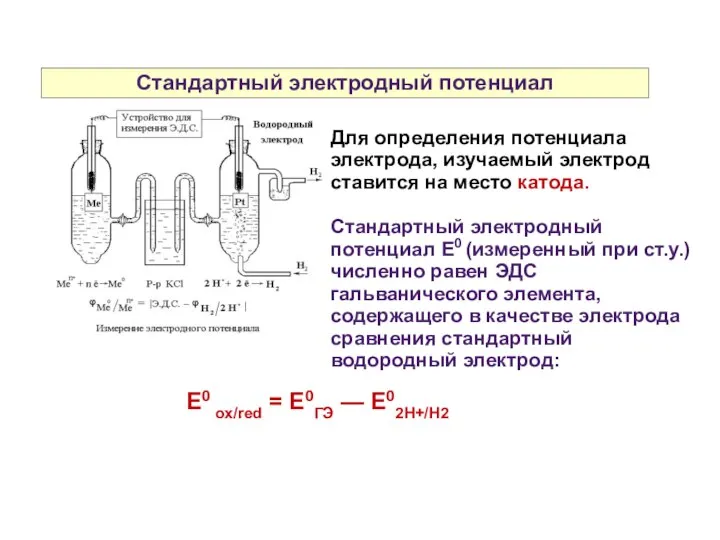
- 10. Стандартный электродный потенциал Для определения потенциала электрода, изучаемый электрод ставится на место катода. Стандартный электродный потенциал
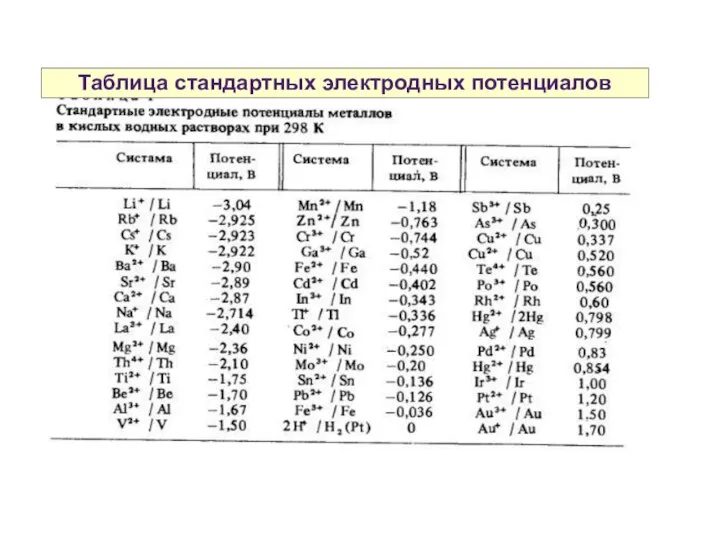
- 11. Таблица стандартных электродных потенциалов
- 12. Стандартный электродный потенциал При составлении произвольного ГЭ, электрод с более положительным потенциалом будет выполнять функции катода
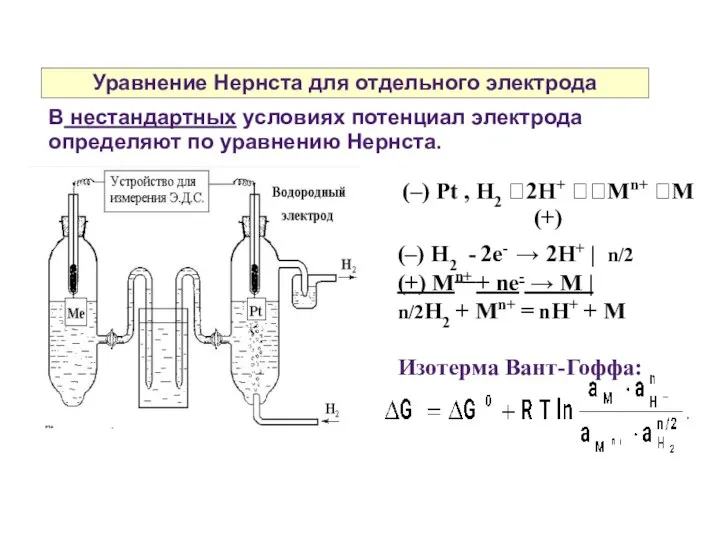
- 13. Уравнение Нернста для отдельного электрода В нестандартных условиях потенциал электрода определяют по уравнению Нернста. (–) Pt
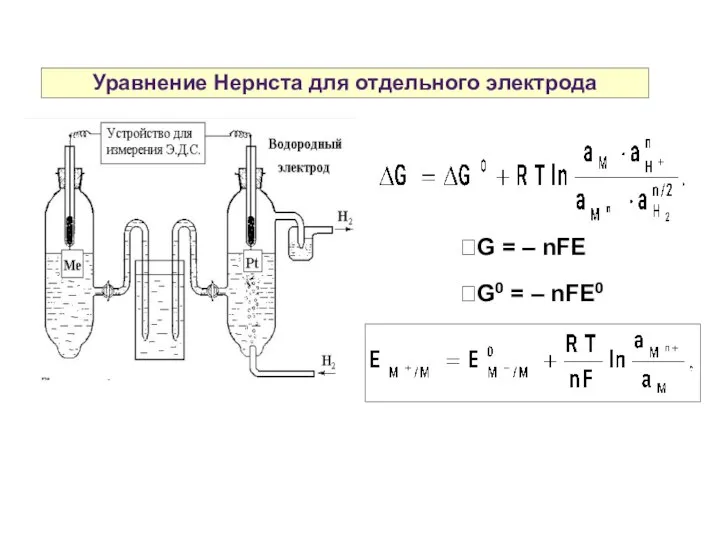
- 14. Уравнение Нернста для отдельного электрода G = – nFE G0 = – nFE0
- 15. Уравнение Нернста для отдельного электрода Общий вид уравнения Нернста для отдельного электрода: где аоф — активность
- 16. Уравнение Нернста для отдельного электрода Задание: определить потенциал медного электрода, молярная концентрация раствора CuSO4 в котором
- 17. Уравнение Нернста для гальванического элемента Процесс идет в прямом направлении, если GГЭ 0, т. к. G
- 18. Уравнение Нернста для гальванического элемента Задание: определить E0ГЭ и ЕГЭ для элемента Даниэля-Якоби. Пусть aCu2+ =
- 19. Уравнение Нернста для гальванического элемента (-) Zn — 2e- → Zn2+ (+) Cu2+ + 2e- →
- 20. Уравнение Нернста для гальванического элемента В общем виде уравнение Нернста для гальванического элемента имеет вид: (-)
- 21. Взаимосвязь константы равновесия Кр со стандартным потенциалом гальванического элемента Е0ГЭ G0 = – nFE0 G0 =
- 22. Взаимосвязь константы равновесия Кр со стандартным потенциалом гальванического элемента Е0ГЭ G0 = – nFE0 G0 =
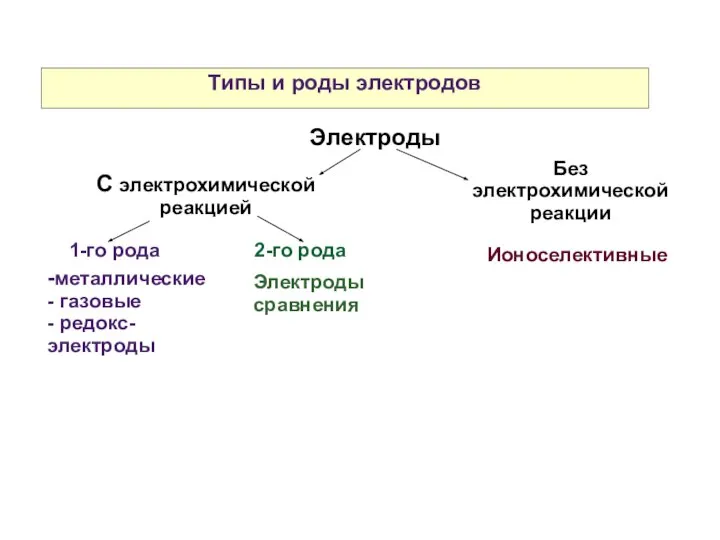
- 23. Типы и роды электродов Электроды С электрохимической реакцией 1-го рода 2-го рода -металлические - газовые -
- 24. Металлические электроды Металл, погруженный в раствор своей соли Me|Men+ Cu|Cu2+ Cu Cu2+ + 2e- Zn|Zn2+ Zn
- 25. Газовые электроды Газовый электрод состоит из инертного проводника 1-го рода (Pt, графит) и газа, находящегося в
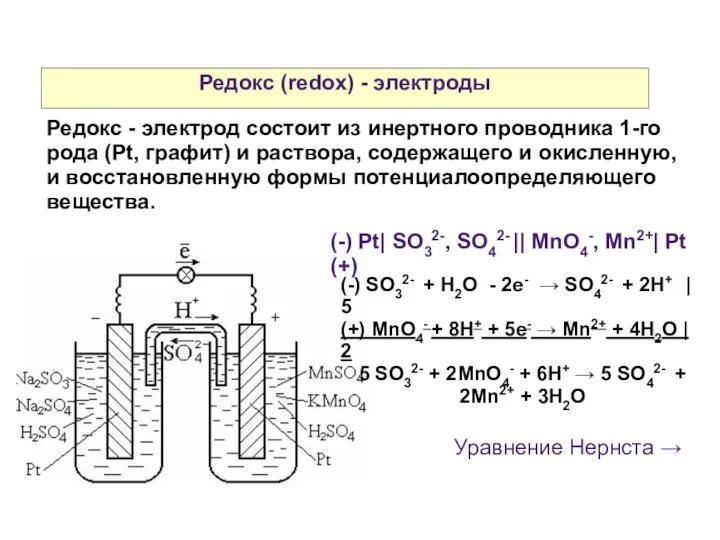
- 26. Редокс (redox) - электроды Редокс - электрод состоит из инертного проводника 1-го рода (Pt, графит) и
- 27. Редокс (redox) - электроды (-) SO32- + H2O - 2e- → SO42- + 2H+ | 5
- 28. Электроды сравнения (2-го рода) Состоят из проводника 1-го рода — металла — покрытого слоем труднорастворимой соли
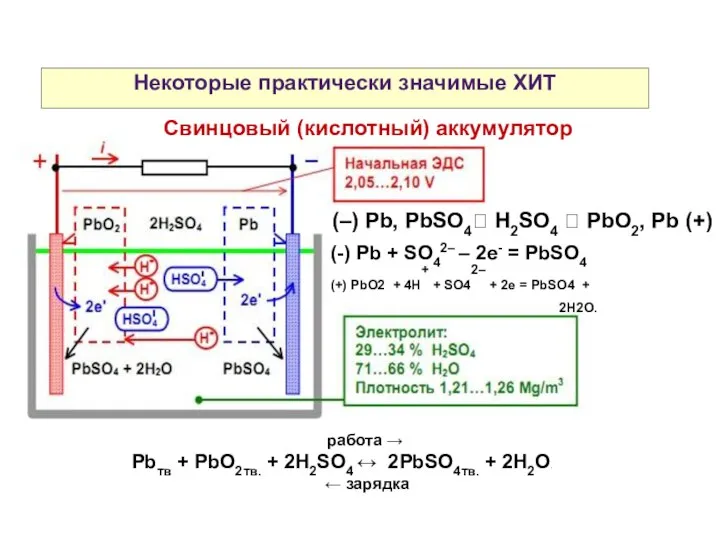
- 29. Некоторые практически значимые ХИТ Свинцовый (кислотный) аккумулятор (–) Pb, PbSO4 H2SO4 PbO2, Pb (+) (-)
- 30. Некоторые практически значимые ХИТ Свинцовый (кислотный) аккумулятор (–) Pb, PbSO4 H2SO4 PbO2, Pb (+) работа
- 31. Некоторые практически значимые ХИТ Щелочной железо-никелевый аккумулятор (–) Fe, Fe(OH)2 ⏐KOH⏐Ni(OH)2, Ni(OH)3, Ni (+) работа →
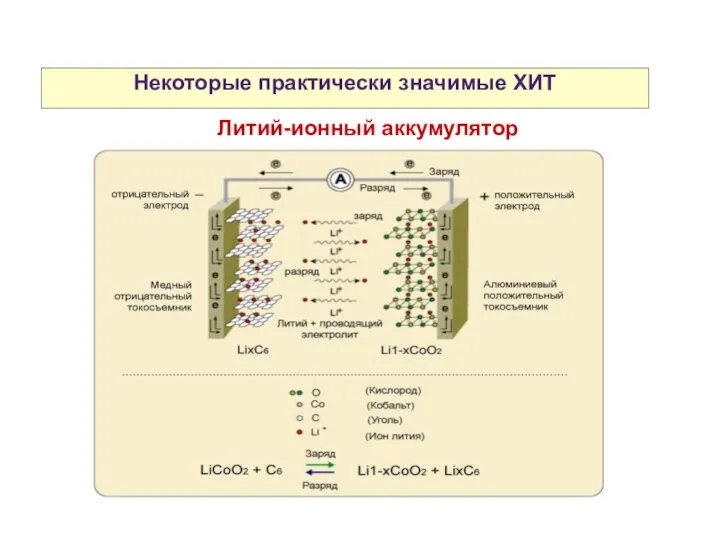
- 32. Некоторые практически значимые ХИТ Литий-ионный аккумулятор
- 34. Скачать презентацию

















 Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск 2005
Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск 2005 Первоначальные химические понятия
Первоначальные химические понятия Типы химических реакций
Типы химических реакций  Качественные реакции на катионы и анионы
Качественные реакции на катионы и анионы Презентация по Химии "М.В. Ломоносов и химия" - скачать смотреть
Презентация по Химии "М.В. Ломоносов и химия" - скачать смотреть  Наглядное пособие «Динамические модели». Кристаллы. Немолекулярные вещества. Простые вещества
Наглядное пособие «Динамические модели». Кристаллы. Немолекулярные вещества. Простые вещества Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.
Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.  Аварії з викидом хімічних небезпечних речовин та їх класифікація
Аварії з викидом хімічних небезпечних речовин та їх класифікація Русская живопись 17 века
Русская живопись 17 века  Конструкционные и функциональные волокнистые композиты. Органические волокна
Конструкционные и функциональные волокнистые композиты. Органические волокна Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1)
Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1) Стиральные порошки и средства для стирки 2016
Стиральные порошки и средства для стирки 2016 Водорастворимые витамины
Водорастворимые витамины Требования, предъявляемые к дизельным топливам
Требования, предъявляемые к дизельным топливам Современное состояние и пути совершенствования стандартизации лекарственных средств
Современное состояние и пути совершенствования стандартизации лекарственных средств Вестерн блоттинг (вестерн-блот, белковый иммуноблот, Western bloting)
Вестерн блоттинг (вестерн-блот, белковый иммуноблот, Western bloting) Образование растворов ВМС
Образование растворов ВМС Радиоуглеродный метод
Радиоуглеродный метод Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Fuziunea nucleara
Fuziunea nucleara Методы анализа, основанные на разделении смеси ЛВ
Методы анализа, основанные на разделении смеси ЛВ Технология кварцевого стекла
Технология кварцевого стекла Угольная кислота H2CO3
Угольная кислота H2CO3 Презентация по Химии "Липиды" - скачать смотреть
Презентация по Химии "Липиды" - скачать смотреть  Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів
Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів Геохимия гидротермального процесса. Гидротермальные месторождения. (Лекция 8)
Геохимия гидротермального процесса. Гидротермальные месторождения. (Лекция 8) Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Программа дополнительного образования Химия, здоровье и окружающая среда
Программа дополнительного образования Химия, здоровье и окружающая среда