Содержание
- 2. Важной ролью эндогенных ГК является подавление иммунной реакции, чтобы предотвратить ее от достижения уровня, который может
- 3. Крысы Lewis, которые генетически детерминированы на гипореактивность ГГН системы, предрасположены к хроническим воспалительным процессам. Кроме того,
- 4. Провоспалительные медиаторы, в частности ИЛ-1 и ФНОα, повышаются в начале развития иммунной реакции, они стимулируют ГГНось,
- 5. . У мышей с генетически детерминированным нарушением иммунной системы - мыши линии MRL/lpr, гомозиготные по гену
- 6. Обнаружена дефектность мышей MLR/lpr по продукции и/или по функциональной активности МП. Показан протективный эффект МП на
- 7. Г.В.Идова Лаборатория механизмов нейрохимической регуляции ГУ НИИ физиологии СО РАМН г.Новосибирск Работа выполнена при поддержке РФФИ
- 8. Olivier B. SEROTONIN: A NEVER-ENDING STORY Eur.J Pharmacol. -2015.-Vol. 753.-P. 2-18
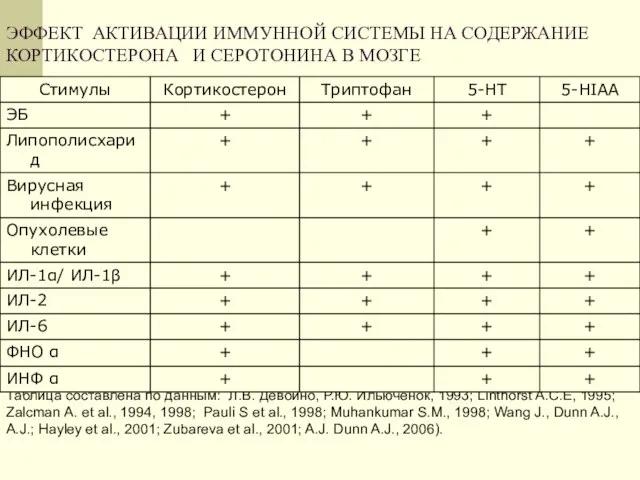
- 9. ЭФФЕКТ АКТИВАЦИИ ИММУННОЙ СИСТЕМЫ НА СОДЕРЖАНИЕ КОРТИКОСТЕРОНА И СЕРОТОНИНА В МОЗГЕ Таблица составлена по данным: Л.В.
- 11. Угнетение иммунного ответа при активации 5-НТ сисемы: 1. Введение серотнина в дозах 50-100 мг/кг; 2.Введение предшественника
- 12. Стимуляция иммунного ответа при снижении 5-НТ системы: 1. Электролитическое разрушение ядер шва среднего мозга; 2.Блокада фермента
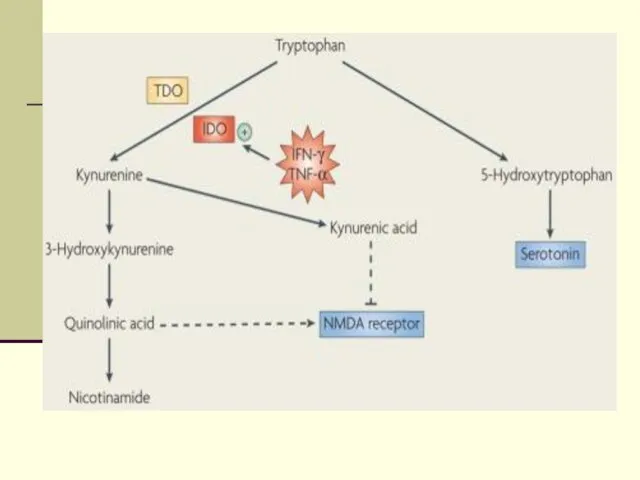
- 13. . L- триптофан Триптофангидроксилаза ( блокатор ПХФА) 5-окситриптофан (5-ОТФ) Декарбоксилаза 5-оксиртиптамин (5-ОТ, 5-НТ – серотонин) ПХФА
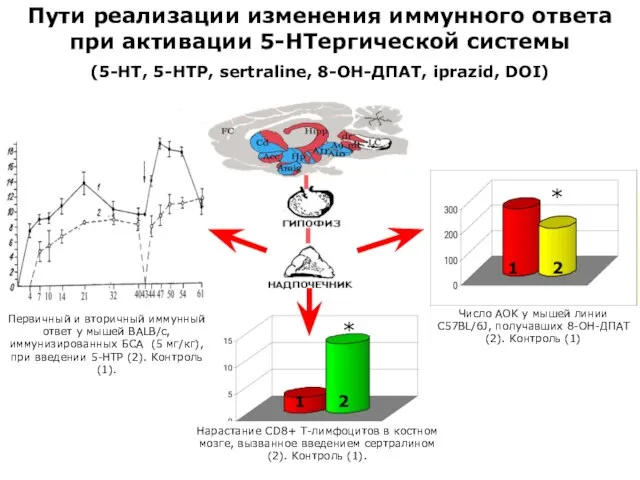
- 15. Число АОК у мышей линии С57BL/6J, получавших 8-ОН-ДПАТ(2). Контроль (1) Первичный и вторичный иммунный ответ у
- 16. 5-НТ включен в регуляцию ГГН оси и контролирует активность КРФ нейронов в гипоталамусе и кортикотрофов, снтезирущих
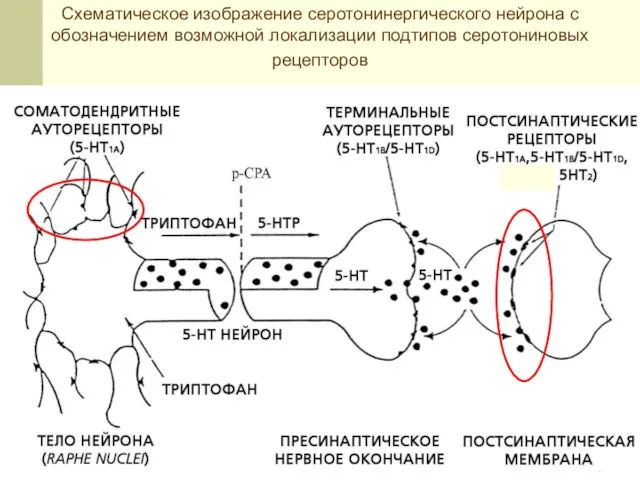
- 17. Схематическое изображение серотонинергического нейрона с обозначением возможной локализации подтипов серотониновых рецепторов
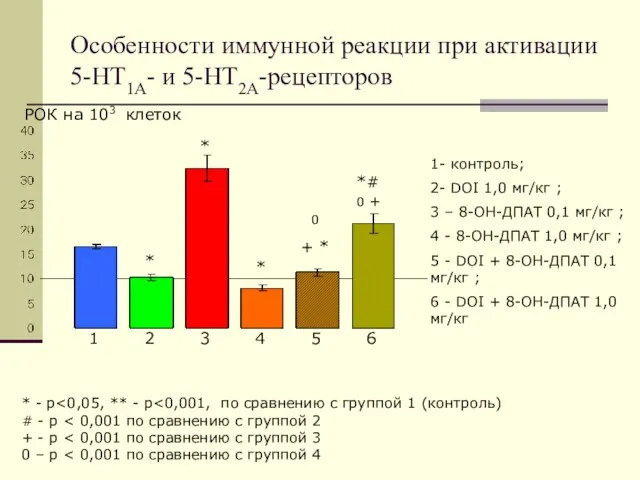
- 18. Особенности иммунной реакции при активации 5-НТ1А- и 5-НТ2А-рецепторов РОК на 103 клеток 1 2 3 4
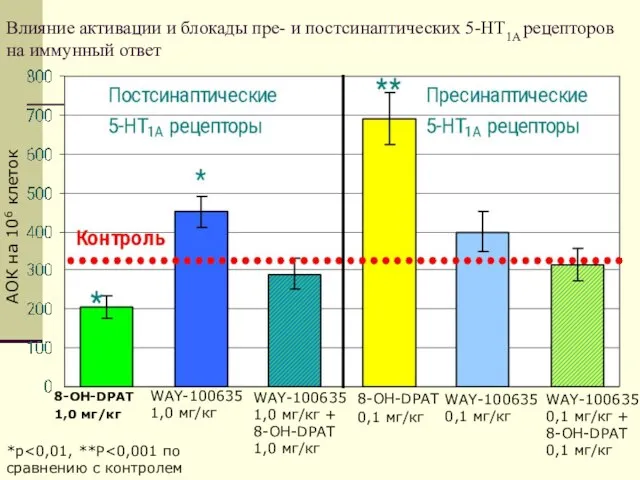
- 19. Влияние активации и блокады пре- и постсинаптических 5-HT1A рецепторов на иммунный ответ 8-OH-DPAT 1,0 мг/кг WAY-100635
- 20. Иммунный ответ при экспериментальном моделировании различных типов поведения, связь с активностью 5-НТергической системы
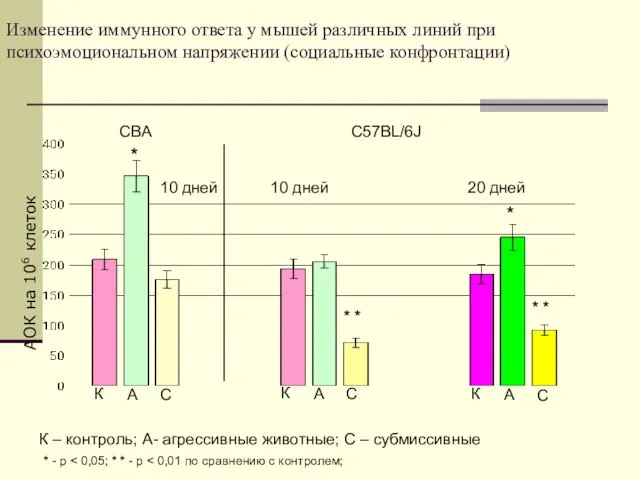
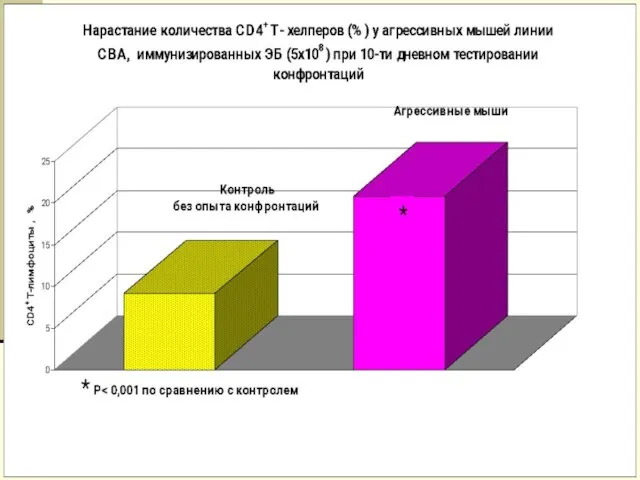
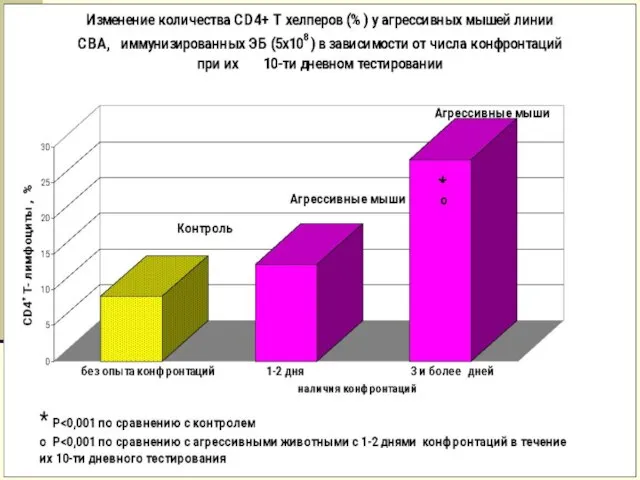
- 21. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (социальные конфронтации) АОК на 106 клеток
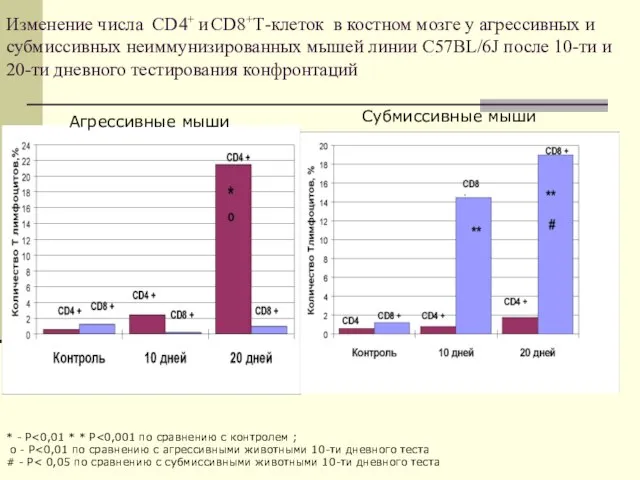
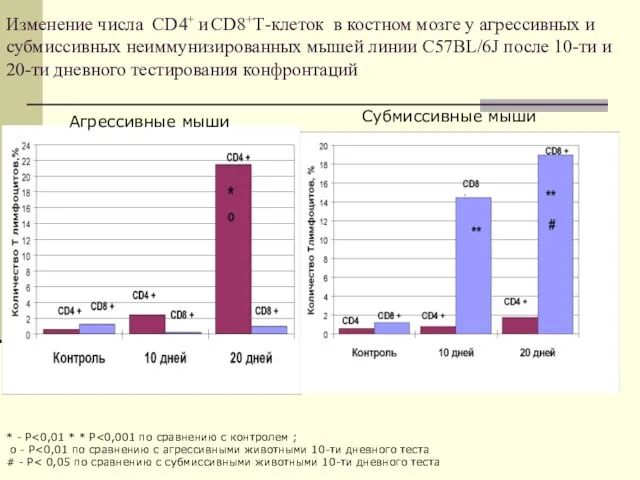
- 22. Изменение числа CD4+ и CD8+Т-клеток в костном мозге у агрессивных и субмиссивных неиммунизированных мышей линии C57BL/6J
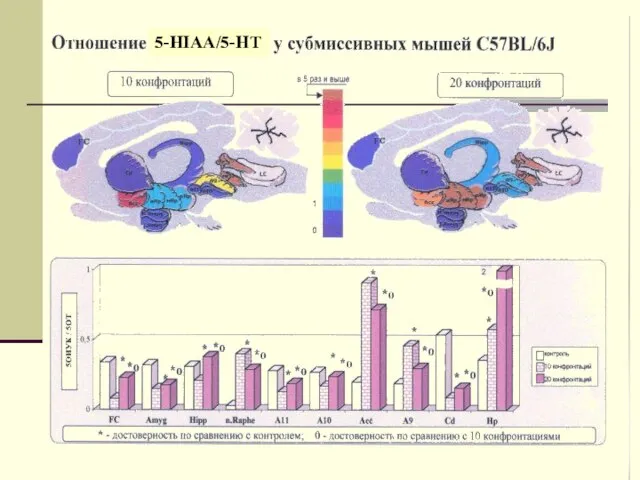
- 23. 5-HIAA/5-HT
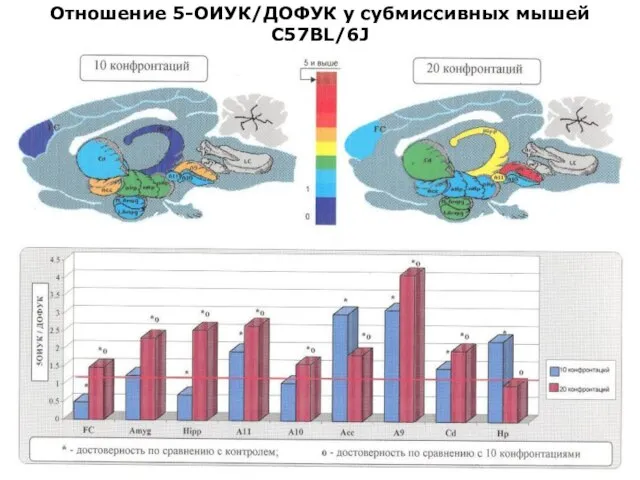
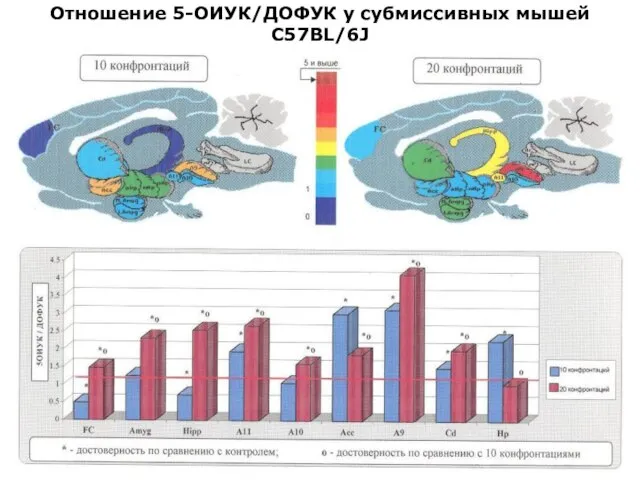
- 24. Отношение 5-ОИУК/ДОФУК у субмиссивных мышей С57BL/6J
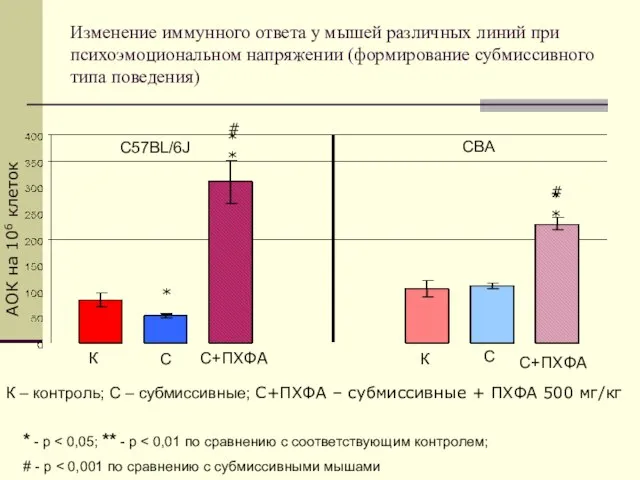
- 25. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (формирование субмиссивного типа поведения) СВА С57BL/6J
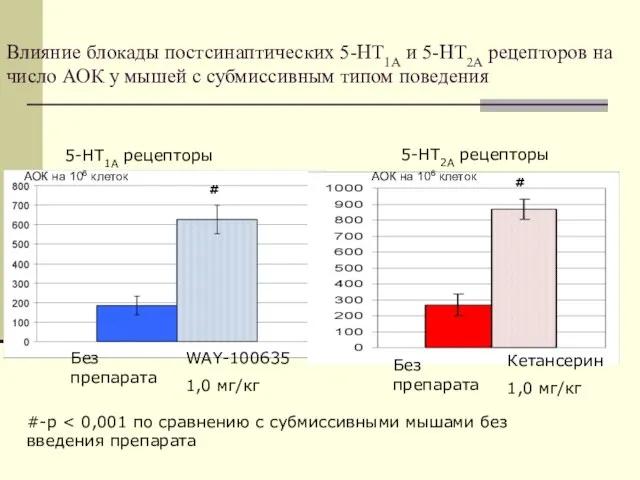
- 26. Влияние блокады постсинаптических 5-НТ1А и 5-НТ2А рецепторов на число АОК у мышей с субмиссивным типом поведения
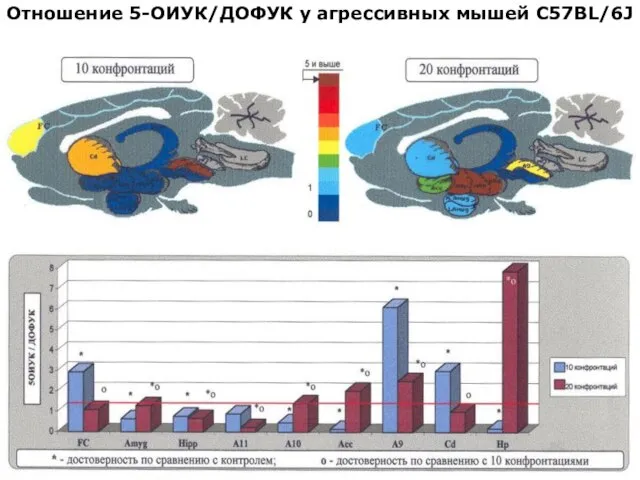
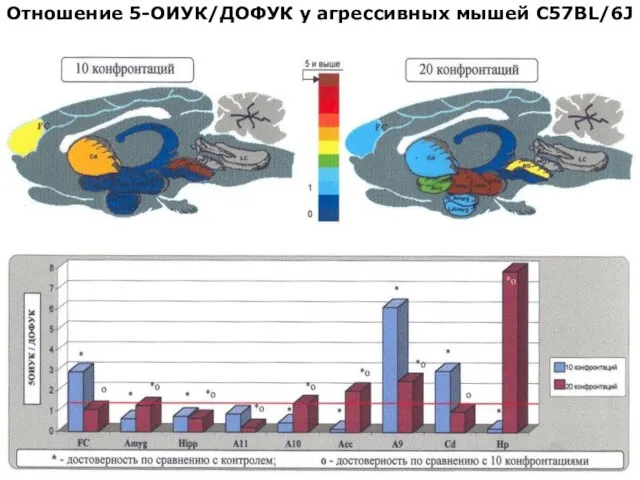
- 27. Отношение 5-ОИУК/ДОФУК у агрессивных мышей С57BL/6J
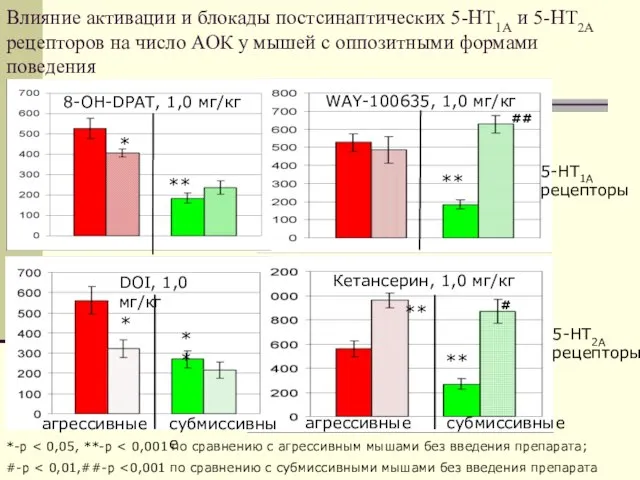
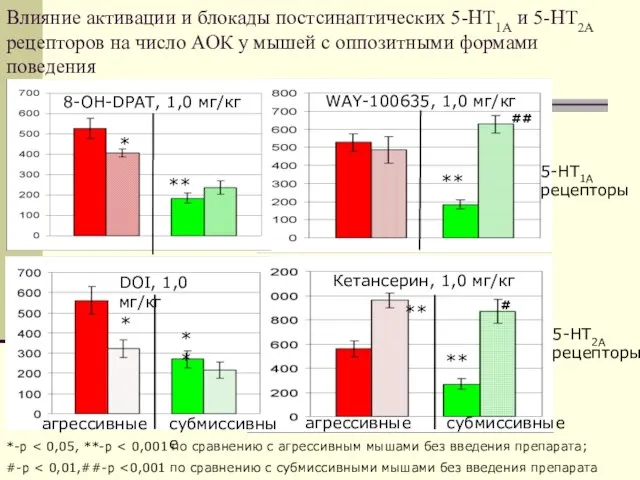
- 28. Влияние активации и блокады постсинаптических 5-НТ1А и 5-НТ2А рецепторов на число АОК у мышей с оппозитными
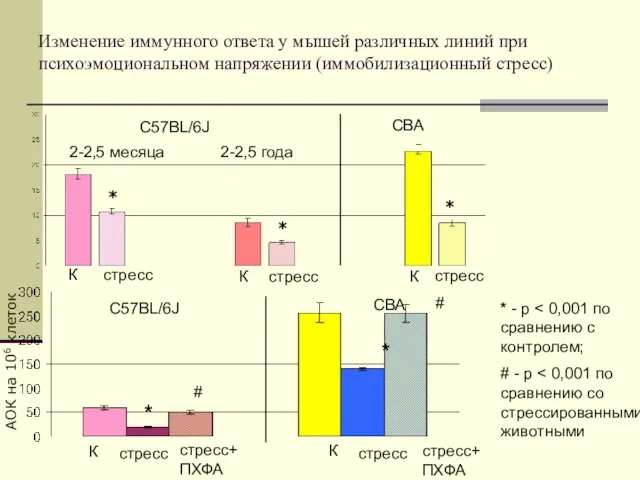
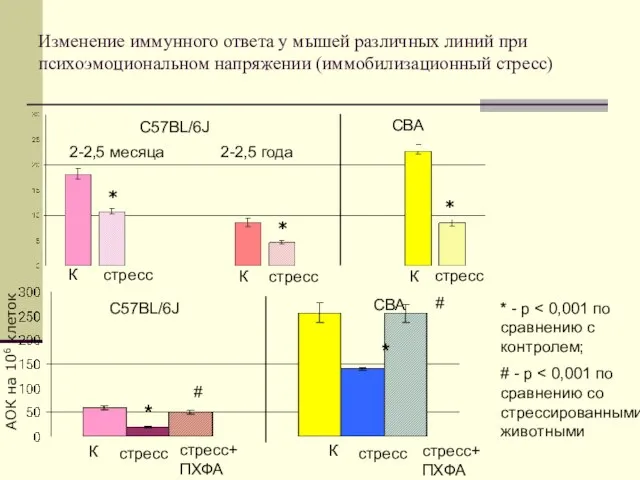
- 29. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (иммобилизационный стресс) С57BL/6J СВА 2-2,5 месяца
- 30. Костный мозг – центральный орган иммунитета, источник стволовых клеток -всех элементов иммунной системы – лимфоцитарного и
- 31. Клетки костного мозга вырабатывают группу регуляторных пептидов - миелопептидов, обладающих иммунорегуляторной (повышают антитлолообразование), дифференцировочной (влияют на
- 32. Серамиил –иммуномодулятор с противобактериальным действием на основе миелопида (МП) 3; Бивален иммуномодулятор с противоопухолевым действием на
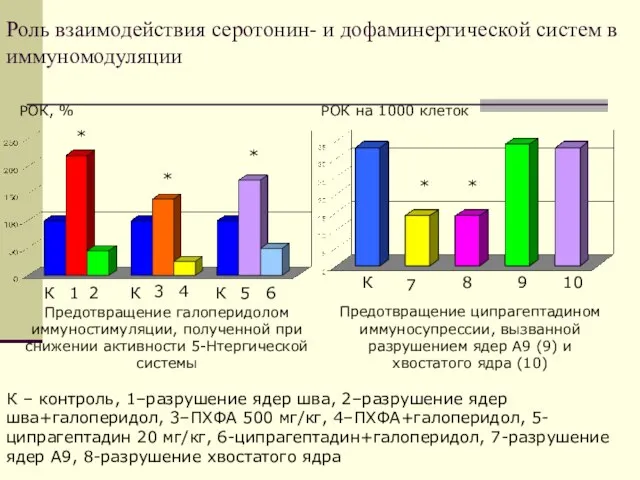
- 33. Роль взаимодействия серотонин- и дофаминергической систем в иммуномодуляции РОК, % РОК на 1000 клеток Предотвращение галоперидолом
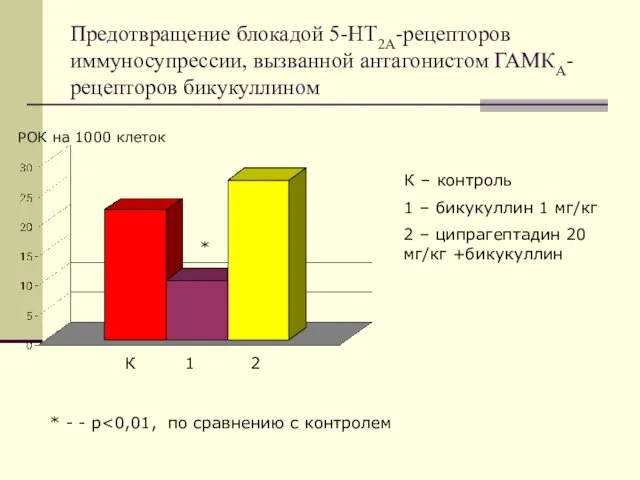
- 34. Предотвращение блокадой 5-НТ2А-рецепторов иммуносупрессии, вызванной антагонистом ГАМКА-рецепторов бикукуллином РОК на 1000 клеток К 1 2 К
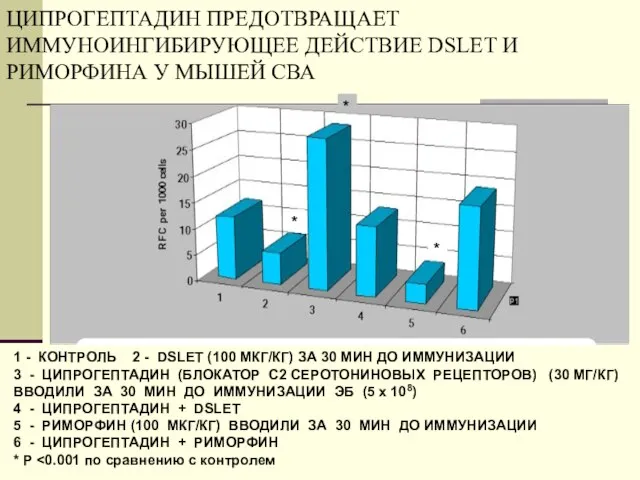
- 35. ЦИПРОГЕПТАДИН ПРЕДОТВРАЩАЕТ ИММУНОИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ DSLET И РИМОРФИНА У МЫШЕЙ СВА 1 - КОНТРОЛЬ 2 - DSLET
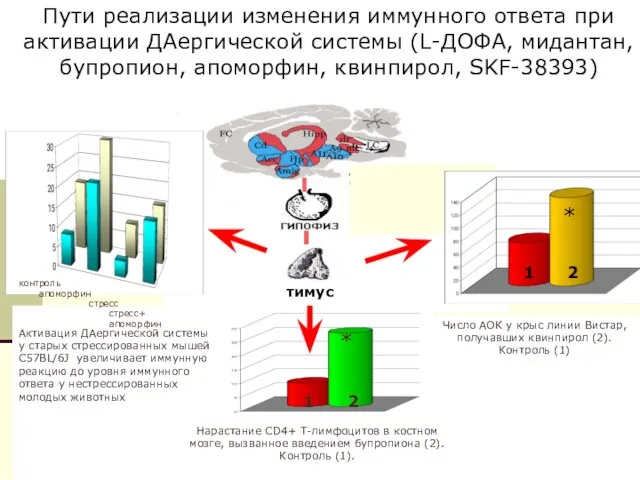
- 36. Активация ДАергической системы у старых стрессированных мышей C57BL/6J увеличивает иммунную реакцию до уровня иммунного ответа у
- 37. Изменение числа CD4+ и CD8+Т-клеток в костном мозге у агрессивных и субмиссивных неиммунизированных мышей линии C57BL/6J
- 40. Отношение 5-ОИУК/ДОФУК у агрессивных мышей С57BL/6J
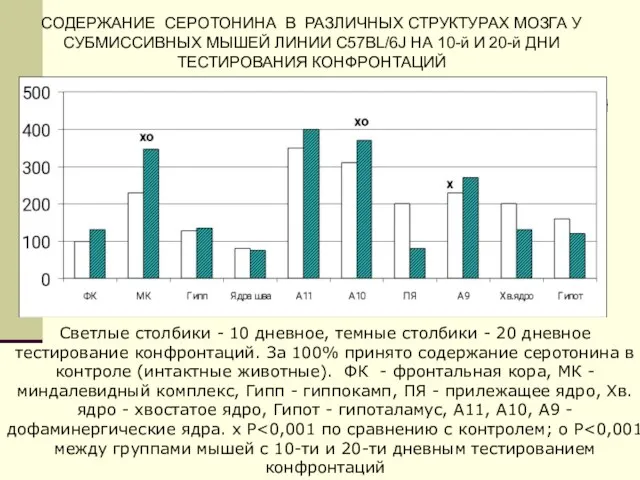
- 41. СОДЕРЖАНИЕ СЕРОТОНИНА В РАЗЛИЧНЫХ СТРУКТУРАХ МОЗГА У СУБМИССИВНЫХ МЫШЕЙ ЛИНИИ C57BL/6J НА 10-й И 20-й ДНИ
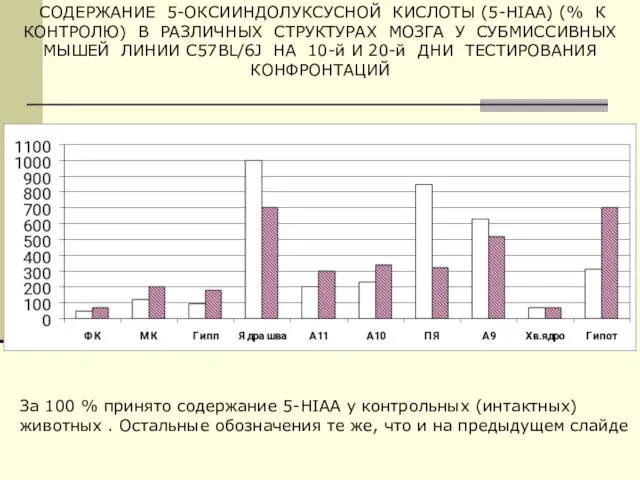
- 42. СОДЕРЖАНИЕ 5-ОКСИИНДОЛУКСУСНОЙ КИСЛОТЫ (5-HIAA) (% К КОНТРОЛЮ) В РАЗЛИЧНЫХ СТРУКТУРАХ МОЗГА У СУБМИССИВНЫХ МЫШЕЙ ЛИНИИ C57BL/6J
- 43. Отношение 5-ОИУК/ДОФУК у субмиссивных мышей С57BL/6J
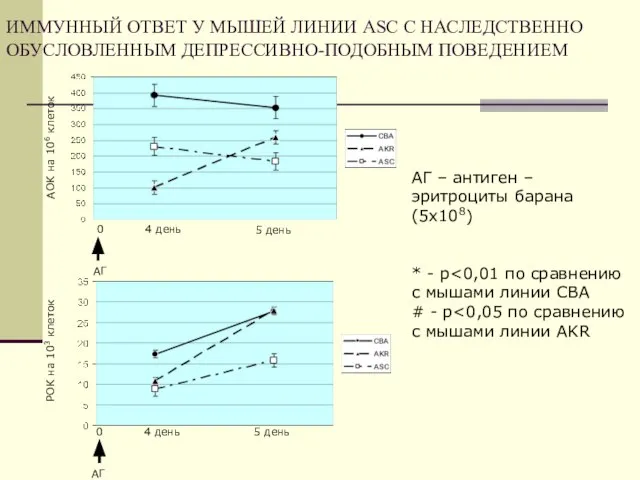
- 44. ИММУННЫЙ ОТВЕТ У МЫШЕЙ ЛИНИИ ASC С НАСЛЕДСТВЕННО ОБУСЛОВЛЕННЫМ ДЕПРЕССИВНО-ПОДОБНЫМ ПОВЕДЕНИЕМ АОК на 106 клеток 4
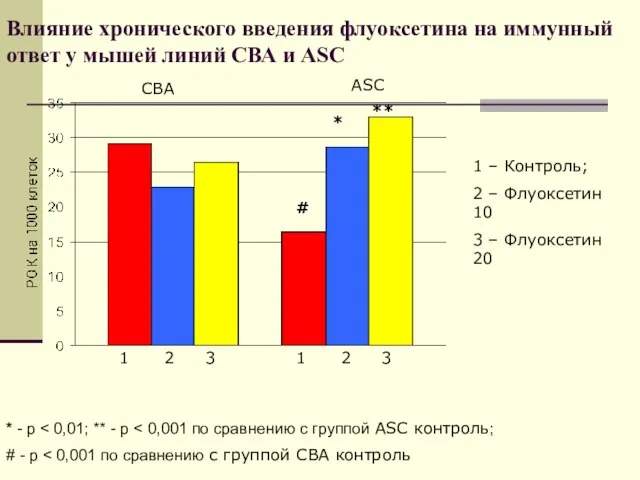
- 45. Влияние хронического введения флуоксетина на иммунный ответ у мышей линий СВА и ASC * ** #
- 46. Изменение иммунного ответа у мышей различных линий при психоэмоциональном напряжении (иммобилизационный стресс) С57BL/6J СВА 2-2,5 месяца
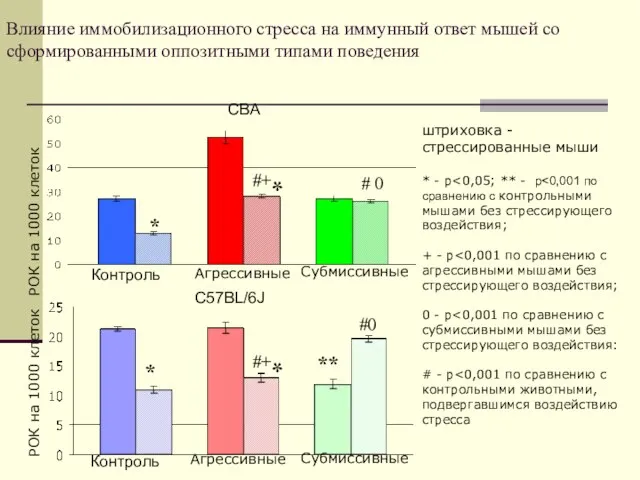
- 47. Влияние иммобилизационного стресса на иммунный ответ мышей со сформированными оппозитными типами поведения *+# Контроль Агрессивные Субмиссивные
- 48. Влияние активации и блокады постсинаптических 5-НТ1А и 5-НТ2А рецепторов на число АОК у мышей с оппозитными
- 50. Скачать презентацию
















 Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі
Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі Строение атома
Строение атома Срез знаний по химии
Срез знаний по химии Алкины
Алкины Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Использование технологии критического мышления на уроках химии
Использование технологии критического мышления на уроках химии Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар
Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар Эмульсии и эмульгаторы
Эмульсии и эмульгаторы Введение в биохимию. Значение биохимии для врача. Химия белка
Введение в биохимию. Значение биохимии для врача. Химия белка Важнейшие минералы
Важнейшие минералы Получение олефинов пиролизом углеводородов
Получение олефинов пиролизом углеводородов Получение фосфорной кислоты
Получение фосфорной кислоты Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть
Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть  Азотные удобрения
Азотные удобрения Атом. Будова атома
Атом. Будова атома Химическая кинетика и катализ
Химическая кинетика и катализ Альдегиды
Альдегиды зубные пасты сравнительная характеристика
зубные пасты сравнительная характеристика Очистка белков (Разделение белков из гетерогенной белковой смеси)
Очистка белков (Разделение белков из гетерогенной белковой смеси) Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В.
Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В. Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Radiation dosimetry
Radiation dosimetry VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии
VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Ионы. Проверочная работа
Ионы. Проверочная работа