Содержание
- 3. Строение атома Лекция 1 Национальный исследовательский университет МЭИ Кафедра Химии и электрохимической энергетики Григорьева Оксана Юрьевна
- 4. Химия – дисциплина в МЭИ. Строение атома. Квантово-механические представления. Квантовые числа. План лекции
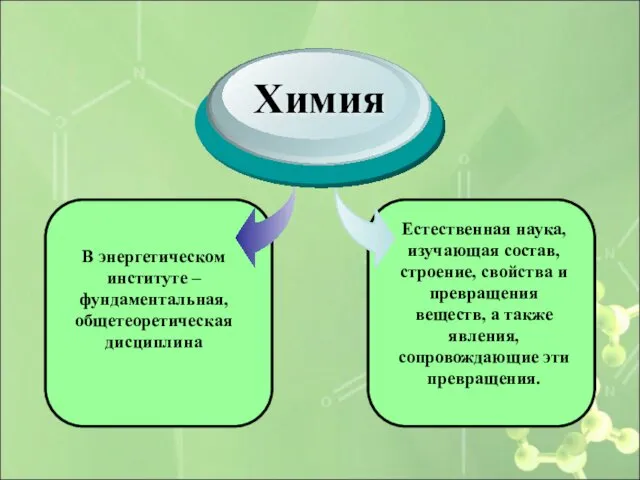
- 5. В энергетическом институте – фундаментальная, общетеоретическая дисциплина Химия Естественная наука, изучающая состав, строение, свойства и превращения
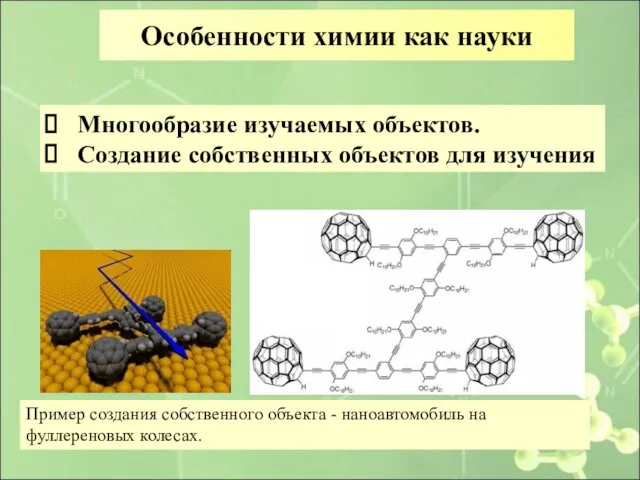
- 7. Особенности химии как науки Многообразие изучаемых объектов. Создание собственных объектов для изучения Пример создания собственного объекта
- 9. Масштабы химии и физики
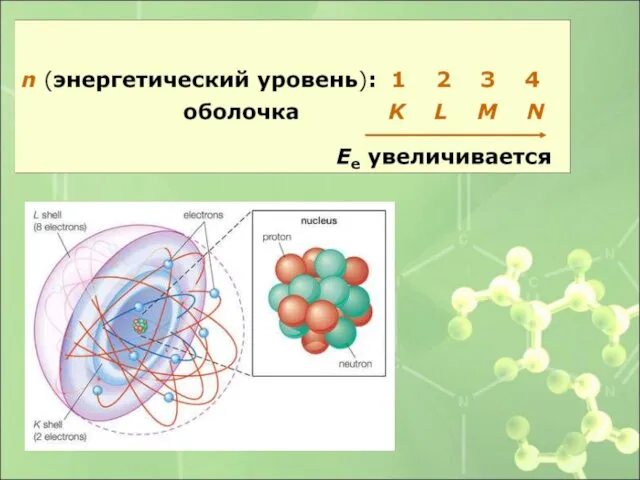
- 10. Электронное строение атома Джозеф-Джон Томсон 1897г - открытие электрона 1904г - модель строения атома (пудинг с
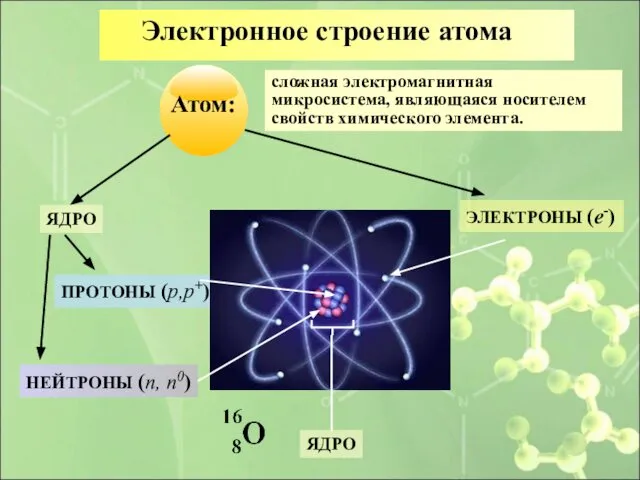
- 11. Электронное строение атома сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента. ЯДРО ЭЛЕКТРОНЫ (e-) ПРОТОНЫ (p,p+)
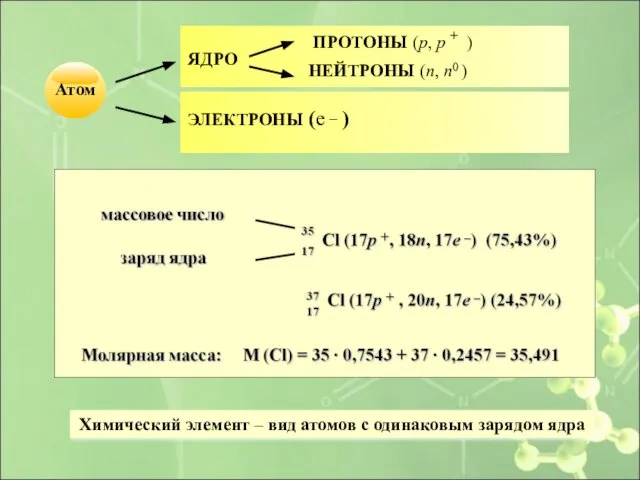
- 12. Химический элемент – вид атомов с одинаковым зарядом ядра
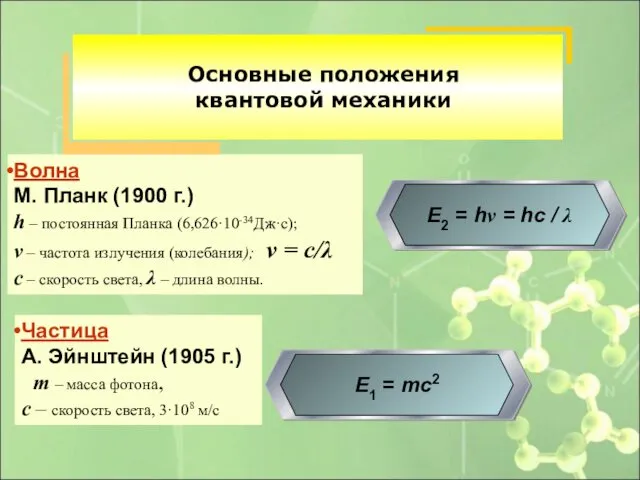
- 13. основана на представлении о квантовании энергии, волновом характере движения микрообъектов и вероятностном методе описания их движения.
- 14. Частица А. Эйнштейн (1905 г.) m – масса фотона, с – скорость света, 3·108 м/с Волна
- 15. Луи де Бройль (1924 г.) Поведение движущихся микрообъектов (в том числе и электронов) – одновременное проявление,
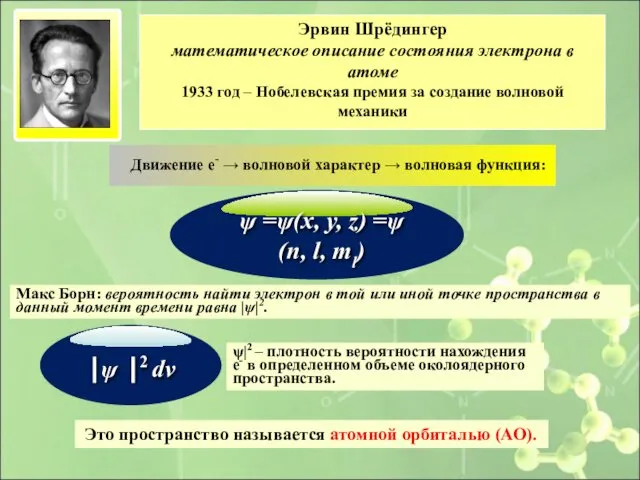
- 16. Точное нахождение частицы (электрона) заменяется понятием статистической вероятности нахождения ее в определенном объеме (околоядерного) пространства.
- 17. Движение е- → волновой характер → волновая функция: Это пространство называется атомной орбиталью (АО). Эрвин Шрёдингер
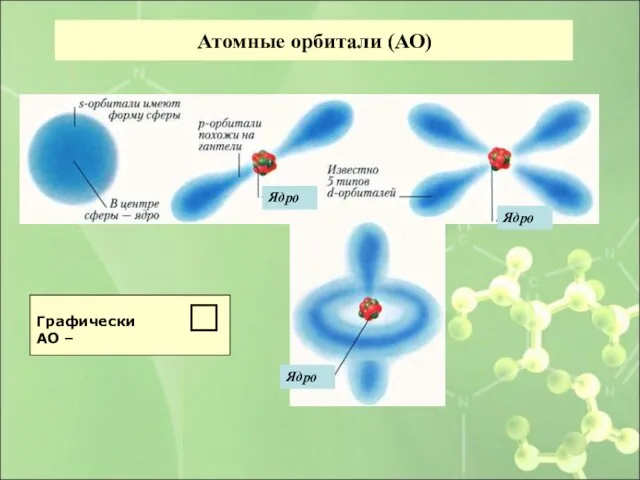
- 18. Атомные орбитали (АО)
- 19. 1. Определяет – энергию электрона – энергетический уровень 2. Показывает – размер электронного облака (орбитали) 3.
- 21. 1. Определяет – орбитальный момент количества движения электрона 2. Показывает – форму орбитали 3. Принимает значения
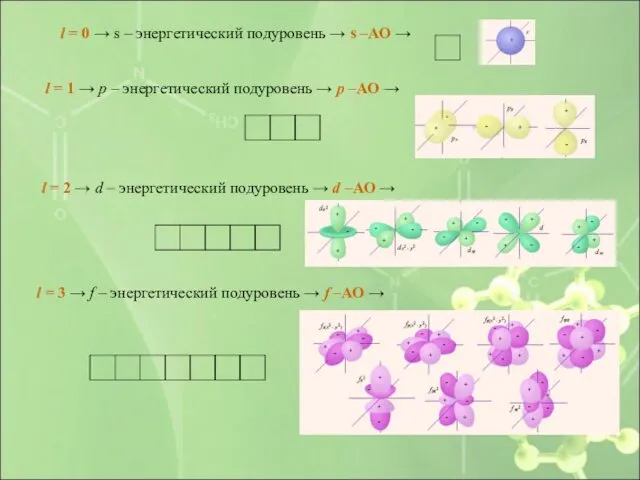
- 22. l = 0 → s – энергетический подуровень → s –АО → l = 1 →
- 23. Каждому n соответствует определенное число значений l → → каждый энергетический уровень расщепляется на энергетические подуровни.
- 24. III. Магнитное квантовое число ml 1. Определяет – значение проекции орбитального момента количества движения электрона на
- 25. Любому значению l соответствует (2l + 1) значений ml , т. е. (2l + 1) возможных
- 26. Все орбитали, принадлежащие одному подуровню, имеют одинаковую энергию и называются вырожденными. Вывод: АО характеризуется определенным набором
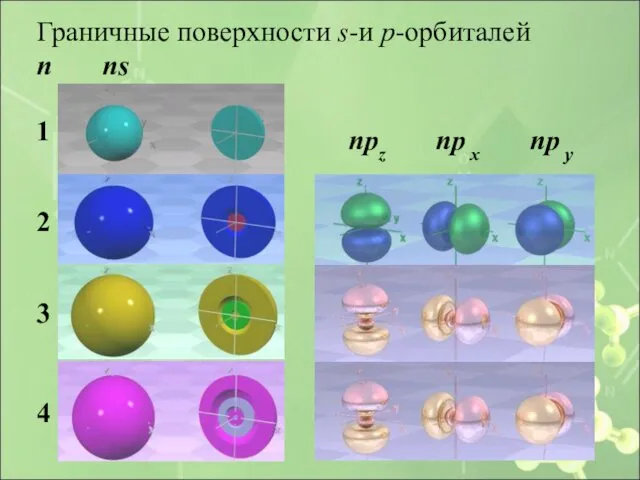
- 27. Граничные поверхности s-и p-орбиталей n ns npz np x np y
- 28. Граничные поверхности d- и f-орбиталей ndx2-y2, ndz2, ndxy, ndxz, ndyz 3 4 4fy3, 4fx3, 4fz3, 4fx(z2
- 29. IV. Cпиновое квантовое число ms 1. Определяет – собственный угловой момент количества движения электрона, связанный с
- 30. Состояние любого электрона в атоме может быть полностью охарактеризовано определенным набором из четырех рассмотренных квантовых чисел.
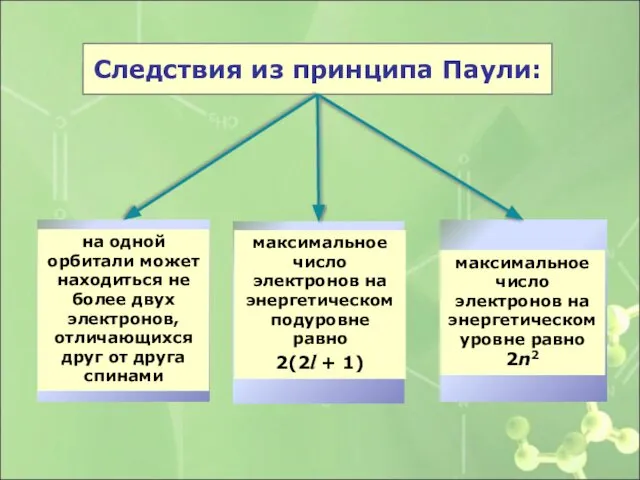
- 31. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были
- 32. Следствия из принципа Паули: на одной орбитали может находиться не более двух электронов, отличающихся друг от
- 33. 1-ое следствие: на одной орбитали может находиться не более двух электронов, отличающихся друг от друга спинами:
- 34. 2-е следствие: максимальное число электронов на энергетическом уровне равно 2n2 n = 3; 2·32 = 18
- 35. 3-ое следствие: максимальное число электронов на энергетическом подуровне равно 2(2l + 1). р-подуровень: l = 1;
- 36. Электроны в атоме (основное состояние) распределяются в соответствии с принципом минимальной энергии. Распределение электронов в атоме
- 37. Правило Клечковского (частный случай принципа наименьшей энергии) : – электроны размещаются последовательно на орбиталях, характеризуемых возрастанием
- 38. Значения суммы (n+l) для различных орбиталей номер энергетического уровня количество электронов на подуровне
- 39. Заполнение однотипных АО происходит по правилу Хунда. Σms = (½ + ½) Правило Хунда: 1 2
- 40. Способы составления схем распределения электронов в атоме: В виде формул электронных конфигураций: Пример1: 19K 1s22s22p63s23p64s1 Ar
- 41. 2. В виде графических формул АО Пример: 8О 1s22s22p4
- 43. Скачать презентацию





























 Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД)
Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД) Физические свойства природного газа. Фазовое состояние
Физические свойства природного газа. Фазовое состояние Biochemistry of thyroid hormones
Biochemistry of thyroid hormones Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров
Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров Окислительный стресс
Окислительный стресс Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Химическая картина мира
Химическая картина мира Презентация по Химии "8 класс Обобщение знаний по теме СЛОЖНЫЕ ВЕЩЕСТВА" - скачать смотреть бесплатно
Презентация по Химии "8 класс Обобщение знаний по теме СЛОЖНЫЕ ВЕЩЕСТВА" - скачать смотреть бесплатно Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов
Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов Харчові добавки
Харчові добавки  Презентация по Химии "ХЛОР - ФИЗИОЛОГИЧЕСКАЯ И ПАТОЛОГИЧЕСКАЯ РОЛЬ В ОРГАНИЗМЕ ЧЕЛОВЕКА" - скачать смотреть бесплатно
Презентация по Химии "ХЛОР - ФИЗИОЛОГИЧЕСКАЯ И ПАТОЛОГИЧЕСКАЯ РОЛЬ В ОРГАНИЗМЕ ЧЕЛОВЕКА" - скачать смотреть бесплатно Введение. Классификация минеральных удобрений
Введение. Классификация минеральных удобрений Химические методы анализа
Химические методы анализа Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Презентация по химии Хлороводород. Соляная кислота.
Презентация по химии Хлороводород. Соляная кислота.  Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Получение витаминов
Получение витаминов Русская живопись 17 века
Русская живопись 17 века  Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф
Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф Химические уравнения
Химические уравнения Запобігання виникнення горіння засобами, що розбавлюють та інгібують
Запобігання виникнення горіння засобами, що розбавлюють та інгібують Синтетические полимеры. Искусственные полимерные материалы
Синтетические полимеры. Искусственные полимерные материалы  Презентация по Химии "Нитраты в овощах" - скачать смотреть
Презентация по Химии "Нитраты в овощах" - скачать смотреть  Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.