Содержание
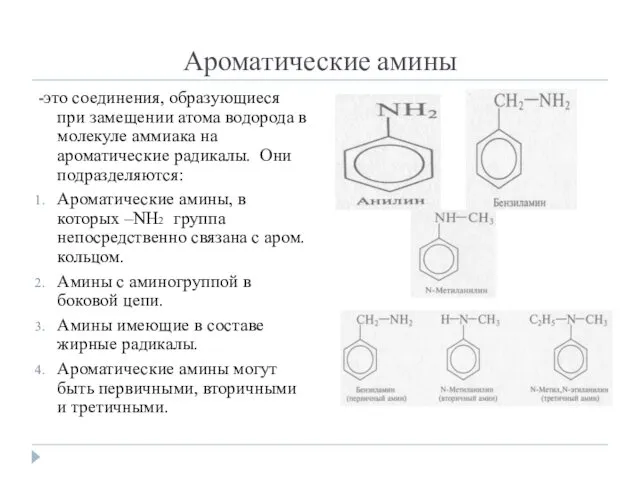
- 2. Ароматические амины -это соединения, образующиеся при замещении атома водорода в молекуле аммиака на ароматические радикалы. Они
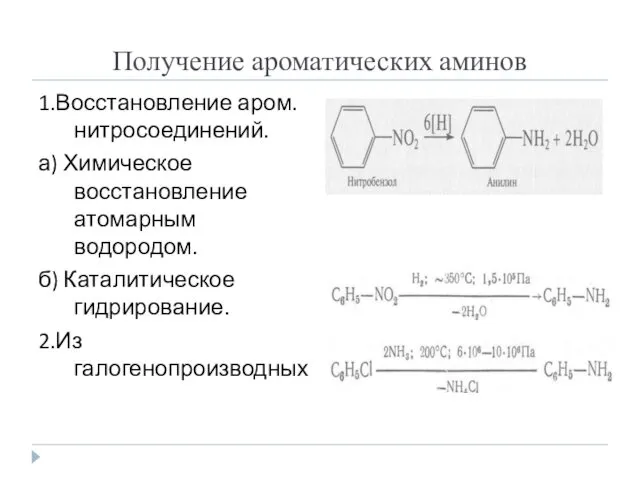
- 3. Получение ароматических аминов 1.Восстановление аром. нитросоединений. а) Химическое восстановление атомарным водородом. б) Каталитическое гидрирование. 2.Из галогенопроизводных
- 4. Получение вторичных и третичных аминов Ar2NH – чисто ароматические вторичные амины (Ar)3N – чисто ароматические третичные
- 5. Физические свойства Ароматические амины – жидкости или твердые вещества со специфическим неприятным запахом. Это полярные соединения,
- 6. Химические свойства Кислотные свойства Амины являются слабыми кислотами. Подобно аммиаку, они как кислоты слабее спиртов, но
- 7. Химические свойства Основность аминов Подобно аммиаку, амины реагируют с кислотами, проявляя основные свойства. Соли аммония (кроме
- 8. Алкилирование (реакция Гофмана) Получение алкильных производных аминов замещением водородных атомов аминогруппы алкильными остатками. Наиболее важным производным
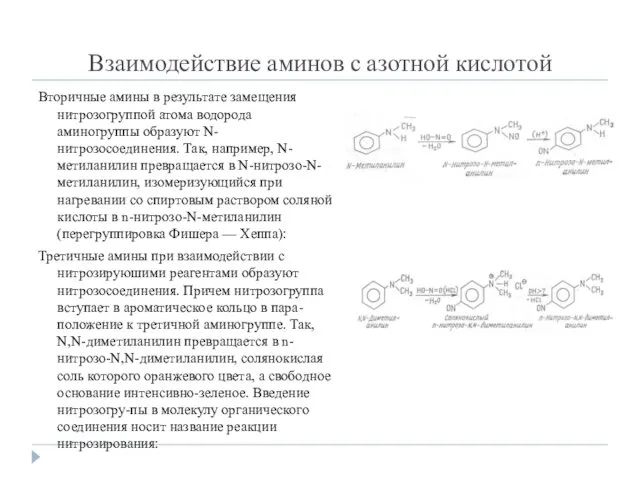
- 9. Взаимодействие аминов с азотной кислотой Азотистая кислота не существует в свободном виде. Она образуется при взаимодействии
- 10. Взаимодействие аминов с азотной кислотой Вторичные амины в результате замещения нитрозогруппой атома водорода аминогруппы образуют N-нитрозосоединения.
- 11. Галогенирование Галогенирование. При действии на анилин бромной водой быстро выпадает беловато-желтый осадок 2,4,6-триброманилина. Активирующее влияние аминогруппы
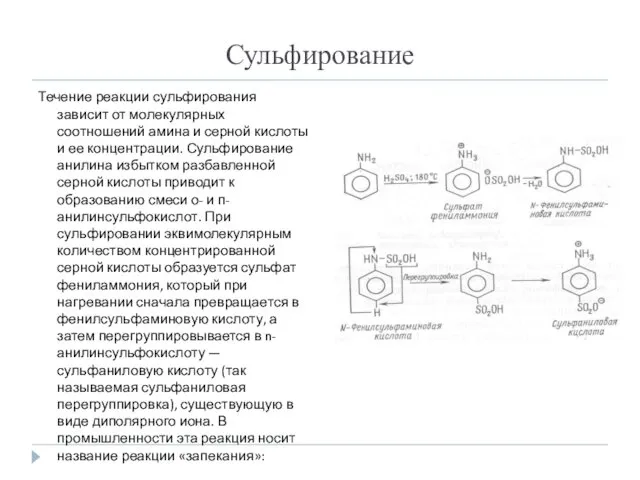
- 12. Сульфирование Течение реакции сульфирования зависит от молекулярных соотношений амина и серной кислоты и ее концентрации. Сульфирование
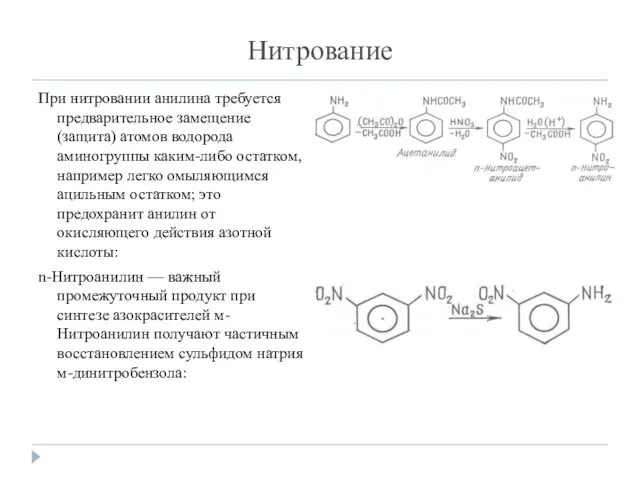
- 13. Нитрование При нитровании анилина требуется предварительное замещение (защита) атомов водорода аминогруппы каким-либо остатком, например легко омыляющимся
- 15. Скачать презентацию







 Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті Химия, как наука. Основные понятия и законы
Химия, как наука. Основные понятия и законы Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар
Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар Текстовые задачи в ЕГЭ Задачи на проценты В12
Текстовые задачи в ЕГЭ Задачи на проценты В12 Анодирование — процесс создания оксидной плёнки на поверхности некоторых металлов
Анодирование — процесс создания оксидной плёнки на поверхности некоторых металлов Секреты чая в пакетиках
Секреты чая в пакетиках 11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова
11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова  Презентация на тему: Выполнила: Елисеева Е. учащаяся 10 класса Сергиевской СОШ № 1
Презентация на тему: Выполнила: Елисеева Е. учащаяся 10 класса Сергиевской СОШ № 1 Дистилляция в химической промышленности
Дистилляция в химической промышленности Химия d -элементов
Химия d -элементов Вольфрам
Вольфрам Органічна хімія і здоров'я людини
Органічна хімія і здоров'я людини Электролиз раствора щёлочи с использованием железного анода
Электролиз раствора щёлочи с использованием железного анода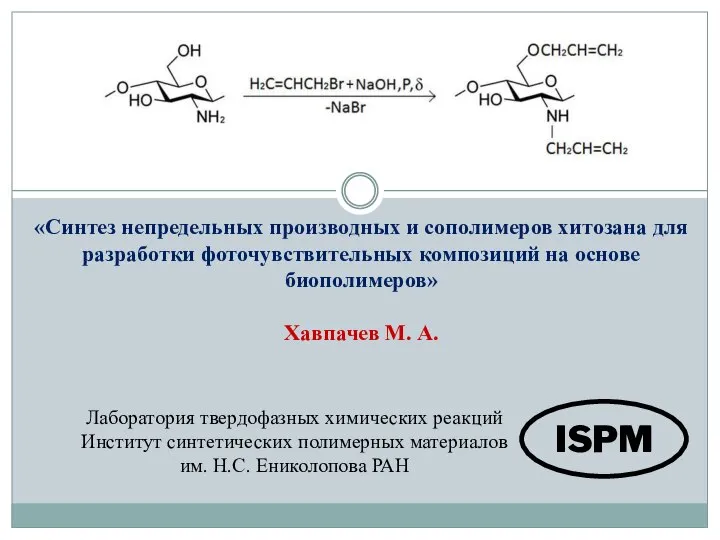 Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров
Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами
Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами Качественный химический анализ воды на определение металлов (железо, мышьяк, свинец) и микроэлементов (фтор, йод)
Качественный химический анализ воды на определение металлов (железо, мышьяк, свинец) и микроэлементов (фтор, йод) Что такое нефть и как она появилась?
Что такое нефть и как она появилась? Микроэлементы и здоровье человека
Микроэлементы и здоровье человека Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі
Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород
Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород Закономерности управления простым обратимым гомогенным процессом
Закономерности управления простым обратимым гомогенным процессом Электронная конфигурация атома
Электронная конфигурация атома Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Hydrogen
Hydrogen Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Презентация по химии Аминокислоты и история их открытия
Презентация по химии Аминокислоты и история их открытия  Olbaltumvielas
Olbaltumvielas