Содержание
- 2. Демокрит (около 460 до н.э— около 360 до н. э.) древнегреческий философ. Основоположник атомистического учения. Ввел
- 3. М.В. Ломоносов (1711-1765) Вошёл в науку как первый химик, обосновал учение об атомах и молекулах, дал
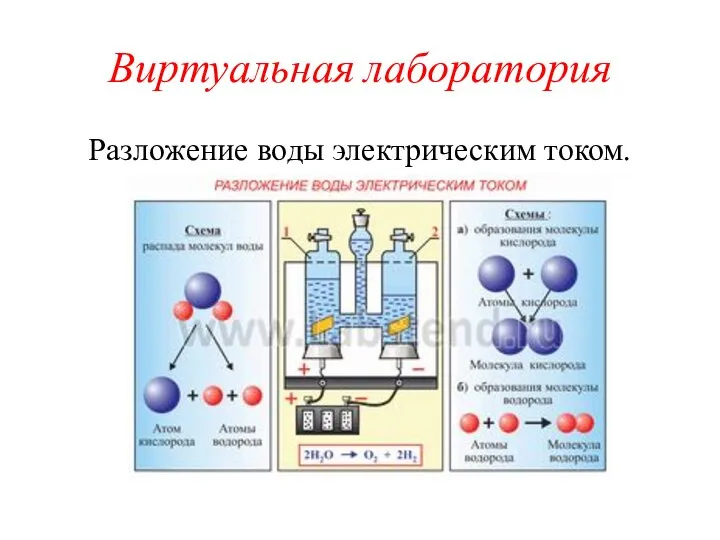
- 4. Виртуальная лаборатория Разложение воды электрическим током.
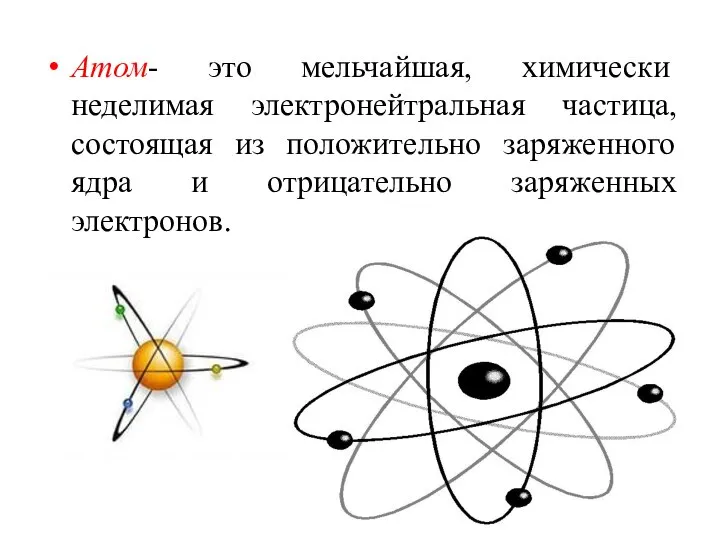
- 5. Атом- это мельчайшая, химически неделимая электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
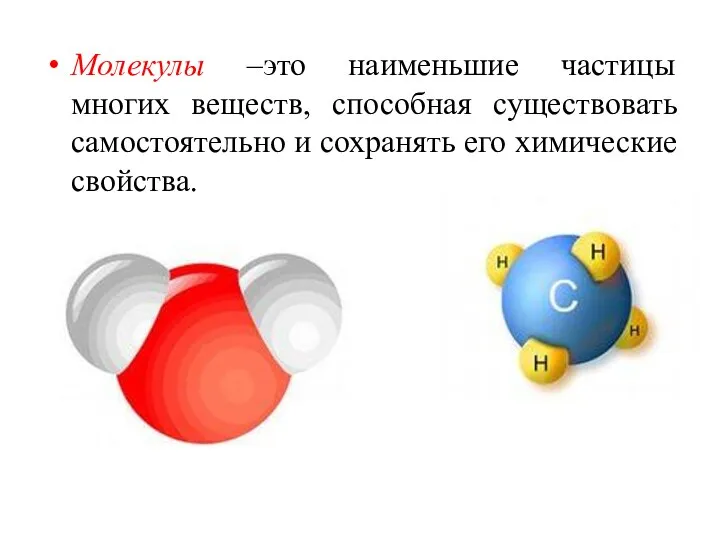
- 6. Молекулы –это наименьшие частицы многих веществ, способная существовать самостоятельно и сохранять его химические свойства.
- 7. Положения атомно-молекулярного учения 1. Вещества состоят из атомов; 2. При взаимодействии атомов образуются простые и сложные
- 8. Тема урока: Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток.
- 9. Агрегатные состояния вещества ЖИДКОЕ ТВЕРДОЕ ГАЗООБРАЗНОЕ Вода tпл=0 ° C tкип=100 ° C
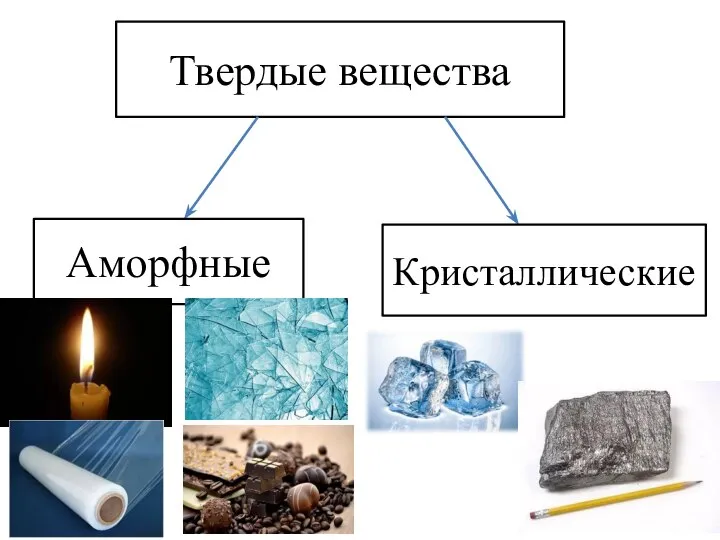
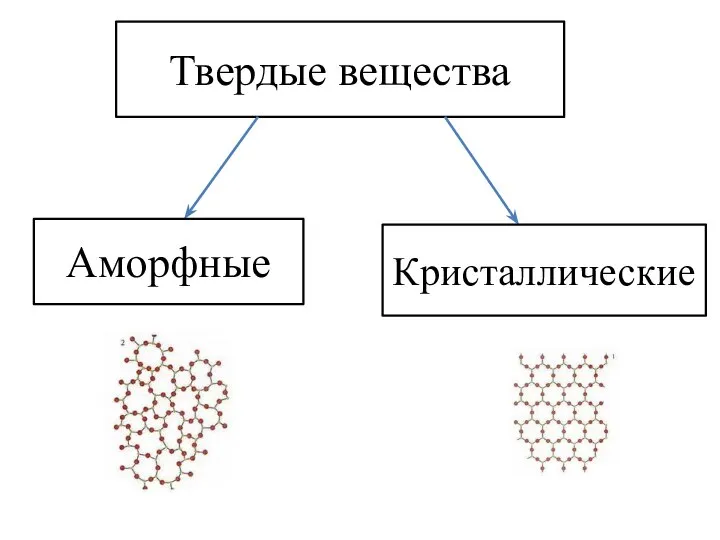
- 11. Твердые вещества Аморфные Кристаллические
- 12. Твердые вещества Аморфные Кристаллические
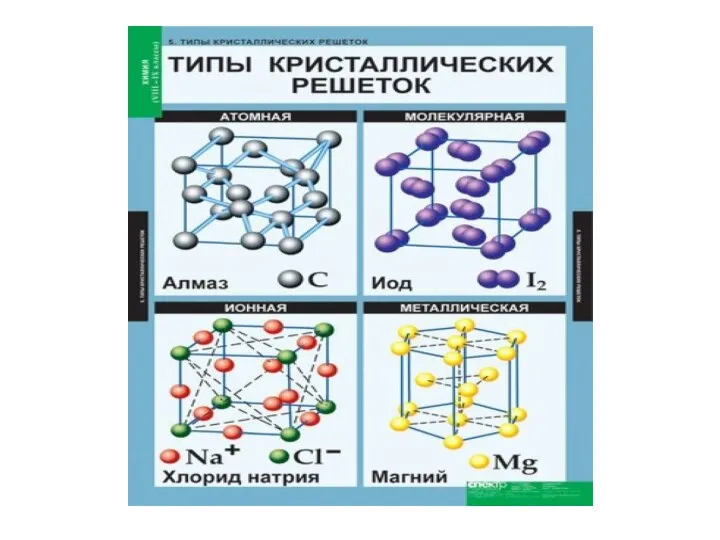
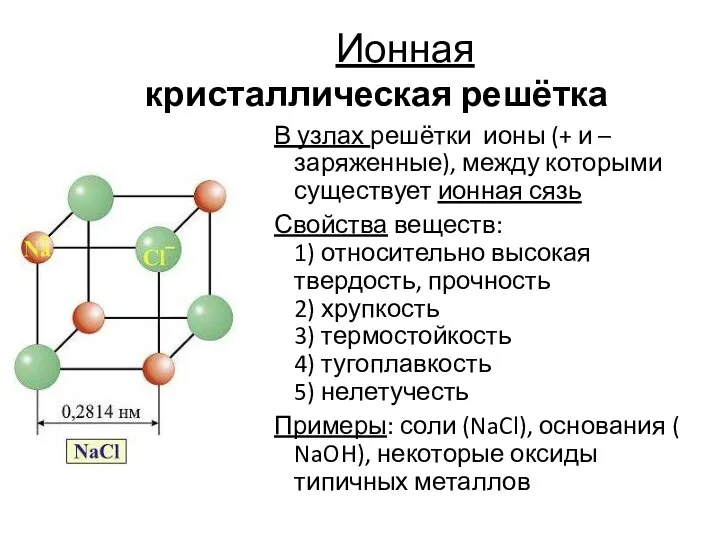
- 16. Ионная кристаллическая решётка В узлах решётки ионы (+ и – заряженные), между которыми существует ионная сязь
- 17. Атомная кристаллическая решётка В узлах решётки отдельные атомы. Химическая связь ковалентная Свойства веществ: 1) высокая твердость,
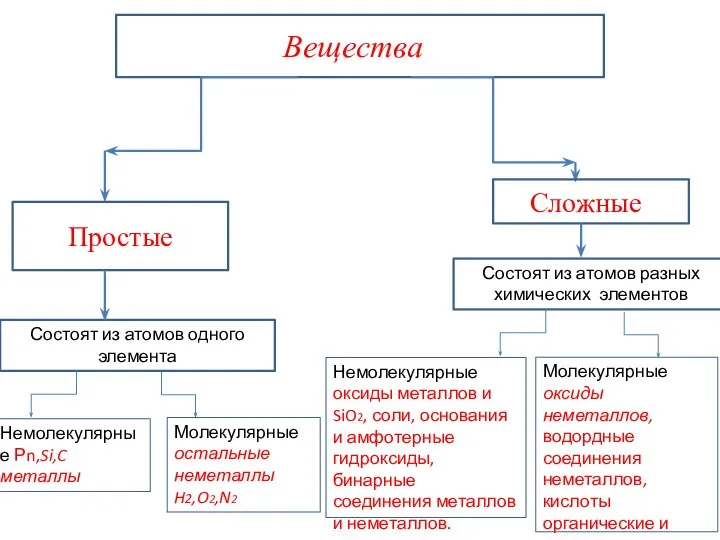
- 20. Вещества бывают молекулярного и немолекулярного строения. Молекулярные вещества-это вещества, мельчайшими структурными частицами которых являются молекулы. Например:
- 21. Молекулярные вещества имеют: Низкие температуры плавления и кипения; Находятся в стандартных условиях в твердом, жидком или
- 22. !!! К молекулярным веществам относятся: большинство простых веществ неметаллов: О2, S8 ,P4, H2, N2, Cl2 соединения
- 23. Немолекулярные вещества- это вещества, мельчайшими структурными частицами которых являются атомы или ионы. Немолекулярные вещества : находятся
- 24. К немолекулярным веществам относятся: -простые вещества металлы и их сплавы: Cu, Na, Fe; -соединения металлов с
- 25. Состоят из атомов одного элемента Немолекулярные Рn,Si,C металлы Молекулярные оксиды неметаллов, водордные соединения неметаллов, кислоты органические
- 26. Получение сульфида железа Виртуальная лаборатория
- 27. Сопоставление Смесь Вещества можно смешать в любых массовых отношениях, т.е. состав смесей переменный . Вещества водящие
- 28. Закрепление 1. Допишите приведенные ниже предложения, заменив многоточия подходящими по смыслу понятиями «химический элемент», «атом», «молекула»:
- 29. 3. Из приведенного перечня: сера, железо, сульфид железа, вода дистиллированная, вода минеральная, вода речная — выпишите
- 31. Скачать презентацию




















 Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Кремний – бог неорганической природы
Кремний – бог неорганической природы Неметаллы: общая характеристика
Неметаллы: общая характеристика Новые катализаторы
Новые катализаторы Презентация по Химии "Пищевые добавки. Е - коды" - скачать смотреть
Презентация по Химии "Пищевые добавки. Е - коды" - скачать смотреть  Инструментальные методы анализа
Инструментальные методы анализа Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В
Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Презентация по химии Фосфор
Презентация по химии Фосфор  Аллотропия углерода
Аллотропия углерода Презентация по Химии "Презентація на тему : «Фосфатні добрива у нашому житті»" - скачать смотреть бесплатно
Презентация по Химии "Презентація на тему : «Фосфатні добрива у нашому житті»" - скачать смотреть бесплатно Строение атома. Периодический закон
Строение атома. Периодический закон Углеводы. Моносахариды. Дисахариды
Углеводы. Моносахариды. Дисахариды Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Производные дигидропиридина (нефидипин, амлодипин, форидон) и пиридина (супрастин)
Производные дигидропиридина (нефидипин, амлодипин, форидон) и пиридина (супрастин) Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Етиловий спирт та його вплив на організм людини
Етиловий спирт та його вплив на організм людини Машиностроительные материалы
Машиностроительные материалы Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15)
Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15) Структура периодической системы химических элементов
Структура периодической системы химических элементов Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат
Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат